竹节参种质资源及育种研究进展
闵欣怡 侯 聪 吴田泽 郑雅芹 邓 港 刘 霞
(武汉理工大学化学化工与生命科学学院,武汉,430070)
竹节参来源于五加科人参属药用植物竹节参PanaxjaponicusC.A.Meyer.,以干燥根茎入药,又称竹节三七、竹节人参、白三七等[1]。它具有人参和三七的特点,具有散瘀、止血、消肿、祛痰、止咳等作用,被称为“草药之王”。药理研究表明,竹节参对心血管系统、中枢神经系统、免疫系统和消化系统均有保护作用[2-9]。长期以来,竹节参的主要来源是野生资源。由于滥采,其栖息地遭到严重破坏,导致竹节参野生资源濒临灭绝。
1 资源分布
竹节参分布区域随时间变化较大。《中国植物志》中记载竹节参广泛分布于我国黄河流域以南湿润半湿润区,分布于中国东北以及云南、贵州、陕西、湖北、四川、湖南、江西、浙江等省的北纬31°附近的地区,越南、尼泊尔、缅甸、日本和朝鲜也有分布[10]。目前,野生竹节参资源匮乏,主要分布于西南地区以及湖北[11]。见表1。
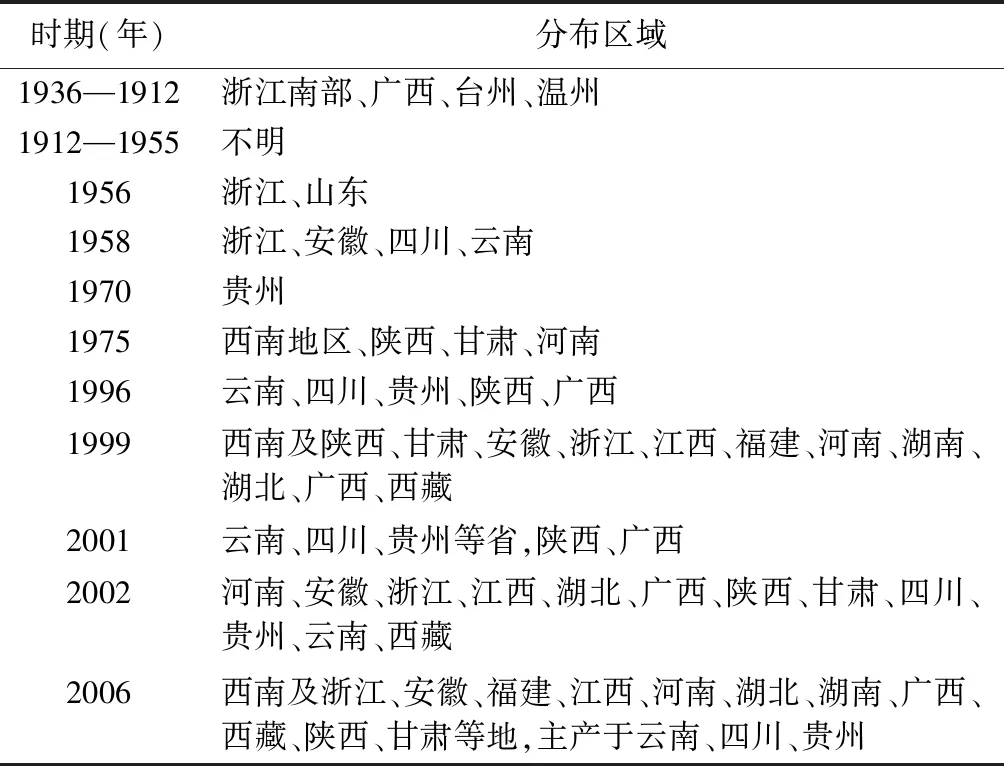
表1 竹节参分布区域变化
1.1 野生资源 竹节参野生资源匮乏,一方面由于滥采滥挖,另一方面在于其生长的自然环境受到巨大威胁。在以往调查过的竹节参野生资源生长地区,近年来的调查显示,曾经野生竹节参的生长地区如今已经很难找到其生长踪迹[12-16]。
1.2 人工种植 竹节参目前的人工栽培技术仍处于刚起步阶段,相关专业技术人员较少,规模化种植基地极少,且缺乏标准化种植技术,导致目前竹节参种植产量少、效益低[17-21]。
2 种质鉴定
2.1 性状鉴定 竹节参产品略呈圆柱形,略呈弯曲状,有些带有肉质侧根。长度为5~22 cm,直径为0.8~2.5 cm。表面为黄色或黄褐色、粗糙,有致密的纵向皱纹和根的痕迹。有明显的节,节间长0.8~2 cm,每个切片有1个凹陷的茎痕。质地坚硬,切片呈黄白色至淡黄褐色,有黄色点状维管束排列成环状。无臭、味苦,后略甜[22]。
2.2 显微鉴定 竹节参横截面木栓层有2~10个细胞。皮层稍宽,有一些分泌道。维管束外韧型,形成层呈现环状。木质部多数排列成2~4组的径向链;木纤维通常为1~4束,有些还会有木化厚壁细胞存在。中央有髓质。薄壁细胞含有大量草酸钙簇晶体,直径17~70 μm,并含有淀粉粒。粉末是黄白色到黄棕色。木纤维直径约25 μm。草酸钙团簇更为常见,直径为15~70 μm。网孔或边缘口导管直径为20~70 μm。偶尔可见树脂束碎片,含有黄色的肿块物。木栓组织碎片细胞多呈现矩形或不规则形,壁厚,淀粉颗粒数量众多。
2.3 成分鉴定 Xie等[23]采用超高效液相色谱-四极飞行时间质谱(Ultra-high Performance Liquid Chromatography-Quadrupole Time of Flight Mass Spectrometry,UPLC-QTOFMS)和多元统计分析技术,对人参、三七、竹节参、西洋参和高丽参等5种药用人参进行了代谢产物分析。分析数据的主成分分析(Principal Component Analysis,PCA)表明,5种人参药材可分离为5组不同的植物化学物质。通过PCA的负荷图确定了导致这些变化的化学标志物,如人参皂苷Rf、20(S)-假人参皂苷F11、丙二酰-人参皂苷Rb1和人参皂苷Rb2,并通过飞行时间质谱对各化学物质的含量进行了初步鉴定,并基于参考标准进行了部分验证。结果表明,UPLC-QTOFMS对于快速分析草药和其他天然产品中存在的一组代谢物是可靠的,并且适用于区分具有相似化学成分的人参混品。
竹节参中主要含有皂苷、糖、多炔、氨基酸、挥发油和无机元素等6种化学成分[24],其中主要活性成分为皂苷。
2.3.1 皂苷 皂苷是人参中研究最多的成分,其含量随产地有很大的不同。竹节参以根茎入药,其中粗皂苷的含量约23.6%,皂苷含量约5%[25]。目前从人参中分离出40多种皂苷,根据其结构的不同分为齐墩果烷型、达玛烷型、奥寇梯木醇型及甾醇型。竹节参中皂苷类型以齐墩果烷型皂苷为主。见表2。
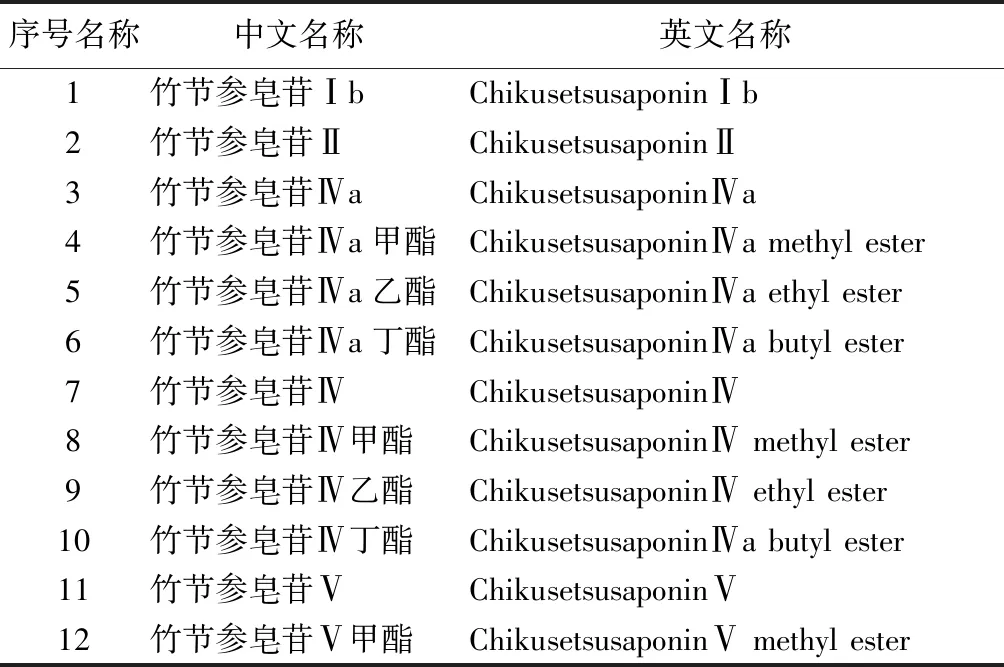
表2 齐墩果酸型化合物
2.3.2 糖 赵海霞等[26]测定了竹节参总糖含量、还原糖含量以及总多糖含量。见表3。Ohtani等[27]从日本生长的竹节参中和分离出了2种具有激活网状内皮系统作用的多糖:竹节参多糖(Tochibanan)A和B。陈洁[28]等利用液相色谱-高分辨傅里叶变换离子回旋共振质谱法和高效液相色谱(High Performance Liquid Chromatography,HPLC)-紫外检测器法定量定性了竹节参多糖组分中的单糖,是由D-葡萄糖、L-鼠李糖、D-半乳糖醛酸、D-半乳糖和阿拉伯糖组成的。

表3 竹节参糖类含量
2.3.3 含氮化合物 陈永波等[29]使用HPLC和红外(Infra-red,IR)光谱,在竹节参根茎中检测出天冬氨酸、酪氨酸、精氨酸、丙氨酸和赖氨酸等17种氨基酸,8种氨基化合物。
2.3.4 多炔类 人参属植物含有大量的C17多炔化合物[29],也能从竹节参中分离出来,其中3种多炔化合物首次在人参属植物中分离出来。
2.4 分子鉴定 由于土壤、气候、水等生长环境对人参生长状况的影响,仅依靠经验,通过性状鉴定人参相对困难。随着分子生物学的发展,中药鉴定开始进入更加科学和准确的阶段,人参的现代研究变得更加真实和可靠。Tautz等[30]首次提出使用DNA序列作为生物分类系统的主要平台。2003年,他首次提出了线粒体细胞色素C氧化酶亚基I(Cytochrome C Oxidase Subunit I,COI)的前半部分,作为DNA条形码的基础,期望编码所有生物物种,并将其命名为“DNA条形码”。2004年,生命条形码联盟(Consortium for the Barcode of Life,CBOL)正式成立,旨在开发一套标准的DNA条形码制备方法,建立一个全面的DNA条形码库。最近,生命条码项目进入了一个新的阶段,启动了国际生命条码(International Barcode of Life,iBOL)项目。iBOL是一个来自26个国家和地区的国际合作项目,旨在建立一个基于所有真核生物DNA条形码文库的自动识别系统。截至2012年9月生命条形码数据系统(The Barcode of Life Data System,BOLD,http://www.boldsystems.org/)数据库拥有2 410 651个标本记录,1 737 588个标本,160 117种生物,包括动物、真菌、植物和原生生物,最终目标是为全球生物鉴定活动提供数据支持和服务。
陈镜安等[31]利用ITS2序列对竹节参进行定向测序,从GenBank下载近缘种和掺假种的ITS2序列。对ITS2数据库进行裁剪,得到24个物种的102条序列。应用DAMBE程序检测ITS2序列的替代饱和。利用MEGA 6.06软件进行序列比对,计算GC含量,分析变异位点,估算种内和种间遗传距离,最终构建NJ树。分析结果显示,竹节参与其不相同的伪种或部分近缘种(秀丽假人参、三叶参、越南人参)之间存在较大差异。但该方法对竹节参及其部分近缘种(西洋参、人参、三七)的鉴别有一定的局限性。说明ITS2序列可作为竹节参及其不相同伪品鉴定的DNA条形码之一,为竹节参及其近缘种间遗传亲缘关系的鉴定、竹节参与不相同掺假品种的鉴别以及竹节参的临床安全性提供了依据。
3 遗传多样性
遗传多样性是生物多样性的一个重要组成部分,它是生物体进化和物种分化的来源。种内遗传多样性是学者们经常研究的遗传多样性。地球上所有生物体的遗传信息的总和是广泛的遗传多样性。
Choi等[32]通过140对引物的实验开发了70个表达序列Tag衍生的多态性简单序列重复标记。这70个标记在4个人参品种中均表现出可重复的多态性,其中19个标记在6个人参品种。这些标记在2个P之间杂交的F2群体中以1∶2∶1的孟德尔遗传方式分离。人参品种“Yunpoong”和“Chunpoong”,表明这些是可复制和遗传的可映射标记。利用基因型数据进行的系统发育分析显示有3个不同的类群:人参-竹节参分化枝、西洋参和三七,相似系数为0.70。竹节参与人参2个物种具有相似的遗传背景。人参品种分为3个小类群:一个独立品种“Chunpoong”,一个亚类群有3份材料,包括2个品种“Gumpoong”和“Yunpoong”以及一个长白种“Hwangsook”,另一个亚类群有2份材料,包括一个品种“Gopoong”和一个长白种“Jakyung”。每对引物产生1到4条带,表明人参基因组具有高度复制的古多倍体基因组结构。
程扬等[33]开发和鉴定了竹节参SSR分子标记,深入研究了竹节参遗传多样性。基于竹节参转录组数据,利用MISA软件对SSR序列进行搜索和分析。根据SSR两翼序列设计SSR引物,并对反应体系进行优化。以5个不同种群为模板,对SSR引物进行多态性检测。共发现12 244个SSR位点,分布在66 403个unigenes基因10 299个单基因中,SSR频率为15.51%。SSR重复序列最多的分别为AT/AT(44.87%)、AAG/CTT(24.00%)、AAAAT/ATTTT(19.28%)和AAAAAT/ATTTTT(6.54%)。最后,通过对竹节参样品的引物多态性检测,获得18对稳定的SSR引物。
竹节参SSR位点丰富而密集,为竹节参及其近缘种的分子鉴定和遗传多样性研究奠定了分子基础。
4 育种研究
4.1 繁殖方式 竹节参有无性繁殖和有性繁殖2种繁殖方式[34]。竹节参一般采用种子播种繁殖方法,可以在8月中旬,选择在年末生长强劲,无病虫害,大颗粒,成熟早的4年以上的植物果实收集种子,去掉果皮,用0.3%高锰酸钾溶液或3.5%~4%的甲醛水溶液浸泡10 min,冲洗后取出,再用湿沙保存,种子∶河沙为1∶4。在保存期间,应注意防止湿沙干燥。一般来说,湿沙子应该揉成一个球。保存好的种子也需要在播种前挑选好,除去小或者保存过程中有霉变或失水的种子,然后用上述方法进行1次消毒处理,即可播种。周益权等[35]对竹节参无性繁殖技术进行了研究,以不同位置育苗的人参为研究对象,研究了不同基质和顶芽保留对人参出苗和多芽形成的影响。结果表明,随着龄期的增加,出苗数量和出苗率降低;有机质含量高的基质可促进多芽的形成。顶芽的保留对竹节参复芽的形成有很大的影响。去顶芽处理显著提高了竹节参的复芽率,最高为30.00%。通过处理顶芽和增加基质养分可以提高竹节参的多梢发生率。陈士林等[36]在研究中公开了一种利用芽茎组织培养人参的方法,提高了竹节参人工栽培的成活率,增加竹节参产量的问题。
4.2 种植方法 林下栽培是竹节参种植生产的最重要的途径之一。根据徐燃等[37]的研究,竹节参生产基地应远离城市、公路、工业区及周边污染源,生产环境、空气质量、种植土壤、灌溉水质、地下水水质均符合现行国家标准,水资源水质、空气水质、土壤水质定期检测评价。根据周益权等[38]的研究,选择阔叶林或针宽混交天然次生林,远离重工业污染和没有化学除草剂、稀疏而高大的树木,在森林树冠下开垦;高封闭的针叶林或大量的竹鞭表土不适宜。选择阴坡或半阴坡,坡度为5%~25%的山坡中段种植。选择松散、肥沃、湿润、排水良好,表面腐殖质大于5 cm。气候寒冷潮湿,年平均气温约10 ℃,极端最高气温小于35 ℃,极端最低气温大于-12 ℃;10 ℃以上的年活动累积温度大于2 700 ℃,年平均降水量大于1 500 mm。每年9月初至10月底种植前,砍伐0.6~0.7 m距离茂密的树木和小灌木,清除1.5 m以下的杂草和灌木,清除林地清洁材料;准备深度25~35 cm,清除土壤屑,施用杀虫剂,使用有机肥,每隔667 m使用全腐猪、牛、羊粪施用2 000 kg,按自然地形逐耕混土,箱宽1~1.2 m,箱长1.2 m,开沟起垄深15~25 cm,宽25~35 m。竹节参苗体形态自然、根较长、无病、无机械损伤,单重量大于10 g,有发芽;第1种参苗为分苗,为根顶端,顶芽清晰生长良好(该苗保证第2年出苗),然后剪长2~4 cm。如果没有顶芽,可以根据根芽的痕迹将每段切成1个芽,在苗圃中栽培1年,然后进行下林移栽。第2种竹节参幼苗种植种子苗,种子幼苗大于2年生,单株重量在5 g以上,种植前用多菌灵溶液1∶800,或甲基溶液1∶800浸泡约45 min,或在块茎苗切口位置浸入植物灰分种植到林地。人工栽培竹节参可以保持丰富的营养,一般来说,野生竹节参的产量以及品质远低于栽培竹节参。
4.3 组织培养 竹节参的市场需求量日益增加,匮乏的野生资源无法满足市场需求,对人参资源育种,人工栽培是解决这一问题的重要途径,组织培养有利于实现规模、标准化种植,有利于种质资源的有效利用,可以解决育种时间、幼苗短缺等问题。罗正伟等[39]以人参胚、茎和叶为外植体,研究分离培养和植物再生技术,优化培养条件,应用正交法筛选竹节参最佳愈伤组织诱导分化培养基。
4.4 品质提升 竹节参的次生代谢产物作为主要有效成分,利用基因工程技术对其代谢途径进行定向调控,提升相关有效成分的产量,从而提高竹节参的产品品质。Rai等[40]描述了基于Illumina的RNA测序分析,以表征竹节参及其与其他人参属植物的比较RNA测序和从头转录组组装。竹节参共产生135 235个单基因,其中78 794个(58.24%)单基因被NCBI nr数据库注释。5种组织的转录组分析和基因本体富集分析结果表明,尽管整个过程在所有组织中都是均匀保守的。然而,每个组织都有几个独特的单基因,在所研究的组织中,叶子显示出最独特的单基因。对竹节参转录组与其他人参属物种的公开转录物组装,即人参、竹节参和西洋参在所有人参属物种中也表现出高度的序列相似性。竹节参转录组鉴定出编码三萜主链生物合成途径中所有酶的推定基因,并分别鉴定出24个和48个单基因,分别被注释为细胞色素P450(Cytochrome P450,CYP)和糖基转移酶(Glycosyltransferase,GT)。这些CYP和GT注释的单基因在所有人参属物种中都是保守的,并与参与三萜类主干生物合成途径的其他转录物共同表达。确定的单基因是参与三萜皂苷生物合成的有力候选基因,可以作为未来验证研究育种的基础。
Zhang等[41]对野生珠子参(竹节参的一种变种)的根茎节和节间进行了比较代谢产物和转录组分析,以揭示它们在三萜皂苷生物合成中的不同作用。结果表明,节点是根茎中人参皂苷合成的关键部位。节点中齐墩果酸型人参皂苷的含量远高于节间。大多数类异戊二烯生物合成相关基因在淋巴结中高度表达。此外,还发现候选尿苷二磷酸糖基转移酶(Uridine Diphosphate Glucuronosyltransferase,UGT)基因在节点和节间之间存在差异表达。这些均有助于更好地了解竹节参及其变种根茎中人参皂苷的代谢以及后续对相关基因进行调控以帮助品质的提升。
Tang等[42]通过比较竹节参茎尖的内部解剖结构、激素含量、淀粉含量和分子转录水平的差异,探讨了根状茎膨大的机制。Illumina测序产生了1 333个差异表达基因(Differentially Expressed Genes,DEGs),这些基因在2个样本之间差异表达。通路富集分析表明,参与淀粉和蔗糖代谢、二萜生物合成和植物激素信号转导通路的DEGs显著富集。此外,淀粉测定结果表明,膨胀部分的淀粉含量显著高于细长部分的淀粉含量。此外,激素测定结果表明,赤霉素A1(GA1)、赤霉素A53(GA53)、吲哚-3-乙酸(IAA)和茉莉酸(JA)含量负相关,而顺式玉米素(cZ)含量与根茎膨大正相关。结果筛选出了几个DEGs和潜在的根状茎膨大候选基因,为人参属植物膨大基因的鉴定以及后续提高产量等奠定了基础。
Xu等[43]利用代谢产物分析,分析显示齐墩果酸型和达马拉型皂苷在竹节参的3种组织(幼根组织、次根组织、老根组织)中分布不均。单分子实时(Single Molecule Real-time,SMRT)测序和下一代测序(Next Generation Sequencing,NGS)数据揭示了与这2种皂苷的产生相关的不同的组织特异性转录组模式。在共表达网络和层次聚类分析中,发现1个3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-coenzyme A Reductase,HMGR)和2个1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate Synthase,DXS)等转录物分别是与竹节参齐墩果酸和达马烷型皂苷生物合成相关的关键基因。此外,还发现CYP和UGT家族蛋白作为皂苷生物合成相关基因的调节因子,表现出组织特异性表达模式。这些结果共同提供了竹节参的全面代谢组学和转录组学概述,为竹节参定向育种奠定基础。
5 结论
在现代中药研究领域中,人参皂苷等提取物的药理作用丰富,对新药研发具有重要的指导价值。它值得进一步研究,在卫生保健产品、食品等领域的价值也在逐步发展。目前,人参分布广泛,具有较高的人工栽培价值,遗传多样性丰富,其潜在应用价值值得进一步开发。近年来,由于竹节参需求的增加,野生竹节参资源稀缺。除了保护竹节参资源和寻找新资源外,还可以从其他植物中寻找替代药用资源,填补高活性成分的药用资源的空白,解决市场供需矛盾。

