基于学习进阶理论的高三化学复习课研究*
——以镁与氯化铵溶液反应为例
倪文峰 戈益超
(1.黄山第一中学 安徽黄山 245700)(2.中国科学技术大学附属中学 安徽合肥 230051)
一、问题提出
目前高三化学复习课多以重复讲解知识点、做习题、讲解习题为主,课堂教学中的演示实验、学生实验、探究实验几乎停止。笔者认为高三复习课不应该是高一、高二化学知识内容的重复讲解,更不应该以机械的重复训练为主,而是应该以高一、高二化学知识为基础,以提升学生发现问题、提出问题、分析问题、解决问题为主,而将数字化实验引进课堂,可以更好地提高学生的学习兴趣和实验能力。镁与氯化铵溶液反应一直是大家探究的热点,笔者将此实验引入课堂,课前在实验室完成探究过程,为探究过程中可能出现的问题做好预案,避免探究结果不理想,影响课堂教学效果。
二、实验探究
(一)镁与氯化铵溶液反应的再现
1.取10.0 mL0.1 mol/L NHCl于大试管内;
2.将pH传感器放入大试管中,再将pH传感器与数据采集器相连,数据采集器再与计算机相连,打开Logger Pro 3(软件);
3.取10 cm长的镁条,打磨除去其表面的氧化镁,并分成4段;先点击软件中的“采集”,再将这4段镁条同时放入大试管,计算机自动记录数据。
(二)实验数据及处理
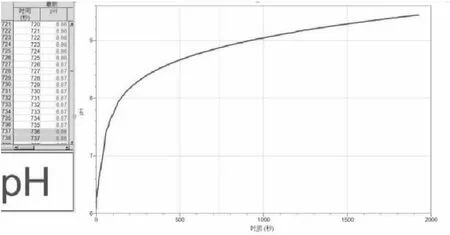
图1 镁与氯化铵溶液反应过程中pH变化图
(三)实验现象及解释
1.将镁条放入0.1 mol/L NHCl溶液中,在反应结束前一直有大量气泡产生。
2.将湿润的石蕊试纸放在试管口,试纸变蓝。
3.从图像中可以看出pH的值一直在增大,溶液从酸性变为碱性,在pH为9.4左右保持相对稳定。

问题1 在碱性条件下镁条能否与水反应生成氢气?
镁条在pH为 9.4左右的氯化铵与铵水的缓冲溶液中反应速率没有减弱,此条件下镁条能否被氢离子氧化,带着疑问笔者做了下面两个实验。
实验1 将打磨后的镁条放入pH为 9.4的碳酸钠与碳酸氢钠的缓冲溶液中有明显的气泡产生,向该缓冲溶液中加入氯化钠,有大量气泡产生。
实验2 将打磨后的镁条放入冷水中,刚开始无明显现象,一段时间后有极少量气泡,但放入氯化钠的溶液中有明显大量气泡。
结论:镁条与pH为 9.4的碳酸钠与碳酸氢钠的缓冲溶液反应,说明在碱性条件下,氢离子也可以氧化镁生成氢气,加入氯化钠气泡加速且在冷水中加入氯化钠也能产生大量气泡,说明氯离子能加速该反应,碱性环境下氢离子也能氧化镁。
问题2 镁条能否直接与铵根离子反应生成氢气?
多数老师利用醋酸铵溶液与镁条反应,有大量气泡来说明镁可以与铵根离子反应,但笔者认为镁与醋酸铵溶液反应并不能说明铵根离子直接与镁反应,还存在一种可能是镁与水反应生成氢氧化镁和氢气,生成的氢氧化镁附着在镁条的表面从而阻止了反应的进行,但加入醋酸铵后,氢氧化镁与铵根离子反应(氢氧化镁是中强碱,而铵水是弱碱)溶解了氢氧化镁,所以镁与醋酸铵溶液的反应不能说明铵根离子直接与镁反应。笔者利用如下实验来验证铵根可以直接与镁反应。
实验3 先将氯化铵溶解在乙醇中,再将打磨后的镁条分别放在乙醇、含氯化铵的乙醇溶液、含氯化钠的乙醇溶液中做对比实验,镁在乙醇、含氯化钠的乙醇溶液中均无明显现象,但镁在含氯化铵的乙醇溶液中有明显的气泡产生。
三、将实验探究转化为教学过程
(一)基于课程标准设定教学目标
1.通过探究镁与氯化铵溶液反应,提升综合运用盐的水解、弱电解质电离、镁的性质等知识解决实际问题的能力。
2.让学生真实经历探究未知知识的过程,经历科学家研究问题的过程,从而提高学生发现问题、提出问题、分析问题、解决问题的能力。
3.提高学生设计实验和实验探究能力,建构宏观—微观—符号—曲线四重表征。
(二) 教学过程呈现
1.定性分析
教师:氯化铵溶液是酸性、碱性还是中性?为什么?
学生:氯化铵溶液呈酸性,因为氯离子不水解,而铵根离子水解(铵根离子结合水电离出来的氢氧根离子生成NH·HO,从而使氢离子浓度大于氢氧根离子浓度,使溶液呈酸性)。
教师:镁常温下很难与冷水反应,氯化铵溶液呈酸性,镁与氯化铵溶液反应吗?
学生:若溶液很稀则不反应,若溶液浓度大,酸性较强则反应生成氢气。
教师:我们以0.1 mol/L的氯化铵溶液为例,用pH传感器测溶液的pH=6.12,溶液呈弱酸性,它能与镁条反应吗?为什么?
学生:不可以,因为酸性太弱。
学生:可以,因为溶液是酸性pH=6.12,热水的pH值也接近6,所以可以反应,但反应速率不会太快。
教师:回答可以的同学,不仅说出原因,而且与热水的pH做对比来证明自己的观点,说明思路开阔,值得表扬和学习。能不能反应,我们来实验一下。
演示实验:先将大约10 cm长、用砂纸打磨好的镁条分成四段同时放入试管中,再取大约10.0 mL 0.1 mol/L的氯化铵溶液于试管中,请学生观察现象。
学生:有大量气泡产生,说明可以反应,且反应速率较快。
教师:对这个实验结果满意吗?对此大家还有什么疑问吗?
学生:反应可以理解,毕竟溶液呈酸性。我想知道反应后溶液的pH是多少。
教师:请同学们再来预测一下反应后溶液的酸碱性。
学生:溶液pH逐渐增大,接近7,反应变慢。
教师:为什么?
学生:因为镁与pH=7的水不反应,所以当溶液的pH接近7时反应变慢。
教师:镁与0.1 mol/L的氯化铵溶液反应过程中pH值的变化是怎样的,我们用pH传感器来测一下实验中pH的变化。
2.曲线图分析
实验:将pH传感器与数据采集器相连,数据采集器再与计算机相连,打开Logger Pro 3(软件)。将用砂纸打磨好的镁条(15 cm)分成四段同时放入小烧杯中,再取25 mL 0.1 mol/L的氯化铵溶液倒入小烧杯中, 采集数据如图1所示。
教师:同学们对此实验现象及其结果有疑问吗?
学生1:为什么刚开始pH变化较大,后来变化较慢?
学生2:镁条与pH=7的水都难反应,为什么溶液pH大于7,反应还没有停止?难道镁条在碱性条件下也能与水反应?
学生3:pH在9到10之间时,仍有大量气泡冒出,这是为什么?
学生4:溶液呈碱性,溶液中有铵根离子,是否有氨气逸出?
学生5:生成的气体是不是氢气?
……
教师:我们先来解决第4及第5个问题,用实验方法就可以,怎么做呢?
学生:把湿润的石蕊试纸放在烧杯口,观察其是否变蓝;收集一试管气体,点燃,看是否有爆鸣声。
实验:用湿润的石蕊试纸放在烧杯口,试纸变蓝,说明有氨气生成逸出;收集一试管气体,点燃,有爆鸣声,说明是氢气。
教师:请同学们思考第一个问题,为什么刚开始pH变化较大,后来变化较慢?
学生:铵根离子水解呈酸性,刚开始溶液氢离子浓度大,加入镁,消耗氢离子,使平衡右移,但根据“勒夏特列原理”,只能减弱不能抵消,所以溶液pH增大;后来溶液pH变化较慢,那是因为到pH大约是9时,此时应该是氯化铵与氨水的缓冲溶液,再者生成的氨水有一部分挥发了,使溶液pH变化变小,还有可能是溶液已经是碱性,pH变化就像是酸碱中和滴定一样,在中间这一段pH=7附近变化较快,后来即使是碱性增强其pH变化也小。
教师:你分析得很有道理,我也同意你的观点,那对于问题2、问题3,同学们有什么想法,请和大家一起分享一下。
学生:在碱性条件下,仍能有大量氢气生成,说明镁条与溶液反应与酸碱性无关,但与pH=7的水不反应,说明与铵根离子或与氯离子有关。
教师追问:你的推理很好,那该如何设计实验证明此观点呢?
学生:对于氯离子,我们可以在氯化钠溶液中加入镁条,观察现象,若有大量气泡产生,则说明氯离子对此反应有促进作用,若无明显现象,则说明无作用。
教师:那铵根离子起到的作用是什么,目前有三种观点,观点1:氢氧化镁为中强碱,而氨水是弱碱性,镁与水反应生成氢氧化镁与氢气,但氢氧化镁难溶于水,附着在镁条的表面,阻止了反应的进行,加入氯化铵溶液,镁与水生成的氢氧化镁与铵根离子反应生成氨水,从而使平衡右移;观点2:氨根离子与镁条反应生成氢气与氨气;观点3:二者都有。请同学们课下思考,怎么设计实验方案来证明是哪种观点。
学生:将氯化铵直接溶解在乙醇中,得到氯化铵的乙醇溶液,再加入金属镁,观察是否反应。
教师:这个方案很有创意,可以进行实验来证明铵根离子是否可以直接与镁条反应。
(三)教学反思
本节课用pH传感器实时检测镁与氯化铵溶液反应后pH的变化,用曲线表征打破学生固有认知,引导学生向化学变化的本质方向思考,引导学生尊重客观事实,带领学生发现问题、提出问题、设计实验方案、解决问题,体验真实探究过程,使学生乐于参与,充分调动了学生的积极性,给相对死板的高三复习课带来一丝激情。学生积极思考探究曲线变化的原因,使其知识得到综合运用,发展学生的宏观辨识与微观探析的素养,更是打破传统的宏观—微观—符号三重表征,上升到宏观—微观—符号—曲线表征。课下学生提供的方案,更能反映出本节课激发了学生的学习兴趣,学生乐于学习思考,从被动学习转化为主动学习。
笔者将探究实验引入高三课堂复习教学中是一种大胆尝试,特别是在新课标、新课程、新高考的“三新”的教学理念下进行有意义的课堂教学改革,有益于化学学科核心素养的落实,如宏观辨识与微观探析、科学探究与模型认知、科学态度与社会责任在本节课都得到很好的落实,课后学生的兴奋及对实验的追问,都体现了这是一次比较成功的高三课堂教学转型。

