布鲁氏菌噬菌体基因组学研究进展
张 宇,朴东日,姜 海
布鲁氏菌病简称布病,是一种由布鲁氏菌引起的、全身感染性的人兽共患性疾病,《中华人民共和国传染病防治法》将其归为乙类传染病。人主要通过直接接触受感染的病畜及其食物制品或吸入带有布鲁氏菌的气溶胶而感染,发病后出现发热、关节痛和多汗等症状。动物大多是从患病动物、受污染的水源和饲料等途径摄入布鲁氏菌导致感染[1],主要引起流产和产奶量减少等病症。自1887年首次从死于“马耳他热”的英国士兵的脾中分离到布鲁氏菌以来[2],经100多年的研究,共有12种布鲁氏菌被发现。其中6个经典种布鲁氏菌均来源于陆生生物,即羊种布鲁氏菌(B.melitensis)、牛种布鲁氏菌(B.abortus)、绵羊附睾种布鲁氏菌(B.ovis)、犬种布鲁氏菌(B.canis)、猪种布鲁氏菌(B.suis)和沙林鼠种布鲁氏菌(B.neotomae);另外6个为新发现的布鲁氏菌,即鲸种(B.ceti)、鳍种(B.pinnipidialis)、田鼠种(B.microti)、狒狒种(B.papionis)、红狐种(B.Vulpis)和人源种布鲁氏菌(B.inopinata)[3]。
应用布鲁氏菌噬菌体鉴别布鲁氏菌是一种简便和快速的方法,但它只能鉴别种,不能鉴别各生物型[4]。20世纪50年代,Parnas和Jablonski等发现了噬菌体对布鲁氏菌的感染和裂解作用[5-6]。1955年在苏联分离到的Tbilisi(Tb)噬菌体是最早被国际公认的用于布鲁氏菌鉴定的噬菌体,到80年代,根据宿主特异性,将布鲁氏菌噬菌体分为6大群,其代表株为Tb、Fi(Firenze)、Wb(Weybridge)、Bk(Berkeley)、R/C、Iz(Izatnagar),这对布鲁氏菌噬菌体的分群及其在布鲁氏菌种中的鉴别和分类起到重要作用,全球的实验室至今仍在使用[7-8]。后来分离到的噬菌体SA、A2、NM系列等噬菌体[9],作为参考系统的补充,对布鲁氏菌的分型鉴定也具有一定意义。布鲁氏菌噬菌体的研究由来已久,但对具有不同宿主特异性的不同布鲁氏菌噬菌体的种群结构、分子多样性和基因组的转运机制仍然了解甚少。现对布鲁氏菌噬菌体最新研究结果进行简要综述。
1 布鲁氏菌噬菌体分类研究
布鲁氏菌噬菌体均属于痘病毒科,为双链DNA病毒,具有二十面体头部和一个短小尾部,尾部有尾纤丝,该纤丝对噬菌体吸附在宿主菌上有明显作用[10]。基因组大小相近,为38.25~41.45 kb,其中Iz噬菌体的基因组是所有裂解型布鲁氏菌噬菌体中最大的[11],预测的蛋白产物个数也非常相近,Tb、Pr、Fi、Wb、S708、Bk、R/C和EF4的GC含量为48%,低于宿主菌布鲁氏菌基因组(57%)。布鲁氏菌噬菌体之间具有高度相似的序列和基因组结构,主要差异表现在它们所感染的布鲁氏菌的种类不同[12]。表1是目前在美国国立生物信息中心(NCBI)数据库收录的12株布鲁氏菌噬菌体。
1.1 Tb 1955年第比利斯疫苗和血清研究所首次从牛粪便中分离得到Tbilisi噬菌体[2]。随后,该噬菌体被布鲁氏菌分类学国际小组委员会批准作为布鲁氏菌菌株诊断和鉴别的参考噬菌体[13]。Tb在常规检测浓度(routine test dilution,RTD)对牛种布鲁氏菌有裂解作用;在高浓度(104×RTD或更高)时可引起猪种和沙林鼠种布鲁氏菌裂解。
1.2 Wb Weybridge(Wb)噬菌体是在猪种布鲁氏菌培养液中通过诱导Tb噬菌体得到的[14],对光滑型的牛种、猪种和沙林鼠种布鲁氏菌具有裂解作用,不裂解粗糙型的犬种、绵羊种布鲁氏菌。
1.3 Fi Firenze(Fi)噬菌体是从牛种布鲁氏菌中分离得到的[15],在RTD中可以裂解光滑型牛种、沙林鼠种、田鼠种和红狐种布鲁氏菌;在高浓度下对猪种布鲁氏菌也有裂解作用。
1.4 Bk Berkeley(Bk)噬菌体是在羊种布鲁氏菌Isfahan株中培养Wb噬菌体出现的噬斑中分离得到的[16],能裂解光滑型牛种和猪种布鲁氏菌。后又在不同的羊种布鲁氏菌株上传代,得到Bk2噬菌体,现在是鉴定光滑型布氏菌的常用噬菌体之一[4]。
1.5 R/C R/C是一种来源于Wb、D和Mc/75噬菌体的突变体,可裂解绵羊附睾种布鲁氏菌、犬种布鲁氏菌以及其他种型的一些粗糙型菌株,而不裂解任何光滑型布鲁氏菌[12]。
1.6 Iz 1982年,印度Izatnagar的兽医研究所从绵羊和山羊粪便中分离到的Iz噬菌体,在RTD时可裂解光滑型牛种、猪种、沙林鼠种、羊种布鲁氏菌,也可裂解粗糙型羊种和猪种布鲁氏菌,而不裂解粗糙型牛种、绵羊附睾种和犬种布鲁氏菌;在104×RTD甚至更高浓度,几乎对所有光滑型布鲁氏菌表现出裂解活性,但对粗糙型牛种和绵羊附睾种布鲁氏菌的裂解活性仍较低,对犬种布鲁氏菌的活性几乎没有[17]。
1.7 NP Rigby等[12]从非典型牛种布鲁氏菌分离出的布鲁氏菌噬菌体,命名为Nepean(Np)噬菌体,可以裂解光滑型猪种和沙林鼠种布鲁氏菌。
1.8 Pr 2003年在墨西哥Perote分离出布鲁氏菌噬菌体Pr[18],可以裂解牛种、羊种和猪种布鲁氏菌,其噬斑因布鲁氏菌菌株不同而有所差异,在牛种和猪种布鲁氏菌中复制时,形成清晰的斑块,而在羊种布鲁氏菌中复制时,产生小的浑浊斑块。
1.9 EF4 Calvin等从蒙大拿州采集的麋鹿粪便样本中分离出可感染牛种布鲁氏菌S19的噬菌体,命名为EF4[19]。
1.10 F1 F1噬菌体在牛种布鲁氏菌疫苗株S19上繁殖得到[20]。与Tb裂解谱相似,F1对牛种、猪种、沙林鼠种和田鼠种布鲁氏菌具有特异性。
1.11 BiPBO1 BiPBO1是第一个被鉴定出的温和型布鲁氏菌噬菌体,是Hammerl等[21]通过诱导,从人源种布鲁氏菌中分离到的噬菌体。在形态上不同于其他已知的布鲁氏菌噬菌体,属于长尾病毒科,可感染牛种和羊种布鲁氏菌。
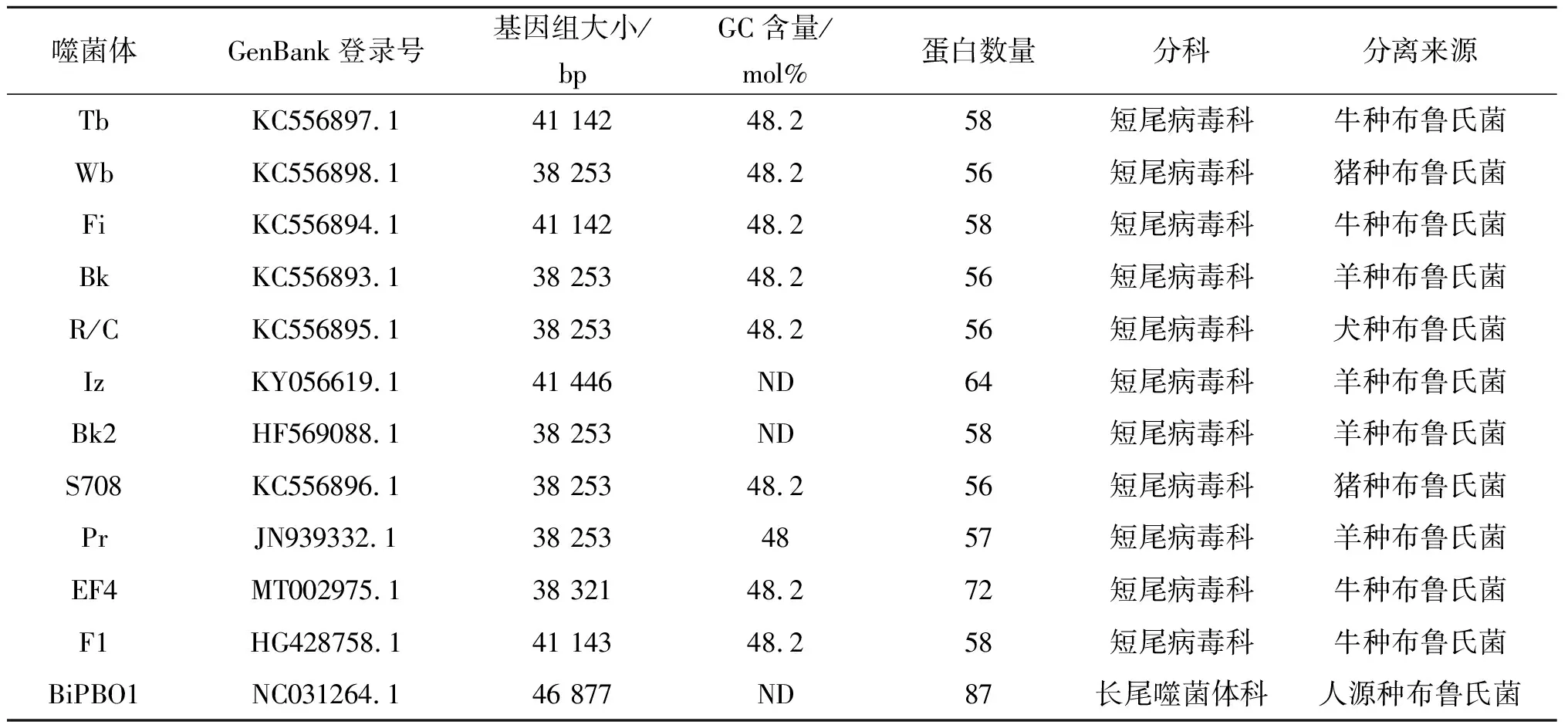
表1 NCBI数据库收录的布鲁氏菌噬菌体Tab.1 Brucella phages included in the NCBI database
2 布鲁氏菌噬菌体基因组功能研究进展
基因对噬菌体的繁殖至关重要。布鲁氏菌噬菌体的基因根据预测的功能进行聚类,结构蛋白和裂解蛋白在正链上编码,反向链中具有参与DNA复制和代谢的基因结构[18]。
2.1 Tb Tb噬菌体有57个开放阅读框(ORF),3个转录终止子和4个预测的转录启动子。ORF 28与编码预测GDSL/SGNH水解酶的酶尾纤维蛋白具有同源性,酶尾纤维蛋白常在降解宿主细胞膜中起作用[22]。ORF 29编码预测的碳水化合物结合尾刺突蛋白,与含有碳水化合物结合蛋白的果胶裂解酶样结构域表现出显著的相似性。ORF 6和7分别编码末端酶小亚基和大亚基,这两个末端酶是参与DNA包装的主要蛋白质。ORF 30的产物具有肽聚糖结合结构域和DUF847结构域,这些结构域通常存在于噬菌体裂解蛋白和细菌肽聚糖降解酶中[23],主要在裂解宿主和降解肽聚糖中起作用。ORF 43编码假定的DNA甲基转移酶,ORF 49编码假定的Ⅲ型限制性核酸酶,这2个基因可能参与DNA限制和修饰[17]。ORF 23可能编码尾纤维蛋白,其与伯克霍尔德菌噬菌体DC1尾纤维蛋白肽酶结构域(N端位置拓扑结构)表现出相似性[22]。4个可能与DNA复制有关的基因ORF 33、ORF 50、ORF 52和ORF 58,分别编码预测的DnaA样蛋白、DEAD解旋酶、核酸外切酶和双功能引物酶/DNA聚合酶。
2.2 Pr Pr噬菌体基因组中的ORF 6和7与Tb噬菌体的功能相同,均在编码大小亚基末端酶中发挥作用。Pr ORF 29的产物也具有肽聚糖结合结构域和DUF847结构域,可能参与宿主裂解。可能参与DNA限制和修饰的ORF 42和ORF 48,分别编码预测的DNA甲基转移酶和Ⅲ型限制性核酸酶。ORF 32、ORF 49、ORF 51和ORF 57可能参与DNA复制,其编码的预测产物功能均与Tb噬菌体相同。
2.3 Fi ORF 28和ORF 29可能在吸附和渗透宿主细胞中有重要作用,ORF 28编码的预测蛋白产物为酶尾纤维蛋白,ORF 29编码的预测碳水化合物结合尾刺突蛋白,含有与沙门菌噬菌体P22相似的果胶裂解酶结构域[22,24]。
2.4 Wb Wb基因组的ORF 16和ORF 23编码结构蛋白,ORF 27编码尾部蛋白,ORF 57编码引物酶/DNA聚合酶。
2.5 R/C R/C基因组的ORF 14编码引物酶/DNA聚合酶,该基因内含有终止密码子,对基因表达起到调控作用。
2.6 Iz Iz噬菌体中位于ORF 23和24之间的301 bp重复核苷酸序列,编码尾纤维蛋白[11]。与R/C相同,Iz编码引物酶/DNA聚合酶的基因中也包含一个终止密码子。
2.7 EF4 EF4噬菌体的基因组编码密度为87.8%,有72个编码序列(CDS),其中38个与已知功能的蛋白具有序列相似性,包括主要头部蛋白、门户蛋白和尾环蛋白,以及大小亚基末端酶。该基因组还包含参与DNA复制的假定蛋白,如双功能DNA聚合酶/引物酶、解旋酶、核酸外切酶和DNA核酸内切酶。
2.8 F1 F1噬菌体基因组已知具有58个假定基因和7个转录终止子。F1与Tb和Pr非常相似,核苷酸同源性分别为99%和98%,大多数预测的基因产物甚至完全相同。F1的一些产物可能参与病毒粒子组装,如Gp12主要头部蛋白、Gp15和Gp16结构蛋白、Gp24尾丝蛋白,这些产物与Tb相应的蛋白相关,有显著的氨基酸多态性。
2.9 BIPBO1 该基因组包括87个ORF和19个可能的转录终止子,32个假定的基因产物可以进行功能分配。BIPBO1与其他温和噬菌体相似,其编码结构蛋白的基因主要存在于基因组左臂,整合基因和宿主细胞裂解的基因位于中段,右臂是参与复制和免疫的基因。正链上ORF 1和2可能编码大小亚基末端酶,ORF 3和6可能编码与HK97样噬菌体头部蛋白相关的门户蛋白和主要衣壳蛋白,ORF 9、10、13和16是4个假定的尾部基因。此外,还有两个位于负链上的基因,可能编码毒素(ORF 20)和解毒剂蛋白(ORF 19),该模块可能与BiPBO1原噬菌体的稳定性有关。ORF 29编码的蛋白含有纤维连接蛋白3型重复序列(FN3),该结构域通常存在于噬菌体的尾部蛋白质中,可能有助于噬菌体附着到细胞表面[25]。基因组中段的ORF 33和ORF 37可能为编码赖氨酸和整合酶的基因,参与整合。在基因组的右臂有几个对复制很重要的ORF,ORF 77和ORF 79的产物分别与DnaA起始蛋白和DnaB解旋酶类似,ORF 52也可编码解旋酶,该基因被一个核酸内切酶基因(ORF 51)和一个核酸外切酶基因(ORF 53)包围。
3 布鲁氏菌噬菌体基因组进化
Tb、Fi、Wb、S708、Bk、R/C、EF4和Pr这些布鲁氏菌噬菌体基因组之间具有较高的序列同源性。Tb、Fi、Wb、S708、Bk和R/C的成对核苷酸序列同源性>96.1%,Tb与Fi、Pr的核苷酸同源性均>99%[18,22],EF4与R/C基因组的核苷酸同源性为99.71%,F1与Tb和Pr非常相似,核苷酸同源性分别为99%和98%,所有基因组具有很强的共线性。Farlow等[22]确定了与宿主范围表型一致的3个遗传组,I组噬菌体TbM、TbW和Fi,II组噬菌体Bk、R/C和Pr,III组噬菌体S708和Wb。在I组噬菌体中,TbW和Fi序列仅相差一个核苷酸,TbM与TbW和Fi的总核苷酸同源性为99.93%,差异主要存在于几个基因间IG区域和ORF 21的插入。还有研究表明在不同研究所的Tb噬菌体存在一些序列偏差,主要是由点突变造成的[18,22,24]。
4 应 用
布鲁氏菌病仍然是一个全球性的健康问题,对这种人兽共患病的监测和防控仍是一个难题。食品和临床样本中布鲁氏菌的检测是一项费时费力的工作,许多针对布鲁氏菌DNA的PCR检测方法已经开发出来,但这些方法无法区分活的和死的布鲁氏菌。噬菌体广泛应用于布鲁氏菌的分型,可在宿主菌细胞内可以增殖到非常高的数量,所以它们也可以作为宿主菌的特定指示物,现已有研究者对此进行初步应用。例如,Kirill等[26]使用实时荧光定量PCR(qPCR)对噬菌体DNA扩增过程进行监测,以此间接证明血液样本中存在活菌,这种方法无需DNA提取和纯化步骤,对含有其他可能被错误鉴定为布鲁氏菌属(人苍白杆菌和阿菲波菌)的混合培养物同样有效;Projahn等[27]同样利用qPCR方法,在人为污染田鼠种布鲁氏菌的牛乳中检测出噬菌体DNA扩增,证明牛乳中存在活菌,与传统的基于培养的技术相比,这种方法表现出在牛奶基质中同样具有高稳定性,并且检测时间也大大缩短。因此,可以认为分子检测方法是检测布鲁氏菌的一种可靠灵敏的方法,有助于减少筛选潜在污染物所需的实际操作时间,并在不分离细菌的情况下得到结果,提示感染风险。但这些研究结果都是通过模拟样品得到的,未来是否可以应用到真实标本中还需要进一步的验证。
5 展 望
目前关于布鲁氏菌噬菌体的全基因组测序以及遗传特征的研究逐渐成为热点。通过将更多的布鲁氏菌噬菌体纳入到基因组数据库中,研究噬菌体与宿主菌细胞壁结合的位点及其与布鲁氏菌的作用机制,从而设计出具有裂解布鲁氏菌相似作用的药物[28],即可应用其净化布病养殖场以及治疗布鲁氏菌病;通过研究噬菌体基因组功能及其与宿主菌相互作用,探明布鲁氏菌噬菌体进化过程及其与宿主菌共同演化关系,确定其在宿主菌之间传递遗传信息的作用,从而了解布鲁氏菌噬菌体在布病流行规律中的作用,有效控制传播进程;通过开发新的灵敏可靠的活布鲁氏菌检测方法,有效地应用到食品和临床标本的检测中。
利益冲突:无
引用本文格式:张宇,朴东日,姜海. 布鲁氏菌噬菌体基因组学研究进展[J]. 中国人兽共患病学报,2022,38(8):718-722. DOI:10.3969/j.issn.1002-2694.2022.00.095

