欧前胡素固体分散体凝胶骨架缓释片的制备及药动学评价
徐志杰
欧前胡素固体分散体凝胶骨架缓释片的制备及药动学评价
徐志杰
威海海洋职业学院,山东 威海 264300
制备欧前胡素固体分散体(imperatorin solid dispersion,IMP-SD)凝胶骨架缓释片(hydrogel matrix sustained-release tablets)(IMP-SD-HMSRT),并研究口服药动学行为及体内外相关性。溶剂挥发法制备IMP-SD。在单因素考察的基础上,选择HPMC K15M用量、聚乙二醇(PEG)400比例和PEG总用量为主要影响因素,缓释片在2、6、12 h累积释放率的综合评分为响应值,采用Box-Behnken设计-效应面法优化IMP-SD-HMSRT最佳处方,并考察在家兔体内的药动学行为。利用Loo-Rigelman法评价其体内外相关性。IMP-SD-HMSRT最佳处方为HPMC K15M用量为48 mg/片、PEG 400比例为58%、PEG总量为26.5 mg/片。HMSRT的12 h累积释放率达到95.54%。药动学结果显示IMP-SD- HMSRT的max波动小,max延后至(4.08±0.43)h,与欧前胡素普通片相比IMP-SD-HMSRT的相对生物利用度提高至219.76%。IMP-SD-HMSRT在pH 6.8磷酸盐缓冲液中体外释药行为与体内吸收存在相关性。IMP-SD-HMSRT释药缓慢,促进了药物吸收,体内吸收与体外释药具有良好的相关性。
欧前胡素;固体分散体;凝胶骨架缓释片;Box-Behnken设计-效应面法;药动学
欧前胡素(imperatorin)主要存在于白芷、欧前胡、防风、独活等中药植物中,属于香豆类化合物,研究表明它具有抗炎、抗抑郁、镇痛等作用[1],在心血管系统和神经系统中应用较多[2-3]。据报道[4],欧前胡素脂溶性较好,但水中溶解度仅为2.45 µg/mL,溶出度差,导致药物难以吸收。尚曙玉等[5]将其制备成固体分散体后口服生物利用度提高至2.03倍。但欧前胡素具有一定的毒性[6],固体分散体的快速释药使欧前胡素的血药浓度波动较大,容易加剧毒副作用,因此有必要进一步制备成缓释制剂。另外,欧前胡素在胃肠道均有吸收[7],适合制备成缓释制剂。凝胶骨架缓释片(hydrogel matrix sustained-release tablets,HMSRT)具有释药变异小、制备工艺简单、适合大规模生产、辅料成本低廉等优势,是缓释制剂研究热点之一[8-10],可有效抑制血药浓度波动,减少患者服药次数、增强顺应性及药效[11]。为解决欧前胡素固体分散体(imperatorin solid dispersion,IMP-SD)血药浓度波动较大缺点,提高其安全性及有效性,本研究采用HPMC K15M为凝胶骨架缓释片的缓释材料,聚乙二醇(PEG)类物质(PEG 400和PEG 4000混合物)作为释药速率调节剂,将IMP-SD进一步制备成凝胶骨架缓释片(hydrogel matrix sustained-release tablets,IMP- SD-HMSRT),并对体内药动学进行研究,为欧前胡素新制剂研究提供参考。
1 仪器与材料
1.1 仪器
Quintix125D-1CN型电子分析天平,赛多利斯科学仪器北京有限公司;DF-101S磁力搅拌器,河南天辰仪器设备有限公司;1100型高效液相色谱仪,安捷伦公司;RC-6D型药物溶出试验仪,天津创兴电子设备有限公司;YP-1型压片机,宁波天辰机械设备有限公司;HB-800型超声仪,张家港市海博设备有限公司;RF01型旋蒸蒸发仪,上海况胜实业公司;YD-4片剂硬度仪,天津创兴电子设备有限公司。
1.2 材料
欧前胡素对照品,批号110826-202021,质量分数99.6%,中国食品药品检定研究院;羟丙基甲基纤维K15M(HPMC K15M),批号181208,西安天正药用辅料有限公司;欧前胡素原料药,批号20191025,质量分数为98%,南京春秋生物工程有限公司;淀粉,批号190910,曲阜市天利药用辅料有限公司;聚乙二醇400(PEG 400),批号20200315,山东瑞生药用辅料有限公司;聚乙二醇4000(PEG 4000),批号20191224,山东瑞生药用辅料有限公司;聚乙烯吡咯烷酮(PVP K30),Sigma-Aldrich公司;硬脂酸镁,批号151026,湖北兴银河化工有限公司;甲醇,色谱级,德国Merck公司。
1.3 动物
日本大耳兔,雌雄兼用,体质量1.8~2.4 kg,购自吉林大学动物实验中心[许可证号:SCXK(吉)2016-007]。所有动物实验遵循威海海洋职业学院有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 IMP-SD-HMSRT的制备
2.1.1 IMP-SD的制备及晶型分析 参考文献方法[5]制备IMP-SD。取10 g欧前胡素原料药和50 g PVP K30置于1000 mL圆底烧瓶中,加入600 mL无水乙醇得混悬液。置于45 ℃水浴中磁力搅拌5 h(转速为800 r/min),减压旋蒸除去有机溶剂得残留物,收集并研磨成细粉,即得IMP-SD,过24目筛,置于干燥器中保存。
取欧前胡素原料药、PVP K30、物理混合物(比例同IMP-SD)和IMP-SD粉末约8 mg,置于玻璃槽中,压制平整,进行X射线粉末衍射(X-ray powder diffraction,XRPD)分析。扫描条件为铜靶,扫描速度:5°/min,扫描范围(2):3°~45°,结果见图1。欧前胡素在3°~45°有大量的晶型衍射峰,在物理混合物的XRPD图谱中仍可观察欧前胡素原料药到在9.6°、9.9°、16.1°、18.0°、19.8°、24.1°、35.2°等处的特征晶型衍射峰,说明简单混合未改变欧前胡素存在状态。在IMP-SD的XRPD图谱中欧前胡素的晶型衍射峰均消失不见,说明欧前胡素转变成为无定型物质,同时也证明IMP-SD制备成功。
2.1.2 IMP-SD-HMSRT的制备 IMP-SD-HMSRT的处方工艺研究均按200片进行制备。保持IMP-SD含量为240 mg/片(以欧前胡素计40 mg/片),加入处方量的HPMC K15M和释药速率调节剂(PEG 400与PEG 4000混合物)等辅料,加入淀粉补充片质量至0.5 g/片,混匀。6%淀粉浆制软材,20目筛制粒,真空干燥12 h,20目筛整粒,加入0.8%硬脂酸镁,混匀后压制成直径1.1 cm片剂,即得IMP-SD-HMSRT。
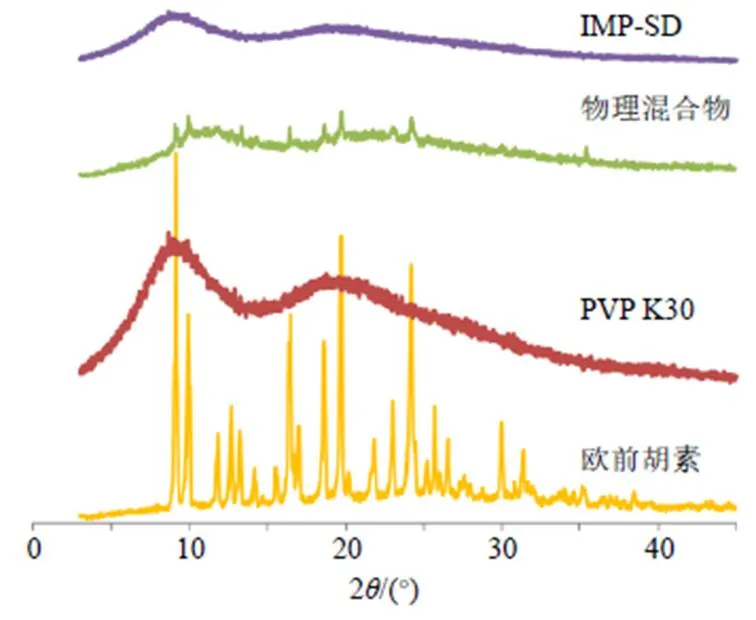
图1 XRPD结果
2.2 HPLC法测定欧前胡素含量
2.2.1 色谱条件 色谱柱为Agilent XDB-C18柱(250 mm×4.6 mm,5 μm);柱温为30 ℃;流动相为甲醇-水(60∶40);检测波长为300 nm;体积流量为1.0 mL/min。理论塔板数以欧前胡素计不低于8000,色谱图见图2,结果表明辅料不干扰欧前胡素含量测定,专属性高。

图2 阴性溶液(A)、欧前胡素对照品(B) 和IMP-SD- HMSRT样品(C) 的HPLC图
2.2.2 对照品溶液的配制及线性关系考察 采用甲醇配制质量浓度为500 µg/mL的欧前胡素对照品储备液。取适量,流动相稀释至20、10、5、1、0.1、0.05 µg/mL,各质量浓度平行3份。进样,记录欧前胡素各质量浓度()的峰面积(),作线性回归得回归方程=18.106 5+0.774 6,=0.999 7,线性范围为0.05~20 µg/mL。
2.2.3 供试品溶液的配制 取10片IMP-SD- HMSRT,研磨至细粉,称取0.5 g置于100 mL量瓶中,加入50 mL甲醇震荡混匀,超声10 min,放置20 min,并用甲醇-水(60∶40)定容。取适量过0.45 µm微孔滤膜,取续滤液0.5 mL置于25 mL量瓶中,甲醇-水(60∶40)定容,即得IMP-SD-HMSRT供试品溶液。
2.2.4 重复性考察 按照“2.2.3”项下方法平行制备6份IMP-SD-HMSRT供试品溶液,分别进HPLC测定欧前胡素含量,计算其RSD为1.62%,结果表明重复性良好。
2.2.5 精密度考察 取质量浓度为0.05、5、20 µg/mL的欧前胡素对照品溶液分别作为低、中、高质量浓度,连续进样6次进行分析。结果显示低、中、高质量浓度的RSD值分别为0.95%、0.69%、0.74%,结果表明本实验精密度良好。
2.2.6 稳定性考察 取IMP-SD-HMSRT供试品溶液置于室温,分别于0、2、4、8、12、24 h进样分析,计算得欧前胡素质量浓度的RSD为1.12%,结果表明供试品溶液在24 h内稳定性良好。
2.2.7 加样回收率考察 取9份0.25 g的IMP-SD- HMSRT细粉置于100 mL量瓶中,分成低、中、高3组,分别加入欧前胡素对照品10、20、30 mg,按照“2.2.3”项下所述方法分别制备IMP-SD-HMSRT的供试品溶液,进样测定欧前胡素含量。结果显示,欧前胡素平均加样回收率为99.43%,RSD为1.24%。
2.3 IMP-SD-HMSRT释放度测定方法
转篮法考察体外释药情况。设置溶出仪转速为75 r/min,温度为(37.0±0.5)℃,取6片IMP-SD- HMSRT同时放入900 mL蒸馏水的溶出杯中。分别于0、2、4、6、8、10、12 h取样3 mL至离心管中,密封,并补加3 mL蒸馏水(温度为37 ℃)。0.45 µm微孔滤膜(水膜)过滤样品,进样测定欧前胡素含量,计算各点累积释放率,绘制体外释药曲线。
2.4 单因素试验考察各因素对IMP-SD-HMSRT释药的影响
2.4.1 骨架材料型号对IMP-SD-HMSRT释药的影响 固定IMP-SD含量为240 mg/片,骨架材料用量为45 mg/片,PEG 400与PEG 4000用量比为1∶1,PEG总用量为20 mg/片等条件不变,分别考察骨架材料型号(HPMC K4M、HPMC K15M、HPMC K30M)对IMP-SD-HMSRT体外释药的影响,结果见图3。HPMC K4M相对分子质量较小,药物释药容易,因而体外释药相对较快;而HPMC K30M相对分子质量较大,形成的凝胶层相对较厚,导致体外释药相对较慢。HPMC K15M作为骨架材料时由于分子量适中,制得的IMP-SD-HMSRT体外释药行为相对理想,故后续研究均采用HPMC K15M作为IMP-SD-HMSRT的骨架材料。
2.4.2 HPMC K15M用量的考察 固定IMP-SD含量为240 mg/片,HPMC K15M为骨架材料,PEG 400与PEG 4000用量比为1∶1,PEG总用量为20 mg/片等条件不变,分别考察HPMC K15M用量(30、45、60 mg/片)对IMP-SD-HMSRT释药行为的影响,结果见图4。当HPMC K15M用量为30 mg/片时体外释药相对较快,用量为60 mg/片体外释药相对较慢,而用量为45 mg/片时IMP-SD- HMSRT体外释药相对适中,可见其用量对IMP-SD- HMSRT体外释药影响较大,后续需要进一步优化。

图3 骨架材料型号的考察(, n = 3)

图4 HPMC K15M用量的考察(, n = 3)
2.4.3 PEG 400用量比例的考察 固定IMP-SD含量为240 mg/片,HPMC K15M为骨架材料,用量为45 mg/片,PEG总用量为20 mg/片(PEG 400与PEG 4000混合物)等条件不变,分别考察PEG 400所占PEG总用量比例(30%、50%、70%)对IMP-SD- HMSRT释药的影响,结果见图5。PEG 400和PEG 4000的相对分子质量不同,因而两者比例不同时对IMP-SD-HMSRT体外释药产生一定影响。PEG 400用量比例相对较大时(70%)体外释药相对较快,比例相对较小时(30%)为体外释药相对较慢,当用量为50%时IMP-SD-HMSRT体外释药相对适中。可见PEG 400用量比例对IMP-SD-HMSRT体外释药影响较大,后续需要进一步优化。
2.4.4 PEG用量的考察 固定IMP-SD含量为240 mg/片,HPMC 15M为缓释材料,PEG 400用量比例为50%等条件不变,分别考察PEG总用量(30、20、10 mg/片)对IMP-SD-HMSRT释药行为的影响,结果见图6。PEG物质在IMP-SD-HMSRT中起到调节释药速率的作用,当PEG用量较大时(30 mg/片)体外释药相对较快,比例相对较小时(10 mg/片)为体外释药相对较慢,后续需对PEG用量进一步优化。
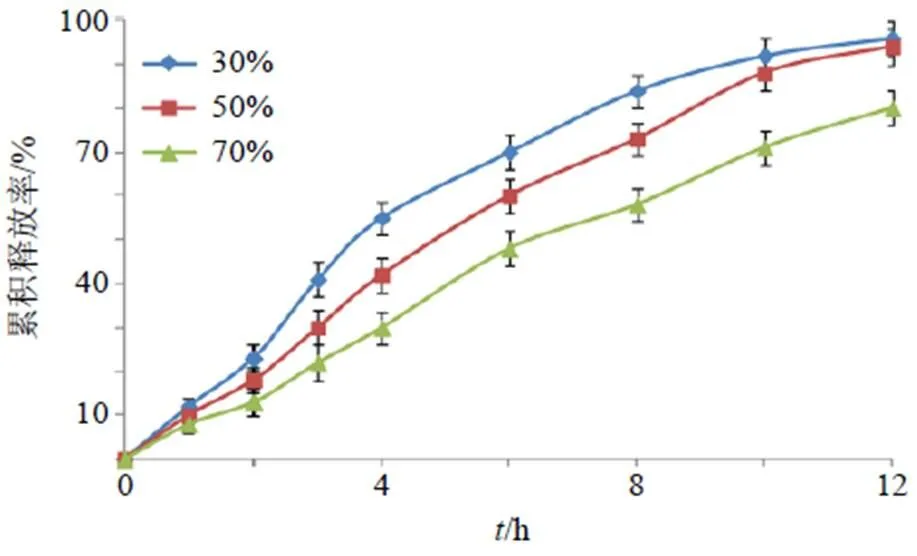
图5 PEG 400用量比例的考察(, n = 3)

图6 PEG用量的考察(, n = 3)
2.5 Box-Behnken响应面法优化IMP-SD-HMSRT处方
2.5.1 实验方案 根据单因素考察结果,选择HPMC K15M用量(30、45、60 mg/片,1)、PEG 400所占PEG总用量的比例(30%、50%、70%,2)和PEG总用量(10、20、30 mg/片,3)作为主要影响因素,各影响因素的水平见表1。
对于IMP-SD-HMSRT来讲,在2 h的累积释放率(2)应防止出现突释或迟释,6 h的累积释放率(6)应防止出现释药不足或过度释药,12 h累积释放率(12)应达基本释放完毕要求。采用综合评分()进行评价,公式为=|2-0.3|×100+|6-0.7|×100+|12-0.95|×100,以综合评分为响应值,采用Box-Behnken响应面法优化IMP-SD- HMSRT处方,根据实验组合分别制备不同处方的IMP-SD-HMSRT,并分别测定2、6、12 h的累积释放率,计算值,结果见表1。
2.5.2 模型的拟合及最佳处方 对实验数据进行拟合,得出的2次多元回归方程为=6.48+2.811+2.592-13.233-0.6812-5.6513-0.8523+8.5712+5.1222+11.7032,方差分析见表2。拟合结果显示,2=0.987 1,adj2=0.970 6,说明拟合值与实测值相关性良好。模型<0.000 1(具极显著性意义),失拟项的=0.148 3>0.05(无显著性意义),说明该模型未知因素干扰小。根据方差分析结果,方程中1、2、3、13、12、22和32各项均具显著性或极显著意义(<0.05、0.01)。固定HPMC K15M用量、PEG 400比例和PEG总量的某一因素,得其他2因素对综合评分的三维曲面图,见图7。
表1 Box-Behnken试验设计结果(n = 3)
Table 1 Experiments results of Box-Behnken (n= 3)
序号X1/(mg∙片−1)X2/%X3/(mg∙片−1)L2/%L6/%L12/%Y序号X1/(mg∙片−1)X2/%X3/(mg∙片−1)L2/%L6/%L12/%Y 130 (−1)30 (−1)20 (0)33.765.488.216.11045701024.750.480.239.7 245 (0)50 (0)2031.473.294.45.31145703034.676.297.112.9 345502033.670.796.55.91260302022.757.884.619.9 460 (+1)5010 (−1)15.853.475.150.71345502030.673.597.36.4 53070 (+1)2045.176.594.821.81445301021.962.478.732.0 645502034.674.195.69.31545303033.272.398.18.6 760702023.458.390.422.91660503023.874.994.511.6 8305030 (+1)35.877.694.314.11745502032.771.696.25.5 930501026.254.883.430.6
当固定某一因素不变时,随着其他2因素的增加总评分均呈现先下降后上升趋势,总评分越小,表明释药过程越理想。得到的IMP-SD-HMSRT最佳处方为HPMC K15M用量48.18 mg/片,PEG 400比例58.26%,PEG总量26.62 mg/片;预测的总评分为4.7。
表2 方差分析
Table 2 Analysis of variance
因素方差自由度均方F值P值因素方差自由度均方F值P值 模型2 746.409305.1659.64<0.000 1X12309.421309.4260.480.000 1 X163.28163.2812.370.009 8X22110.481110.4821.590.002 4 X253.56153.5610.470.014 3X32576.13135.82112.60<0.000 1 X31 399.2011399.20273.47<0.000 1残差35.8275.12 X1X21.8211.820.360.569 4失拟度25.1738.293.150.148 3 X1X3127.691127.6924.960.001 6纯误差10.6542.66 X2X32.8912.890.560.476 8总误差2 782.2216

图7 各因素与响应值的三维图
2.6 工艺验证
为便于操作,将IMP-SD-HMSRT最佳处方调整为HPMC K15M用量为48 mg/片,PEG 400比例为58%,PEG总量为26.5 mg/片。平行制备3批IMP-SD-HMSRT,分别测定2、6、12 h的累积释放率,并按照“2.5.1”项下方法计算综合评分。3批IMP-SD-HMSRT体外释药结果见图8,说明确定的最佳处方工艺重复性良好,综合评分分别为5.1、4.6、4.8,均与预测值4.7接近,且12 h平均累积释放率达到95.54%。

图8 IMP-SD-HMSRT体外释药曲线(, n = 6)
2.7 欧前胡素普通片及IMP-SD片的制备和体外释药比较
取欧前胡素和IMP-SD粉末适量,分别加入淀粉混合均匀,6%淀粉浆制软材,20目筛制粒,真空干燥12 h,20目筛整粒,加入0.8%硬脂酸镁,混匀后压制成直径1.1 cm片剂,即得欧前胡素普通片及IMP-SD片。
按“2.3”项下方法比较欧前胡素普通片、IMP- SD片和IMP-SD-HMSRT体外释药情况,结果见图9。IMP-SD片在0~4 h释药速率较快,在4 h基本释放完毕。将IMP-SD制备成IMP-SD-HMSRT后释药缓慢,12 h累积释放率为96.07%,而欧前胡素普通片在12 h累积释放率仅为33.40%。由于IMP-SD- HMSRT具有明显的缓释特征,为与后续药动学研究保持一致,因此增加了18 h取样点。

图9 欧前胡素普通片、IMP-SD片和IMP-SD-HMSRT体外释药曲线(, n = 6)
2.8 药动学研究
2.8.1 给药及取血方案 取18只健康家兔,分为欧前胡素普通片组、IMP-SD片组和IMP-SD-HMSRT组,给药前禁食0.5 d,但可自由饮水。用开口器将片剂送入家兔口中,温水送服。欧前胡素普通片组于0.25、0.5、1、1.5、2、2.5、3、4、6、8 h于耳缘静脉处取血约1 mL置于肝素化离心管中。IMP-SD片和IMP-SD-HMSRT组分别增加取血点至12 h和18 h。血浆样品均于3500 r/min离心3 min,取血浆密封,置于−18 ℃冰箱保存。
2.8.2 血浆样品的处理[5]甲醇配制质量浓度为800 ng/mL的异欧前胡素作为内标溶液。常温解冻后吸取血浆样品100 µL置离心管中,加入内标溶液40 µL,醋酸乙酯-石油醚(1∶1)2 mL,涡旋6 min,5000 r/min离心5 min。取上层有机相,置于空白离心管中,45 ℃的氮气缓慢吹干,于残渣加入100 µL甲醇复溶,继续于5000 r/min离心5 min即得血浆样品,待测。
2.8.3 溶液配制及线性曲线考察 采用甲醇稀释配制成质量浓度为1000、500、250、100、50、25 ng/mL的欧前胡素对照品溶液,分别取100 µL,45 ℃的氮气缓慢吹干,加入100 µL空白血浆,涡旋6 min,即得欧前胡素血浆对照品溶液。按照“2.8.2”项下所述方法处理样品,进HPLC测定欧前胡素与内标的峰面积。欧前胡素与内标的峰面积比()对欧前胡素质量浓度()进行线性回归后得回归方程为=1.426 8+10.265 9,=0.992 2,因此,欧前胡素血浆对照品在20~1000 ng/mL线性关系良好。
2.8.4 专属性考察 取空白血浆、欧前胡素+空白血浆和血浆样品分别进HPLC,色谱图见图10,可见,血浆内源性物质不干扰欧前胡素及内标色谱峰,因此专属性较高。
2.8.5 稳定性考察 取欧前胡素普通片给药1.5 h的血浆样品,于0、1、3、6、9、12 h进HPLC测定,计算欧前胡素与内标峰面积之比的RSD为7.64%,所以血浆样品稳定性较好。
2.8.6 精密度考察 取质量浓度为25、250、1000 ng/mL血浆对照品溶液,连续进样6次,计算得欧前胡素与内标异欧前胡素峰面积之比的RSD分别为6.35%、7.09%、5.78%,所以日内精密度良好。取质量浓度为25、250、1000 ng/mL血浆对照品溶液,每天测定1次,连续测定6 d,计算得欧前胡素与内标峰面积之比的RSD分别为9.15%、10.26%、7.78%,所以日间精密度良好。
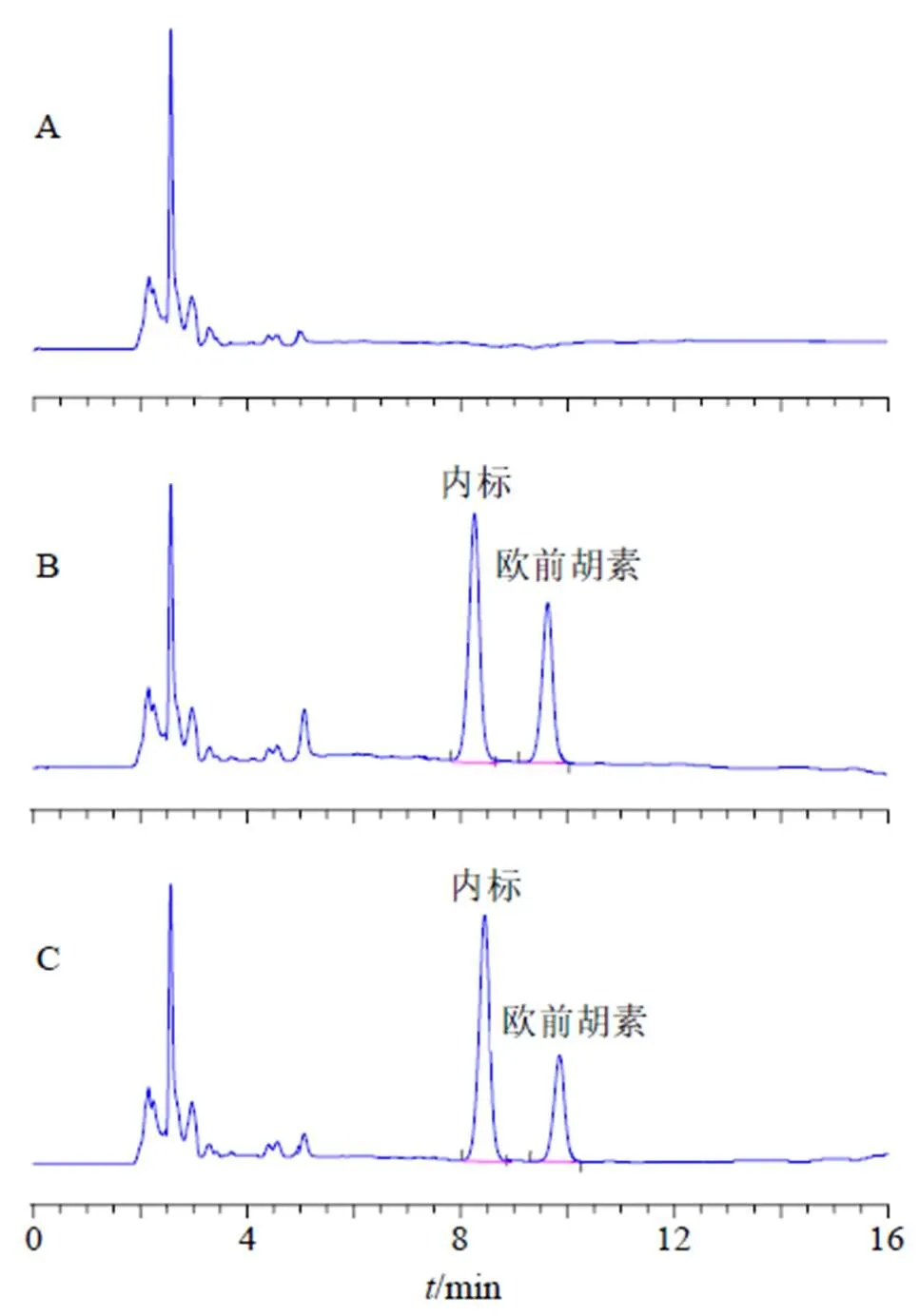
图10 空白血浆(A)、欧前胡素+空白血浆(B) 和血浆样品(C) 的HPLC图
2.8.7 回收率考察 取质量浓度为25、250、1000 ng/mL的欧前胡素对照品溶液,按照“2.8.2”项下所述方法制备血浆对照品溶液,进样测定欧前胡素与内标的峰面积,计算两者峰面积比值,带入=1.426 8+10.265 9计算欧前胡素的测得质量浓度,并与实际质量浓度相比计算回收率。结果显示,平均回收率为95.64%,RSD为7.71%。
2.8.8 药动学结果 主要药动学参数采用药动学分析软件DAS 2.0进行拟合,结果见表3。欧前胡素不同片剂的药-时曲线见图11。IMP-SD片的达峰时间(max)、达峰浓度(max)、药时曲线下面积(AUC0~t)等与欧前胡素普通片相比具有显著性差异(<0.05、0.01),其中max显著性提前,max显著性提高,波动幅度较大,相对生物利用度提高至191.47%。IMP-SD-HMSRT的max显著性延后至(4.08±0.43)h,max降低至(344.67±43.81)ng/mL,血药浓度波动幅度明显降低,体内平均滞留时间(MRT)显著延长(<0.01),与欧前胡素普通片相比相对生物利用度提高至219.76%,其生物利用度提高幅度高于IMP-SD片。
表3 主要药动学参数(, n = 6)
Table 3 Main pharmacokinetic parameters (, n = 6)
参数单位欧前胡素片IMP-SD片IMP-SD-HMSRT Tmaxh1.53±0.260.94±0.23*4.08±0.43**## Cmaxng∙mL−1405.08±57.33789.66±157.74**344.67±43.81*## T1/2h4.17±0.383.81±0.338.25±1.63**## AUC0~tng∙h∙mL−11 249.16±184.242 391.73±387.09**2 745.15±416.94**# AUC0~¥ng∙h∙mL−11 302.85±198.612 483.22±414.84**2 849.18±427.13**# MRTh2.32±0.312.71±0.373.54±0.46**## F%−191.47219.76
与欧前胡素普通片比较:*<0.05**<0.01;与IMP-SD片比较:#<0.05##<0.01
*< 0.05**< 0.01imperatorin tablets;#< 0.05##< 0.01IMP-SD tablets
2.9 体内外相关性评价
采用Loo-Rigelman法计算IMP-SD-HMSRT体内吸收率(a)[12-13]。

式中(A)表示时间体内药量,(A)¥为体内总药量,ρ表示时间血药浓度,10表示药物从中央室消除速率常数,d表示时间内的血药浓度曲线下面积,e为周边室内药物量,p表示周边室药量
按此公式计算a,并作为因变量,以各时间点的累积释放率F为自变量进行线性回归,评价IMP-SD-HMSRT体内外相关性。结果显示(表4),IMP-SD-HMSRT在pH 6.8磷酸盐缓冲液中相关系数最高(=0.981 9),回归方程为a=2.008 4F-11.697 3。因此IMP-SD-HMSRT可采用pH 6.8磷酸盐缓冲液(转篮法,75 r/min)来预测体外释放及体内吸收情况。
3 讨论
缓释材料HPMC型号(K4M、K15M、K30M)对IMP-SD-HMSRT体外释药影响较大,当HPMC K4M和HPMC K30M作为缓释材料时容易出现释药过快或释药过慢情况[14-16],可能是由于相对分子质量太大或太小时,均影响了凝胶层的缓释效果。HPMC K15M相对分子质量适中,故选为缓释材料,其用量对体外释药影响较大[16-17],结合单因素实验,确定其优化范围为30~60 mg/片。

图11 欧前胡素普通片、IMP-SD片和IMP-SD-HMSRT 药-时曲线(, n = 6)
HMSRT一般是通过扩散及溶蚀机制释放药物,因此,需加入一定量的PEG作为释药速率调节剂[10],PEG型号(PEG 400或PEG 4000)对释药影响也较大,单独采用PEG 400或PEG 4000时释药速率均不理想,因而采用两者混合物作为释药速率调节剂[9-10,18]。结合单因素实验结果,确定PEG400所占比例优化范围为30%~70%,PEG总量优化范围为10~30 mg/片。
表4 IMP-SD-HMSRT的评价结果(n = 6)
Table 4 Evaluation results of IMP-SD-HMSRT (n = 6)
溶出介质溶出条件回归方程相关系数 0.01 mol∙L−1盐酸溶液转篮法,75 r∙min−1Fa=1.794 1 Ft-9.971 50.769 6 pH 4.5醋酸-醋酸钠缓冲液转篮法,75 r∙min−1Fa=2.312 8 Ft-17.248 00.908 5 水转篮法,75 r∙min−1Fa=2.205 7 Ft-16.078 40.968 2 pH 6.8磷酸盐缓冲液转篮法,75 r∙min−1Fa=2.008 4 Ft-11.697 30.981 9
制备的IMP-SD-HMSRT释药过程可能是:IMP-SD-HMSRT进入水相后缓释片表层的HPMC高分子材料遇水发生水化,即在缓释片表层形成凝胶层,该凝胶层对内部药物释放起到阻滞效果。同时,IMP-SD-HMSRT处方中释药速率调节剂PEG物质遇水发生溶解,在凝胶阻滞层中留下释药通道。随着时间的延长骨架材料逐渐溶蚀,直至药物释放完毕[17],体外释药示意图见图12。
欧前胡素原料药溶解度较差,在8 h后血药浓度已低于定量限。IMP-SD在一定程度上促进了药物吸收,但在12 h后血药浓度已低于定量限。而IMP-SD-HMSRT增加了药物在胃肠道滞留时间,有助于药物被充分吸收,因而18 h时间点血药浓度仍在定量限之上,为真实反映IMP-SD-HMSRT体内药动学行为,故IMP-SD-HMSRT测定时间点设定至18 h。

图12 IMP-SD-HMSRT体外变化过程
家兔口服药动学结果显示,IMP-SD片的max显著性提前,max与欧前胡素普通片相比提高了1.95倍,这与SD提高药物溶解度、提高药物溶出速率及累积溶出度有关,但体内血药浓度波动幅度较大,可能会对安全性造成影响。而IMP-SD- HMSRT使max大大降低,这是由于缓释片中的高分子材料HPMC K15M口服遇水后形成凝胶层,控制了IMP-SD中药物的释放速率,同时也影响了入血速度,使max显著性延后[19],max波动幅度减小,且IMP-SD-HMSRT的生物利用度提高幅度高于IMP-SD片,说明HMSRT有助于药物被充分吸收,提高生物利用度[19-20]。本研究成功制备了IMP-SD- HMSRT,后期还需对其剂量[20]、给药方案、质量标准以及药效学评价等继续进行研究。
志谢:本研究由山东省职业教育栾会妮名师工作室资助(2019)
利益冲突 所有作者均声明不存在利益冲突
[1] 李晓强, 谭余庆, 李慧杰, 等. 欧前胡素药理作用及机制研究进展 [J]. 中国实验方剂学杂志, 2020, 26(18): 196-201.
[2] 于定荣, 翁小刚, 王本晓, 等. 延胡索、白芷炮制配伍对元胡止痛方中延胡索乙素、欧前胡素含量以及镇痛作用的影响 [J]. 中草药, 2021, 52(8): 2306-2312.
[3] 廖祥萍, 王怀伟, 刘南海, 等. 欧前胡素在中枢神经系统疾病治疗中的研究进展 [J]. 赣南医学院学报, 2019, 39(1): 97-100.
[4] 祝婧云, 汤涛, 廖正根, 等. 注射用欧前胡素脂微球处方前研究 [J]. 江西中医药大学学报, 2018, 30(4): 72-75.
[5] 尚曙玉, 张铁山, 徐凯, 等. 欧前胡素固体分散体的制备及其体内药动学研究 [J]. 中成药, 2021, 43(3): 574-579.
[6] 朱海, 孙旖, 夏振娜, 等. 欧前胡素急性毒性和安全药理学研究 [J]. 药学实践杂志, 2013, 31(6): 428-431.
[7] 高芸, 栾立标. 白芷中2种有效成分在大鼠小肠的吸收特性 [J]. 中国新药杂志, 2007, 16(14): 1094-1098.
[8] 孟戎茜, 王曼, 王慧芳, 等. 卡维地洛凝胶骨架缓释片的处方优选与表征 [J]. 中国现代应用药学, 2019, 36(15): 1876-1881.
[9] 郭留城, 杜利月, 郝海军, 等. 青藤碱固体脂质纳米粒凝胶骨架缓释片的制备及处方优化 [J]. 中国医院药学杂志, 2018, 38(18): 1893-1897.
[10] 付金芳, 曹伶俐, 李乘欣, 等. 氢溴酸高乌甲素纳米粒缓释片的制备 [J]. 中成药, 2017, 39(5): 952-955.
[11] 陈韡彬, 傅慧灵, 江宁宇, 等. 他克莫司缓释片的制备及体外释放度考察 [J]. 海峡药学, 2019, 31(1): 6-8.
[12] 胡杰, 侯靖宇, 陆苑, 等. 右旋酮洛芬氨丁三醇速释缓释双层片在Beagle犬体内的药物动力学及生物等效性 [J]. 沈阳药科大学学报, 2015, 32(8): 642-646.
[13] 王维, 王博, 连潇嫣, 等. 口服缓释制剂体内外相关性评价方法研究进展 [J]. 药物评价研究, 2011, 34(5): 380-383.
[14] 邓向涛, 阮晓东, 郝海军. 马钱子碱固体脂质纳米粒凝胶骨架缓释片的研制 [J]. 中草药, 2018, 49(22): 5298-5304.
[15] 李宏伟, 付金芳, 范明松. 白杨素固体脂质纳米粒水凝胶骨架缓释片的制备 [J]. 中成药, 2020, 42(3): 564-569.
[16] 邓向涛, 张文周, 张智强. 钩藤碱纳米混悬剂缓释片制备、优化与体外释放评价 [J]. 中草药, 2020, 51(20): 5128-5136.
[17] 董丹丹, 郑岩, 刘会珍, 等. 田蓟苷纳米混悬剂冻干粉缓释片制备工艺研究 [J]. 中草药, 2019, 50(12): 2841-2847.
[18] 徐芳芳, 石伟, 张晖, 等. 穿心莲总内酯亲水凝胶骨架片的制备及体外释药机制研究 [J]. 中国中药杂志, 2015, 40(1): 79-83.
[19] Zhang R, Zhang Y, Wu Y,. Succinylated whey protein isolate as a sustained-release excipient of puerarin derivative oral tablets: Preparation, optimization and pharmacokinetics [J]., 2018, 13(4): 383-394.
[20] Wang L, Liu X. Sustained release technology and its application in environmental remediation: A review [J]., 2019, 16(12): 2153- 2155.
Preparation of imperatorin solid dispersion hydrogel matrix sustained-release tablets and pharmacokinetic evaluation
XU Zhi-jie
Weihai Ocean Vocational College, Weihai 264300, China
To prepare imperatorin solid dispersion (IMP-SD) hydrogel matrix sustained-release tablets (IMP-SD- HMSRT), and investigate the pharmacokinetic behavior and-correlation.Solvent evaporation was used to prepare IMP-SD. On the basis of single factor investigation, HPMC K15M dose, PEG 400 proportion and amounts of PEG dose were selected as main influencing factors, composite score of cumulative rate of 2, 6, and 12 h of IMP-SD-HMSRT was used as response value, Box-Behnken design-response surface method was employed to optimize formulation of IMP-SD-HMSRT, and the pharmacokinetic behavior in rabbits was studied. Loo-Rigelman method was used for the evaluation ofandcorrelation.The optimal formulation of IMP-SD-HMSRT: HPMC K15M dose was 48 mg/tablet, PEG 400 proportion was 58%, PEG total dose was 26.5 mg/tablet. The accumulative release of IMP-SD-HMSRT could achieve 95.54% whthin 12 h. Pharmacokinetic results showed thatmaxfluctuated slightly, andmaxwas delayed to (4.08 ± 0.43) h. The relative bioavailability of the IMP-SD-HMSRT was enhanced to 219.76% comparing to imperatorin tablets.release behavior of IMP-SD-HMSRT in pH 6.8 phosphate buffer saline was associated with itspharmacokinetics.The drug release of IMP-SD-HMSRT was slowly, and promoted absorption. The correlation between the absorptionand releaseis fine.
imperatorin; solid dispersion; hydrogel matrix sustained-release tablets; Box-Behnken design-response surface method; pharmacokinetics
R283.6
A
0253 - 2670(2022)17 - 5321 - 09
10.7501/j.issn.0253-2670.2022.17.008
2022-02-17
国家自然科学青年基金资助项目(51804021)
徐志杰(1984—),女,硕士,讲师,研究方向为现代给药系统与制剂新技术。Tel: (0631)7697687 E-mail: xzj18669333606@126.com
[责任编辑 郑礼胜]

