茶皂素稳定的芹菜素纳米乳制备及其体外释放研究
张旭敏,谢 龙,赵雨芯,李芝蓓,李小芳
茶皂素稳定的芹菜素纳米乳制备及其体外释放研究
张旭敏,谢 龙,赵雨芯,李芝蓓,李小芳*
成都中医药大学药学院,中药材标准化教育部重点实验室,四川省中药资源系统研究与开发利用重点实验室,省部共建国家重点实验室培育基地,四川 成都 611137
以茶皂素为天然乳化剂制备芹菜素纳米乳液(AP-NE),并对其进行稳定性和体外释放特性的考察,以期获得新型绿色的纳米制剂。采用高速剪切结合高压均质技术制备AP-NE,以平均粒径和多分散指数(PDI)为自变量,运用总评归一值(OD)法对数据进行处理,采用Box-Behnken效应面法优化处方并进行验证,并对最优处方制备的AP-NE进行理化性质和体外释放特性考察。优化结果表明AP-NE的最优制备处方为芹菜素质量分数0.40%、茶皂素质量浓度2.0 mg/mL、油相用量(蓖麻油-辛癸酸甘油酯1∶3)3 mL;测得AP-NE的平均粒径为(259.5±3.6)nm、PDI为0.103±0.005、ζ电位为(−35.81±0.42)mV、电导率为(88.60±1.00)μS/cm,pH为7.37±0.08,溶解度为(128.12±1.35)μg/mL,载药量为(5.77±0.08)%,浊度为(99.45±1.69)cm−1(=3);经染色法鉴别为O/W乳液,透射电子显微镜观察乳滴不粘连,大小均一,呈圆球状;稳定性试验表明AP-NE稳定性良好;体外释放研究表明AP-NE中芹菜素的释放具有缓慢和持续的趋势。以茶皂素作为乳化剂制备的纳米乳可明显提高芹菜素的溶解度和稳定性,是一种潜在的可提高药物有效性的新型纳米制剂。
芹菜素;纳米乳;茶皂素;高速剪切-高压均质技术;Box-Behnken效应面法;理化性质;稳定性;体外释放
芹菜素(apigenin),又称芹黄素、洋芹素,是一种天然植物黄酮,大量存在于常见的水果和蔬菜中,例如橙子、柚子、芹菜、欧芹、洋葱、百里香、薄荷、橄榄、甘菊和麦牙菜中,被认为是一种具有抗炎、抗氧化和抗癌作用的生物活性类黄酮[1-4]。然而,由于芹菜素在水中溶解度低,最大溶解度为2.16 μg/mL,且肠通透性高,被归为生物药剂学分类系统(Biopharmaceutics Classification System,BCS)的II类药物[5],严重影响其口服生物利用度进而影响其临床疗效的发挥。目前,为了改善芹菜素溶解度和生物利用度低的问题,大量学者引入了多种新型的制剂,例如纳米晶[6-7]、纳米粒[8-9]、醇质体[10]、胶束[11]、纳米囊[12]、乳剂[13-14],这些制剂存在载药量低,加入大量合成辅料使安全性降低等问题。
纳米乳作为一种新型载体,其内部同时存在亲水和亲油区域,可以形成牢固的油水界面膜,能显著改善难溶性药物的溶解性和生物利用度,为解决中药难溶性有效成分和有效部位的成药性问题提供了新思路[15]。然而,合成类表面活性剂的加入给制剂临床上的使用带来了安全隐患,例如聚山梨酯-80会导致严重的神经毒性、肾毒性或细胞毒性,长期使用会对人体产生毒副作用[16]。
茶皂素分子是由疏水性的苷元和亲水性的糖体以及有机酸3部分构成,由于其糖体、有机酸及配基上的羟基是亲水基团,同时五元环配基主体为疏水基团,因此,茶皂素可作为一种天然非离子型表面活性剂[17-18],近年来已被应用于多种研究[16,19-22]之中。本实验以天然表面活性剂茶皂素为乳化剂制备芹菜素纳米乳(apigenin nanoemulsion,AP-NE),旨在提高芹菜素的溶解度和生物利用度,并探索茶皂素作为天然稳定剂的可能。
1 仪器与材料
1.1 仪器
Agilent 1260型高效液相色谱仪,DAD检测器,美国Agilent公司;AH100D型高压均质机,加拿大ATS公司;NICOMP 380ZLS型激光粒度测定仪,美国PSS粒度仪公司;DDS-11C型电导率仪、pHs-2F pH计,上海仪电科学仪器股份有限公司;C25型实验室分散乳化均质机,上海恒川机械设备有限公司;XMI9007-8型智能温湿度仪,重庆英博实验仪器有限公司;80-1型离心沉淀器,江苏正基仪器有限公司;KQ5200DE型数控超声波清洗器,昆山市超声仪器有限公司;UV-6100型紫外分光光度仪,上海美谱达仪器有限公司;JEM 1200EX型透射电子显微镜(TEM),日本JEOL公司。
1.2 材料
芹菜素对照品(批号MUST-21030615,质量分数98.03%),成都曼斯特生物科技有限公司;芹菜素(批号GL20201223,质量分数98.30%)、茶皂素(批号GL20200429,质量分数90.31%),西安小草植物科技有限责任公司;辛癸酸甘油酯(CT,食品级)、肉豆蔻酸异丙酯(IPM,日化级)、棕榈酸异丙酯(PI,日化级),山东优索化工科技有限公司;油酸、蓖麻油、甲醇,均为分析纯,成都市科隆化学品有限公司;油酸乙酯,批号20180926,质量分数98.0%~100.0%,化学纯,国药集团化学试剂有限公司;聚山梨酯-80、磷酸(GR级),成都市科龙化工试剂厂;透析袋MD34-5m(截留相对分子质量8000~14 000),成都诺舟生物科技有限公司。
2 方法与结果
2.1 AP-NE的制备
采用高速剪切结合高压均质法制备AP-NE[23]。精密称取处方量的芹菜素原料药,加入油相,超声使其充分混匀。另精密称取处方量的茶皂素,加入去离子水,超声使其充分溶解,作为水相。将水相转入油相中,置于转速为19 000 r/min的高速剪切机下进行剪切2 min,制得粗乳液,将粗乳液在100 MPa压力条件下进行高压均质6次,即得AP-NE。
在不加原料药的条件下,按AP-NE的制备方法制备,即得空白纳米乳。
2.2 芹菜素的测定
参考文献方法[4,8]进行。
2.2.1 色谱条件[8]色谱柱为Comatex-C18柱(250 mm×4.6 mm,5 μm);检测波长337 nm;流动相为甲醇-0.1%磷酸水溶液(62∶38);体积流量1.0 mL/min;柱温35 ℃;进样量5 μL。
2.2.2 对照品溶液的制备[23]精密称取芹菜素对照品5.32 mg,置于50 mL量瓶中,加入适量甲醇溶解,超声,定容至刻度,摇匀,配制成质量浓度为106.40 μg/mL的芹菜素对照品溶液。
2.2.3 供试品溶液的制备 精密量取芹菜素纳米乳液(AP-NE)1 mL,置于10 mL量瓶中,加入适量甲醇,超声30 min破乳后,静置10 min,用甲醇定容,用微孔滤膜滤过,取续滤液作为供试品溶液。
2.3 乳液分层指数的计算
将制得的AP-NE装于玻璃瓶中,室温静置,定时观察分层、絮凝、沉淀等现象,记录乳液层高度,计算乳液分层指数[23]。
分层指数=1-H/0
H、0分别为、0时刻乳液层的高度
2.4 Box-Behnken响应面法优化AP-NE处方
2.4.1 Box-Behnken设计试验 在前期单因素试验[4]的基础上,以芹菜素质量分数(1)、茶皂素质量浓度(2)、油相用量(3)为影响因素,分别以AP-NE的平均粒径(1)和PDI(2)的总评归一值(overall desirability,OD)为评价指标,采用3因素3水平的Box-Behnken效应面法进行试验设计[24-25]。因素与水平及试验安排与结果见表1。由于2个指标值均越小越好,因此选用公式OD=(12…d)1/n以及d=(max-Y)/(max-min)对OD值进行计算。
2.4.2 数学模型拟合及分析 基于以上数据,使用Design-Expert 8.0.6软件对OD值进行多元回归二次多项式拟合,得到回归方程OD=0.83-0.0921+0.0302+0.0693+0.19012+0.20013+0.01323-0.40012-0.05822-0.09432,2=0.978 9,<0.000 1。
方差分析结果(表2)表明该模型的值小于0.000 1,表明该模型有意义,可用于优化AP-NE的制备工艺。回归方程的拟合决定系数2为0.978 9>0.95,表明实测值与预测值之间存在高度的相关性,能准确预测实验结果;其校正决定系数(adj2)=0.951 8,表明模型响应值的变化有95.18%来源于本实验所选自变量,实验误差较小,试验方法可靠。以上数据表明,该模型可用于预测和分析AP-NE的最佳制备工艺。
2.4.3 响应面优化与预测 根据拟合结果,绘制三维效应曲线图,预测AP-NE的最佳制备处方工艺,结果见图1。基于Box-Behnken响应面,通过Design- Expert 8.0.6软件预测优化后的最优处方为芹菜素质量分数0.40%,茶皂素质量浓度2.04 mg/mL,油相用量为2.98 mL,最优配方的OD预测值为0.842。为使测定结果更加准确,优化处方修改为AP质量分数0.40%,茶皂素质量浓度2.00 mg/mL,油相用量3.00 mL。
表1 响应面试验设计及结果
Table 1 Arrangement and results of response surface test
编号X1/%X2/(mg∙mL−1)X3/mLY1/nmY2OD编号X1/%X2/(mg∙mL−1)X3/mLY1/nmY2OD 10.30 (−1)1.75 (−1)2.40 (0)252.20.1980.597100.30 (−1)2.00 (0)0.60 (−1)282.70.1620.547 20.40 (0)2.25 (+1)0.60 (−1)294.80.1010.573110.50 (+1)1.75 (−1)2.40 (0)262.30.2890.000 30.40 (0)1.75 (−1)4.20 (+1)262.40.1230.750120.40 (0)2.00 (0)2.40 (0)254.80.1290.778 40.30 (−1)2.00 (0)4.20 (+1)320.60.1290.263130.40 (0)1.75 (−1)0.60 (−1)272.90.1550.619 50.50 (+1)2.25 (+1)2.40 (0)302.10.0950.516140.50 (+1)2.00 (0)4.20 (+1)274.50.1910.522 60.30 (−1)2.25 (+1)2.40 (0)285.20.2300.363150.40 (0)2.00 (0)2.40 (0)253.40.0930.869 70.40 (0)2.00 (0)2.40 (0)251.70.1350.779160.40 (0)2.25 (+1)4.20 (+1)284.90.0350.756 80.40 (0)2.00 (0)2.40 (0)260.00.0900.836170.50 (+1)2.00 (0)0.60 (−1)329.10.0880.000 90.40 (0)2.00 (0)2.40 (0)252.30.0950.871
表2 OD回归方程的方差分析
Table 2 Variance analysis of regression equation of OD
方差来源离差平方和自由度均方F值P值方差来源离差平方和自由度均方F值P值 模型1.17090.13036.08<0.000 1X120.67010.670185.73<0.000 1 X10.06710.06718.530.003 5X220.01410.0143.920.088 2 X27.293×10−317.293×10−32.020.198 6X320.03710.03710.270.015 0 X30.03810.03810.520.014 2残差0.02573.617×10−3 X1X20.14010.14038.860.000 4失拟项0.01735.606×10−32.640.186 0 X1X30.16010.16044.920.000 3纯误差8.500×10−342.125×10−3 X2X36.611×10−416.611×10−40.180.681 8总离差1.20016
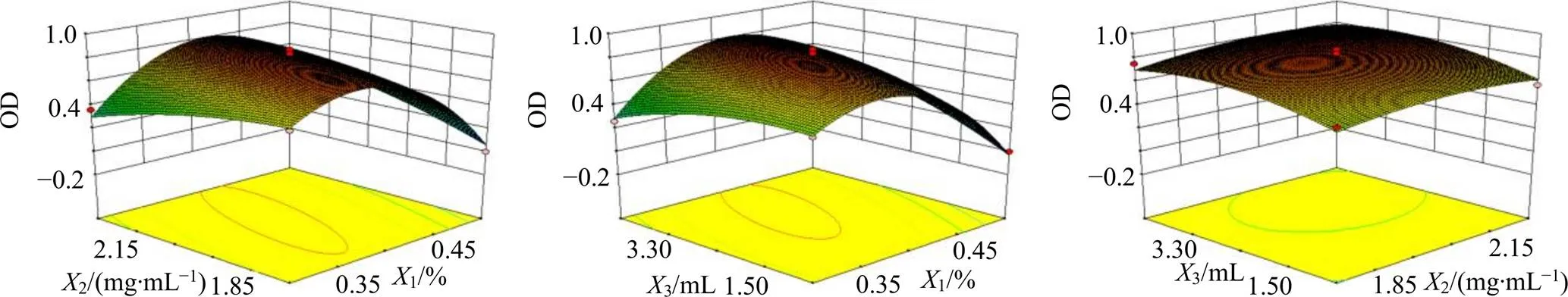
图1 X1、X2、X3对OD值影响的效应曲面图
2.4.4 处方验证试验 结合既定的工艺参数,根据上述修正后的最佳处方,平行制备3批AP-NE,测得平均粒径、PDI和OD值见下表3。各实测值与预测值接近,说明采用总评归一法得到的回归方程预测性良好,处方的优化较为理想。
表3 验证试验(, n = 3)
Table 3 Verification test (, n = 3)
批次粒径/nmPDIOD值 1259.5±3.60.103±0.0050.811±0.003 2261.7±4.20.099±0.0040.807±0.007 3260.3±2.90.105±0.0030.802±0.006
2.5 理化性质考察
2.5.1 AP-NE类型的鉴别(染色法) 利用油溶性染料苏丹Ⅲ(红色)和水溶性染料亚甲基蓝(蓝色)在纳米乳中扩散的快慢来判断纳米乳的类型[26-27]。取等量的AP-NE于2支试管中,分别加入适量且等量的亚甲基蓝和苏丹III,结果显示,亚甲基蓝在AP-NE中的扩散速度快于苏丹III,表明AP-NE为O/W型纳米乳。
2.5.2 AP-NE的微观形貌 取适量纳米乳,用蒸馏水稀释至适当浓度,滴于覆有支撑膜的铜网上。静置10 min后,用滤纸吸去多余的液体,然后加入3%磷钨酸溶液(pH 7.0)负染90 s,再用滤纸吸去多余的液体。自然蒸发后,用TEM分别在100 nm和200 nm的尺寸下观察AP-NE的微观形貌,结果见图2,AP-NE呈圆球形,大小均匀,乳滴之间无粘连,成型性好。
2.5.3 溶解度的测定 采用HPLC法测得AP-NE中芹菜素的溶解度为(128.12±1.35)μg/mL,与未加乳化剂的阴性对照纳米乳的溶解度(34.81±0.25)μg/mL相比,增加了2.68倍;AP-NE平均载药量为(5.77±0.08)%,包封率为(91.32±0.93)%(=3)。

图2 AP-NE的TEM图
2.5.4 pH值的测定 按最优处方制备新鲜的AP- NE,室温下采用pH计测定其pH值,重复3次,求平均值,结果为7.37±0.07(=3)。
2.5.5 电导率的测定 按最优处方制备新鲜的AP- NE,室温下采用电导率仪测定其电导率,重复3次,求平均值,结果为(88.60±1.14)μS/cm(=3)。
2.5.6 ζ电位的测定 按最优处方制备新鲜的AP- NE,采用激光粒度测定仪测定其ζ电位,重复3次,求平均值,结果为(−35.81±0.38)mV(=3)。
2.5.7 浊度的测定[28]按最优处方制备新鲜的AP- NE,精密吸取适量的纳米乳于50 mL量瓶中,用去离子水稀释1000倍,采用紫外分光光度法在680 nm下测定其透光率,重复3次,求平均值,光程长为1 cm,根据公式计算得其浊度为(99.45±1.69)cm−1(=3)。
=/ln(0/)=/ln(1/)
为浊度,为光程长,为稀释倍数,0为光透过参比测试样后照射到光电转换器上的强度,为光透过被测试样后照射到光电转换器上的强度,为透光率
2.6 离心稳定性考察
按最佳制备工艺制备2组新鲜的AP-NE,I组为加了乳化剂茶皂素的纳米乳液,II组为不加乳化剂茶皂素的纳米乳液。室温下精密吸取8 mL于离心管中,在4000 r/min下离心60 min,观察纳米乳的外观形态,以离心前、后吸光度()值的变化表征其离心稳定性,计算离心稳定常数()[29]。
2.6.1 外观 离心结果显示AP-NE仍为乳白色均一状态,未发生聚集、凝结、相分离和破乳现象,表明AP-NE稳定性良好。
2.6.2值的计算 按最优处方制备新鲜的AP- NE,于离心前测定乳液的值记为0,离心后测定上清液的值记为1,平行测定3次。根据公式=1/0计算值,值越大,表明离心稳定性越好。离心稳定性结果如表4所示,I组离心稳定性远远优于II组,表明AP-NE在上述离心条件下含量、性质保持稳定,离心稳定性良好,且乳化剂茶皂素可以提高纳米乳的稳定性。
表4 离心稳定性结果(, n = 3)
Table 4 Results of centrifugal stability (, n = 3)
组别A0A1K/% I0.479±0.0010.465±0.00197.08 II0.352±0.0010.256±0.00072.73
2.7 温度和光照稳定性考察
分别制备2组AP-NE,I组为以最佳工艺制备的AP-NE,II组为不加乳化剂茶皂素制备的AP-NE,分别于4、25、60 ℃,(4500±500)lx的药品稳定性试验箱中放置20 d以上,分别在第0、5、10、15、20天进行取样考察,分析在不同温度和光照条件下乳剂粒径、PDI、浊度、含量变化率、乳液分层指数等参数变化。
表5显示了从纳米乳液分层指数变化角度的稳定性结果。可以明显看出,I组和II组纳米乳在60 ℃保存20 d后分层指数明显增加,分别达到2.86%、14.26%,且2组纳米乳在储存20 d后分层指数变化趋势均为60 ℃>25 ℃>强光>4 ℃。另外,I组纳米乳在强光照射条件下稳定性较好。
表5 不同温度和强光对AP-NE的分层指数的影响(, n = 3)
Table 5 Effects of different temperature and bright light on stratified index of AP-NE (, n = 3)
t/dI组分层指数/%II组分层指数/% 4 ℃25 ℃60 ℃强光4 ℃25 ℃60 ℃强光 000000000 5000.220.160.751.472.141.91 100.811.321.710.741.181.853.973.87 150.911.762.111.304.866.8611.438.21 201.691.942.861.798.5212.0514.2610.95
表6、7分别展示了不同环境分别对2组纳米乳液粒径、浊度和含量变化率的影响。温度稳定性试验结果表明,在粒径方面上,除60 ℃外,I组纳米乳液在不同环境胁迫下在260 nm左右稳定20 d。这可能与ζ电位相对较高且恒定的绝对值密切相关,从而导致强烈的静电排斥以维持系统的稳定性;而II组粒径呈现不同程度的增长趋势,其中60 ℃组增长最为明显,在20 d后粒径增长率达到26.67%,这是因为纳米乳液为热力学不稳定体系,随着温度的升高,分子运动速率逐渐加快,增大了粒子间相互碰撞的几率,从而使粒径加大,而茶皂素可以有效缓解高温所致的聚集现象的发生。
表6 不同温度和强光对I组(含茶皂素)AP-NE稳定性的影响(, n = 3)
Table 6 Effects of different temperature and bright light on stability of AP-NE (I) (, n = 3)
t/d粒径/nm浊度/cm−1含量变化率/% 4 ℃25 ℃60 ℃强光4 ℃25 ℃60 ℃强光4 ℃25 ℃60 ℃强光 0259.0259.7259.2259.499.82100.93103.2199.820000 5260.7259.8263.9263.691.02124.43118.7896.515.972.5117.552.18 10261.3261.1265.5261.788.83116.53103.14115.418.815.4523.2610.22 15261.7261.4268.8269.697.61114.29107.59125.0312.6715.5939.3312.29 20262.9264.2277.5267.493.21123.30140.41123.3017.2618.5940.8310.28
表7 不同温度和强光对II组(不含茶皂素)AP-NE稳定性的影响(, n = 3)
Table 7 Effects of different temperature and bright light on stability of AP-NE (II) (, n = 3)
t/d粒径/nm浊度/cm−1含量变化率/% 4 ℃25 ℃60 ℃强光4 ℃25 ℃60 ℃强光4 ℃25 ℃60 ℃强光 0414.7416.0422.2419.6270.50271.81271.81270.500000 5416.2418.3432.6420.7301.11310.61316.08313.346.978.2221.947.62 10420.6420.5456.7435.3343.90350.98350.98348.1434.7338.0151.2742.36 15421.2425.4480.0440.9279.71265.27251.03262.6652.4760.2869.1956.35 20456.9461.2534.8471.2218.16221.89194.80219.4067.3065.5973.0762.54
浊度方面,由表6可以看出,I组纳米乳在4 ℃和25 ℃条件下,纳米乳液的浊度没有随着储存时间的延长而发生显著变化,而60 ℃组纳米乳液的浊度呈逐渐增加的趋势,特别是存放20 d后,浊度增长速度达到34.55%。这可能是由于在高温条件下较长的储存时间会导致乳化剂亲水端的脱水和较低的界面张力,导致颗粒聚集增加,乳液体系浑浊,最终导致浑浊度增加。
此外,表面活性剂脱水降低了油滴之间的空间排斥,从而使油滴更靠近并聚结[30];而II组纳米乳各条件下浊度均呈现先增大后减小的趋势,这可能是因为纳米乳在储存初期由于不存在乳化剂,粒子间相互碰撞聚集,导致乳液体系变浑浊,浊度增大,继续放置储存,乳液因分层沉降从而使透明度增大,浊度降低。此外,含量变化率越低,稳定性越好。2组纳米乳在60 ℃下储存20 d后芹菜素含量的变化率均远高于4 ℃和25 ℃条件下的变化率,且II组纳米乳在各条件下储存15 d后含量变化率均达到50%以上。综上所述,温度稳定性测试表明,I组纳米乳在各项条件下的各项指标均优于II组,表明茶皂素可以在一定程度上起到稳定纳米乳液的作用,且纳米乳液最好在25 ℃以下保存。另外,茶皂素乳化的纳米乳液在强光条件下,考察期间各项指标均无明显变化,说明该纳米乳液体系在该条件下较为稳定。
2.8 短期储存稳定性考察
按优化后的处方平行制备3批新鲜的AP-NE,乳剂室温保存40 d,分别在第0、5、10、15、20、25、30、35、40天进行取样考察,以粒径、PDI、浊度、ζ电位和乳液分层指数等指标评价其短期稳定性。40 d短期稳定性测试结果如表8所示。结果表明,40 d内茶皂素乳化的AP-NE具有良好的稳定性,在40 d的储存期内没有出现明显的分层、絮凝、聚集等不稳定现象。粒径和浊度分别保持在260 nm和105 cm−1左右,而PDI始终在0.09~0.15波动。
此外,ζ电位大致表征了乳液颗粒的表面电荷。高绝对值会导致粒子之间的排斥力,这可能会提高多相系统的物理稳定性[31]。ζ电位的绝对值较高,维持在33 mV左右,这可能是纳米乳液体系稳定的重要原因。
表8 AP-NE在40d内的粒径、PDI、ζ电位和浊度的变化(, n = 3)
Table 8 Changes in particle size, PDI, ζ potential and turbidity of AP-NE within 40 d (, n = 3)
t/d粒径PDIζ电位/mV浊度/cm−1 0259.80.105−35.97106.51 5255.00.122−32.22102.05 10260.20.095−32.95108.78 15261.90.101−34.50103.53 20266.80.145−32.19108.97 25260.40.128−27.08108.97 30258.60.142−29.41105.56 35266.00.106−32.50109.91 40263.00.143−32.55109.26
2.9 体外释放度考察
精密吸取AP-NE 5 mL,置于预先处理好的透析袋中,透析袋两端用夹子固定,以磷酸盐缓冲溶液(pH 7.4)和1%聚山梨酯-80用作释放介质,然后放入装有50 mL释放介质的烧杯中,透析袋完全没入液面以下,同时以芹菜素对照品溶液作为对照。在37 ℃的环境温度下,将其在恒温摇床中以100 r/min的恒定速度搅拌3 d。分别于0.5、1、2、3、4、5、6、7、8、10、12、24、36、48、60、72 h末从烧杯中取出2 mL透析液,并补充等温等量的新鲜透析介质保持水槽状态,样品经微孔滤膜滤过后,按“2.2.1”项下色谱条件进样,测定芹菜素的质量浓度,根据下式计算芹菜素的累积释放率并绘制累积释放曲线,结果见图3。
使用动力学模型分析纳米乳中药物的释放数据,动力学分析结果见表9。
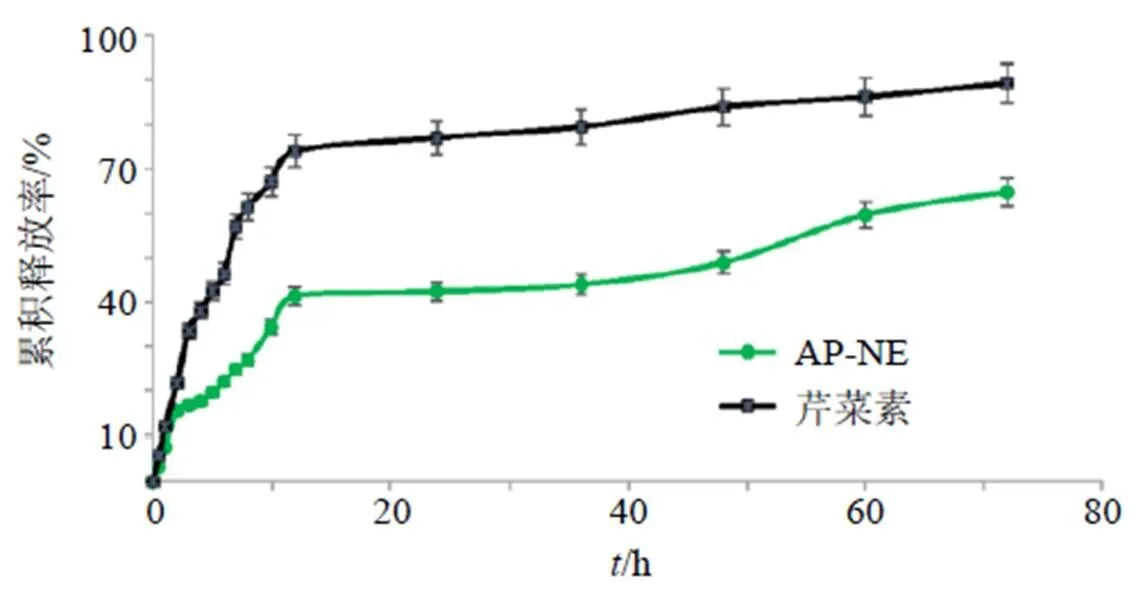
图3 对照品溶液和AP-NE中AP在含有1%聚山梨酯-80的磷酸盐缓冲溶液(pH 7.4)中的累积释放率(, n = 3)
表9 AP-NE释放研究中芹菜素的动力学模型
Table 9 Kinetic model of apigenin in AP-NE release studies
拟合模型方程R2 零级动力学Q=0.760 t+15.4050.807 一级动力学lnQ=54.616-0.093 t0.933 HiguchiQ=7.273 t1/2+4.0620.940 Ritger-PeppaslnQ=0.402 lnt+11.3500.955
Q=(0C+C)/
Q为药物不同时刻的累积释放率,为不同时刻,0为释放介质的总体积,C为不同时刻测得的药物质量浓度,为每次取样体积,为投入药物总质量
从图3中可以清楚地看出,与AP-NE相比,对照品溶液中芹菜素的释放速度要快得多。在前12 h内,(73.94±1.58)%的芹菜素从游离溶液中释放出来,而(41.25±0.46)%的芹菜素从AP-NE中释放出来。该成分从纳米乳中缓慢释放可能是由于茶皂素稳定的AP-NE的强包封作用,它为模拟胃肠道条件下的药物提供了保护屏障。
从表9中可观察到,与零级释放模型(2=0.807)相比,一级动力学模型具有更好的拟合(2=0.933),这表明纳米乳液的药物释放过程取决于浓度。Higuchi和Ritger-Peppas模型很好地拟合了实验数据,相关系数在0.940~0.955,表明药物从纳米乳液中的释放涉及多种机制,例如指数()小于0.5的菲克释放机制[32]。从该释放研究中发现,茶皂素稳定的AP-NE中的芹菜素遵循缓释模式,可以在更长的时间内发挥治疗作用。
3 讨论
根据能量获得方式的不同将制备纳米乳的方法分为高能乳化法和低能乳化法[33],本实验着眼于采用高能乳化法,即高速剪切结合高压均质技术,以天然表面活性剂茶皂素为乳化剂制备AP-NE,以期改善芹菜素的溶解度,克服其口服利用度低和给药不稳定的问题,并探究茶皂素作为天然乳化剂形成和稳定芹菜素纳米乳的潜力。研究表明AP-NE中芹菜素的溶解度为(128.12±1.35)μg/mL,与芹菜素在水中的溶解度2.16 μg/mL相比,增加了58.31倍;与未加乳化剂的阴性对照纳米乳的溶解度(34.81±0.25)μg/mL相比,增加了2.68倍。此外,体外释放试验表明AP-NE可有助于改善芹菜素的口服生物利用度。
温度和光照稳定性试验中,在强光条件以及不同的温度条件下,随着储存时间的延长,I组的各项指标都在不同程度上优于II组,表明茶皂素可以在一定程度上起到稳定纳米乳液的作用。I组中,光照稳定性试验表明,在强光照射(4500±500)lx条件下AP-NE含量和性质保持稳定;温度稳定性试验表明,高温60 ℃导致乳液分层指数、浊度和含量变化率发生明显的增长,而温度低于25 ℃组指标均无明显的变化,说明纳米乳液最好在25 ℃以下保存。另外,茶皂素稳定的纳米乳液在40 d内的储存稳定性良好。
总体而言,本研究揭示了茶皂素作为天然乳化剂形成纳米乳来包封水不溶性药物芹菜素的可能性,但茶皂素的安全性和生物相容性,以及制剂的安全性和体内药效学评价仍需进一步开展。
利益冲突 所有作者均声明不存在利益冲突
[1] Byun S, Park J, Lee E,. Src kinase is a direct target of apigenin against UVB-induced skin inflammation [J]., 2013, 34(2): 397-405.
[2] Huang C S, Lii C K, Lin A H,. Protection by chrysin, apigenin, and luteolin against oxidative stress is mediated by the Nrf2-dependent up-regulation of heme oxygenase 1 and glutamate cysteine ligase in rat primary hepatocytes [J]., 2013, 87(1): 167-178.
[3] Wu D G, Yu P, Li J W,. Apigenin potentiates the growth inhibitory effects by IKK-β-mediated NF-κB activation in pancreatic cancer cells [J]., 2014, 224(1): 157-164.
[4] 张旭敏, 李小芳, 刘凯, 等. 芹菜素纳米乳液的制备及其在人工胃肠液中的稳定性研究[J]. 中药与临床, 2022, 13(2): 21-27.
[5] Zhang J J, Liu D P, Huang Y T,. Biopharmaceutics classification and intestinal absorption study of apigenin [J]., 2012, 436(1/2): 311-317.
[6] Al Shaal L, Shegokar R, Müller R H. Production and characterization of antioxidant apigenin nanocrystals as a novel UV skin protective formulation [J]., 2011, 420(1): 133-140.
[7] Zhang J J, Huang Y T, Liu D P,. Preparation of apigenin nanocrystals using supercritical antisolvent process for dissolution and bioavailability enhancement [J]., 2013, 48(4/5): 740-747.
[8] Das S, Das J, Samadder A,. Strategic formulation of apigenin-loaded PLGA nanoparticles for intracellular trafficking, DNA targeting and improved therapeutic effects in skin melanoma[J]., 2013, 223(2): 124-138.
[9] Wu W W, Zu Y G, Wang L,. Preparation, characterization and antitumor activity evaluation of apigenin nanoparticles by the liquid antisolvent precipitation technique [J]., 2017, 24(1): 1713-1720.
[10] Shen L N, Zhang Y T, Wang Q,. Enhancedandskin deposition of apigenin delivered using ethosomes [J]., 2014, 460(1/2): 280-288.
[11] Zhai Y J, Guo S S, Liu C H,. Preparation andevaluation of apigenin-loaded polymeric micelles [J]., 2013, 429: 24-30.
[12] Ding B Y, Chen H, Wang C,. Preparation andevaluation of apigenin loaded lipid nanocapsules [J]., 2013, 13(10): 6546-6552.
[13] Kim B K, Cho A R, Park D J. Enhancing oral bioavailability using preparations of apigenin-loaded W/O/W emulsions:andevaluations [J]., 2016, 206: 85-91.
[14] Zhao X, Wang Z N, Li X P. Preparation,release and antioxidant potential of formulation of apigenin with hydroxypropyl-β-cyclodextrin modified microemulsion [J]., 2016, 86(1/2): 93-102.
[15] Shakeel F, Faisal M S. Nanoemulsion: a promising tool for solubility and dissolution enhancement of celecoxib [J]., 2010, 15(1): 53-56.
[16] Long J Y, Song J W, Zhang X M,. Tea saponins as natural stabilizers for the production of hesperidin nanosuspensions [J]., 2020, 583: 119406.
[17] 郭霞, 许荣年, 秦志荣. 新型非离子表面活性剂茶皂素的研究进展 [J]. 中国洗涤用品工业, 2011(2): 43-46.
[18] 谢秋英, 黄玉英, 宋振荣. 茶皂素的提取纯化及成品中茶皂素含量的测定 [J]. 福建水产, 2010, 32(2): 14-17.
[19] Deng M, Chen H J, Xie L,. Tea saponins as natural emulsifiers and cryoprotectants to prepare silymarin nanoemulsion [J]., 2022, 156: 113042.
[20] Ma M J, Yuan Y K, Yang S,. Fabrication and characterization of zein/tea saponin composite nanoparticles as delivery vehicles of lutein [J]., 2020, 125: 109270.
[21] Sun Y, Zou M T, Li C Y,. The solubilization of naphthalene using tea saponin as a biosurfactant: Effect of temperature [J]., 2021, 335: 116475.
[22] Yuan Y K, Xiao J Z, Zhang P Y,. Development of pH-driven zein/tea saponin composite nanoparticles for encapsulation and oral delivery of curcumin [J]., 2021, 364: 130401.
[23] 廖艳梅, 李小芳, 刘罗娜, 等. 橙皮苷纳米乳液的制备及其稳定性研究 [J]. 中草药, 2019, 50(10): 2312-2318.
[24] Song J W, Long J Y, Xie L,. Solubilization and changes of physicochemical properties of baicalin by nano sponge, and toxicity of zebrafish liver [J]., 2020, 60: 102003.
[25] 谢青璇, 李小芳, 谢龙, 等. Box-Behnken效应面法优化大黄素/小檗碱-壳聚糖双载药纳米粒的处方工艺研究 [J]. 中草药, 2021, 52(6): 1614-1622.
[26] 何文, 吴文英. O/W型硝苯地平透皮纳米乳的制备及质量评价 [J]. 中国药师, 2017, 20(4): 668-673.
[27] 张琳琳, 李小芳, 谢龙, 等. 星点设计-效应面法优化基于甘草酸的葛根素纳米乳及其体外释放研究 [J]. 中草药, 2020, 51(12): 3180-3186.
[28] Liao Y M, Zhong L, Liu L N,. Comparison of surfactants at solubilizing, forming and stabilizing nanoemulsion of hesperidin [J]., 2020, 281: 110000.
[29] 姚艳玉, 马培华, 曾庆晗, 等. 油相种类对姜黄素纳米乳液稳定性的影响 [J]. 食品科技, 2017, 42(9): 238-242.
[30] Saberi A H, Fang Y, McClements D J. Stabilization of vitamin E-enriched nanoemulsions: Influence of post-homogenization cosurfactant addition [J]., 2014, 62(7): 1625-1633.
[31] Sari T P, Mann B, Kumar R,. Preparation and characterization of nanoemulsion encapsulating curcumin [J]., 2015, 43: 540-546.
[32] Gadkari P V, Shashidhar M G and Balaraman M. Delivery of green tea catechins through oil-in-water (O/W) nanoemulsion and assessment of storage stability [J]., 2017, 199: 65-76.
[33] 陈雯烨, 王志高, 鞠兴荣, 等. 纳米乳的研究进展与潜在局限性 [J]. 粮食科技与经济, 2020, 45(3): 79-83.
Preparation andrelease of tea saponin-stabilized apigenin nanoemulsion
ZHANG Xu-min, XIE Long, ZHAO Yu-xin, LI Zhi-bei, LI Xiao-fang
Key Laboratory of Standardization of Chinese Herbal Medicine, Ministry of Education, Key Laboratory of Systematic Research, Development and Utilization of Chinese Medicine Resources in Sichuan Province, Key Laboratory Breeding Base of Co-founded by Sichuan Province and Ministry of Science and Technology, College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
To prepare apigenin nanoemulsion (AP-NE) with tea saponin as natural emulsifier, and investigate its stability and release characteristics, in order to obtain a new green nano-formulation.AP-NE was prepared by high-speed shearing combined with high-pressure homogenization technology. The average particle size and polydispersity index (PDI) were used as independent variables, and the data were processed by the overall desirability value (OD) method. The formulation was optimized and verified by Box-Behnken effect surface method, and the physicochemical properties andrelease characteristics of AP-NE prepared with the optimal formulation were investigated.The optimal prescription of AP-NE was as follows: apigenin at a concentration of 0.40%, tea saponin at a concentration of 2.0 mg/mL, oil phase (castor oil: caprylic capric triglyceride=1:3) in an amount of 3 mL; The measured average particle size of AP-NE was (259.5 ± 3.6) nm, PDI was 0.103 ± 0.005, ζ potential was (−35.81 ± 0.42) mV, conductivity was (88.60 ± 1.00) μS/cm, and pH was 7.37 ± 0.08, solubility was (128.12 ± 1.35) μg/mL, drug loading was (5.77 ± 0.08)%, turbidity was (99.45 ± 1.69) cm−1(= 3); it was identified as O/W emulsion by staining method, TEM observed that the milk droplets were non-adherent, uniform in size and spherical; stability test showed that AP-NE had good stability;release study showed that the release of apigenin from AP-NE had a slow and continuous trend.Nanoemulsion prepared with tea saponin as emulsifier can greatly improve the solubility and stability of apigenin, and it is a potential new nano-formulation that can improve drug effectiveness.
apigenin; nanoemulsion; tea saponin; high-speed shear-high pressure homogenization technology; Box-Behnken effect surface method; physicochemical properties; stability;release
R283.6
A
0253 - 2670(2022)17 - 5348 - 08
10.7501/j.issn.0253-2670.2022.17.011
2022-03-15
四川省科技厅科研项目(CN)(2020095);四川省科技厅科研项目(2019YFS0113)
张旭敏(1997—),女,硕士研究生,研究方向为中药新剂型、新制剂、新技术。Tel: 18328757648 E-mail: zhangxumin97@stu.cdutcm.edu.cn
李小芳(1964—),女,博士生导师,研究方向为中药新剂型、新制剂、新技术。Tel: 13808195110 E-mail: lixiaofang@cdutcm.edu.cn
[责任编辑 郑礼胜]

