外源性硫化氢对家兔内毒素休克诱发肺动脉高压的干预作用*
郭 赞,刘宜先,齐 杰,羡晓辉,黄新莉△
(1.河北医科大学生理教研室,2.病理生理教研室,石家庄 050017)
内毒素休克(endotoxic shock,ES)是常见的临床危重病症,血管反应性改变是其重要的病理生理特征,其中早期肺循环压力的升高,甚至发生肺动脉高压(pulmonary hypertension,PAH)是ES时急性肺损伤的早期表现,也是导致休克难以治疗的重要因素之一[1]。目前对ES诱发PAH发病机制的研究已深入到细胞、亚显微结构和分子水平,但其具体机制仍未充分阐明。因此,探讨如何防治ES时PAH的形成及其机制已成为该领域重要的研究课题。
继一氧化氮(nitric oxide,NO)、一氧化碳(carbon monoxide,CO)之后,硫化氢(hydrogen sulfide,H2S)作为第三种内源性气体信号分子引起了人们的关注。研究证实,H2S也具有舒张血管的作用[2]。以往本室在离体水平上的研究结果表明,H2S可能参与内毒素血症大鼠主动脉反应性改变的调节,并发现内源性H2S生成减少可能导致内毒素血症大鼠PAH的发生,但其具体机制尚未完全阐明[3]。其他学者的研究显示[4-6],内源性H2S在慢性阻塞性肺疾病患者PAH、缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)及休克大鼠的血管张力调节中均发挥重要作用。以往相关文献报道就H2S对肺动脉高压的影响及其机制多为探讨内源性的H2S的作用,有关外源性的H2S对肺动脉高压的影响及其机制多为离体实验,在整体水平,外源性H2S对ES时PAH有何影响及其机制尚不十分清楚。本研究旨在通过颈静脉注射大剂量细菌脂多糖(lipopolysaccharides,LPS)建立家兔ES模型,在整体水平上探讨预先给予外源性H2S供体是否能够缓解LPS诱发肺循环的紊乱,逆转PAH的发生。并通过观察上述过程中家兔肺动脉反应性,以及肺动脉壁结构的改变,以期为进一步阐述外源性H2S对LPS诱发ES家兔血流动力学紊乱的治疗作用提供实验依据。
1 材料与方法
1.1 药物与试剂
大肠杆菌LPS(E.coli,0111:B4)、硫氢化钠(sodium hydrosulfide,NaHS,H2S供体)、苯肾上腺素(phenylephrine,PE,α1肾上腺素受体激动剂)、乙酰胆碱(acetylcholine,ACh)及消炎痛(indomethacin,Indo)均购自美国Sigma公司。其它试剂均为国产分析纯。
1.2 复制ES家兔模型及分组设计
成年雄性新西兰大耳白家兔32只,体重(2.1±0.1)kg,购自河北省实验动物中心。经耳缘静脉缓慢注射25%乌拉坦(1 g/kg)实施全身麻醉后,立即将家兔仰卧位固定于实验操作台上。常规消毒后,行颈部正中切口,气管插管,钝性分离左侧颈总动脉后插入导管(PE-50,Intramedic,New York,NY,内充满肝素),连接多导生理信号记录仪MP150(美国Biopac公司)用以记录平均动脉压(mean arterial pressure,MAP);钝性分离右侧颈外静脉,经耳缘静脉注射肝素(1 250 U/kg,i.v.)抗凝后,经右心室插入导管至肺动脉入口处(根据显示屏上压力波形可判断肺动脉导管的位置),连接多导生理信号记录仪MP150用以监测平均肺动脉压(mean pulmonary arterial pressure,MPAP)。动物稳定15 min后,经颈静脉导管弹丸式注射药物并实时连续监测MAP和MPAP,直至给药后5 h。家兔按数字表法随机分为4组(n=8):(1)溶剂对照组:注入生理盐水(0.8 ml/kg,i.v.);(2)LPS组:缓慢(10 min)经颈静脉注射LPS(8 mg/0.8 ml/kg);(3)LPS+NaHS组:腹腔注射NaHS(28μmol/kg)后15 min再注入LPS;(4)NaHS组:腹腔注射NaHS(28μmol/kg)。每次静脉给药后再缓慢注入2 ml生理盐水冲管。各组于给药后5 h进行下列观察。
1.3 离体兔肺动脉环(PARs)的制备
上述各组实验动物放血处死后,参照文献[7,8]报道的方法制备PARs:快速联合取出心肺置于4℃并通有混合气(95%O2+5%CO2)的改良Krebs液中。仔细分离肺动脉,将血管周围组织去除干净,剪成3 mm宽的肺动脉环,注意避免损伤肺动脉内皮。
1.4 离体PARs的张力检测
参照文献[8]报道的方法,将血管环垂直悬挂于盛有6 ml Krebs液(含10μmol/L的Indo以消除环氧酶产物作用)的恒温浴槽中(37℃),并持续通入混合气(95%O2+5%CO2)。血管环一端固定于浴槽底部,另一端连接张力换能器(T-1型)。从0 g开始,每隔5 min使PARs张力增加0.5 g,直至最适张力2 g。PARs在2 g基础张力下平衡1 h,每隔15 min换1次液。然后用1×10-6mol/L PE和1×10-6mol/L ACh检测PARs的反应性及内皮细胞的完整性,确认其反应性稳定及内皮细胞完整后,每组选用8个PARs用于实验(1个环/家兔)。首先用1×10-6mol/L PE预收缩PARs,记录预收缩值PEAX,收缩达平台后观察PARs对1×10-6mol/L ACh的内皮依赖性舒张反应。实验结束后,将肺动脉环烘烤(温度为60~70℃)至恒重,称量每个肺动脉环的干重。收缩反应用克张力/毫克干重(g tension/mg dw)表示,舒张反应结果用占1×10-6mol/L PE收缩值的百分比表示。
1.5 肺动脉组织形态学观察
实验结束时,迅速留取家兔肺动脉,立刻置于事先已经准备好的4%多聚甲醛溶液中固定,石蜡包埋,制成5μm厚切片,常规HE染色,进行光镜观察。另取家兔肺动脉,采用2.5%戊二醛固定,常规制备扫描电镜标本,进行扫描电镜观察。
1.6 统计学处理
2 结果
2.1 NaHS对ES发生过程中PAH的影响
与对照组家兔MAP比较,LPS组家兔MAP呈持续性降低,0.5 h时显著低于对照组(P<0.01);1 h时为(80.10±2.93)mmHg,2 h时降到更低水平(61.80±3.60)mmHg,一直维持到5 h,均显著低于对照组(P均<0.01,表1)。在5 h的实验中,对照组家兔MPAP维持在(25.65±2.03~21.38±1.57)mmHg的范围内。与对照组相比,LPS组家兔MPAP迅速升高,0.5 h达高峰,显著高于同时间点对照组(P<0.01);1 h后MPAP((34.43±1.58)mmHg,P<0.01)和1.5 h后MPAP((30.90±1.80)mmHg,P<0.05)稍下降,但均显著高于对照组;2 h后MPAP仍高于对照组,但差异无统计学意义(P>0.05)。与对照组相比,LPS+NaHS组虽然在最初的1 h内MPAP仍表现为升高,但1 h后开始下降且在1.5 h时间点下降接近对照组。与LPS组相比,LPS+NaHS组家兔MPAP在各个时间点均显著降低(P均<0.05)。与对照组相比NaHS组家兔各时间点的MPAP无明显变化(表2)。
Tab.1 Effects of NaHSon changes in mean arterial pressure(MAP)induced by LPSin rabbits(mmHg,±s,n=8)
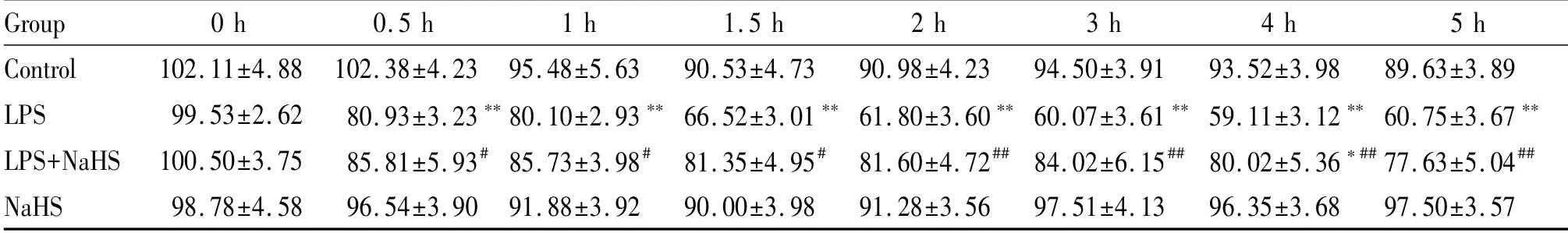
Tab.1 Effects of NaHSon changes in mean arterial pressure(MAP)induced by LPSin rabbits(mmHg,±s,n=8)
LPS:Lipopolysaccharides;NaHS:Sodium hydrosulfide **P<0.01 vs control group;#P<0.05,##P<0.01 vs LPSgroup
Group 0 h 0.5 h 1 h 1.5 h 2 h 3 h 4 h 5 h Control 102.11±4.88 102.38±4.23 95.48±5.63 90.53±4.73 90.98±4.23 94.50±3.91 93.52±3.98 89.63±3.89 LPS 99.53±2.62 80.93±3.23**80.10±2.93**66.52±3.01**61.80±3.60**60.07±3.61**59.11±3.12**60.75±3.67**LPS+NaHS 100.50±3.75 85.81±5.93#85.73±3.98#81.35±4.95#81.60±4.72##84.02±6.15##80.02±5.36*##77.63±5.04##NaHS 98.78±4.58 96.54±3.90 91.88±3.92 90.00±3.98 91.28±3.56 97.51±4.13 96.35±3.68 97.50±3.57
Tab.2 NaHSreverses pulmonary arterial hypertension induced by LPSin rabbits(mmHg,±s,n=8)
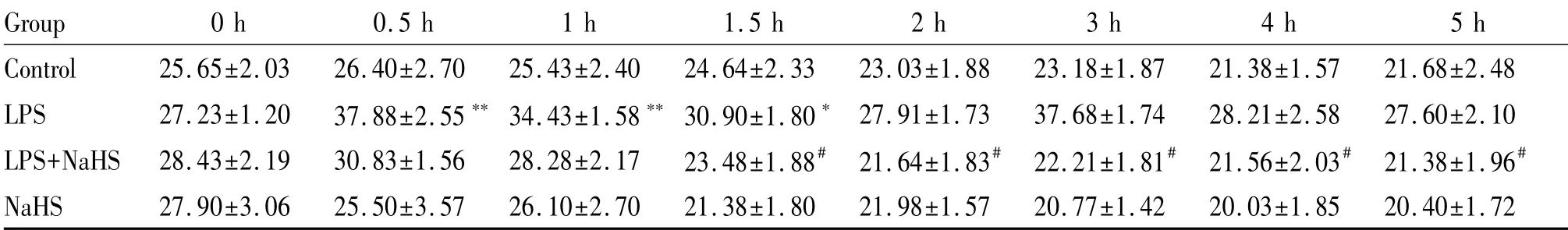
Tab.2 NaHSreverses pulmonary arterial hypertension induced by LPSin rabbits(mmHg,±s,n=8)
LPS:Lipopolysaccharides;NaHS:Sodium hydrosulfide *P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs LPSgroup
Group 0 h 0.5 h 1 h 1.5 h 2 h 3 h 4 h 5 h Control 25.65±2.03 26.40±2.70 25.43±2.40 24.64±2.33 23.03±1.88 23.18±1.87 21.38±1.57 21.68±2.48 LPS 27.23±1.20 37.88±2.55**34.43±1.58**30.90±1.80*27.91±1.73 37.68±1.74 28.21±2.58 27.60±2.10 LPS+NaHS 28.43±2.19 30.83±1.56 28.28±2.17 23.48±1.88#21.64±1.83#22.21±1.81#21.56±2.03#21.38±1.96#NaHS 27.90±3.06 25.50±3.57 26.10±2.70 21.38±1.80 21.98±1.57 20.77±1.42 20.03±1.85 20.40±1.72
2.2 NaHS对ES时PARs张力变化的影响
与对照组相比,LPS组家兔PARs对α1肾上腺素受体激动剂PE的收缩反应张力显著增高(P<0.01);与LPS组相比,LPS+NaHS组家兔PARs对PE的收缩反应显著降低(P<0.05),并接近对照组水平;与对照组相比,NaHS组家兔PARs对PE的收缩反应无显著差异(表3)。
与对照组家兔相比,LPS组家兔PARs对Ach的内皮依赖性舒张反应显著降低(P<0.01);与LPS组相比,LPS+NaHS组家兔PARs对ACh内皮依赖性舒张反应显著增高(P<0.05);与对照组相比,NaHS组家兔PARs对ACh内皮依赖性舒张反应无显著差异(表3)。
Tab.3 Comparison of contraction response to PE and endothelium-dependent relaxation response to ACh in rat pulmonary artery(±s,n=8)
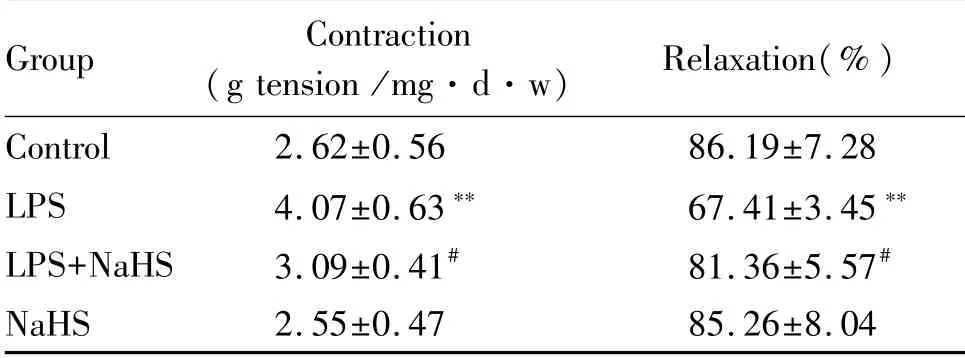
Tab.3 Comparison of contraction response to PE and endothelium-dependent relaxation response to ACh in rat pulmonary artery(±s,n=8)
LPS:Lipopolysaccharides;NaHS:Sodium hydrosulfide **P<0.01 vs control group;#P<0.05,##P<0.01 vs LPS group
Group Contraction(g tension/mg·d·w) Relaxation(%)Control 2.62±0.56 86.19±7.28 LPS 4.07±0.63** 67.41±3.45**LPS+NaHS 3.09±0.41# 81.36±5.57#NaHS 2.55±0.47 85.26±8.04
2.3 NaHS对ES时肺动脉组织形态学的影响
2.3.1 光镜观察 HE染色后在光镜下观察,正常对照组家兔肺动脉内皮细胞结构连续,内皮下弹力纤维完整,平滑肌层排列整齐;LPS组家兔部分肺动脉内皮细胞脱落,内皮下弹力纤维断裂,平滑肌层结构紊乱;与LPS组相比,LPS+NaHS组家兔肺动脉壁各层的损伤明显减轻;NaSH组家兔各层肺动脉壁结构未见显著变化(图1)。
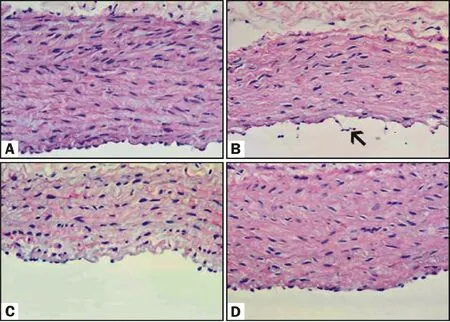
Fig.1 Microphotographs showing structural changes in pulmonary artery of rabbits(HE ×400)
2.3.2 扫描电镜观察 LPS组家兔肺动脉组织在扫描电镜下的病理改变表现为部分内皮细胞缺失;LPS+NaHS组肺动脉内皮细胞形态接近对照组,仅可见细胞间隙稍增宽,未见细胞脱落。NaSH组家兔肺动脉内皮细胞结构未见显著变化(图2)。
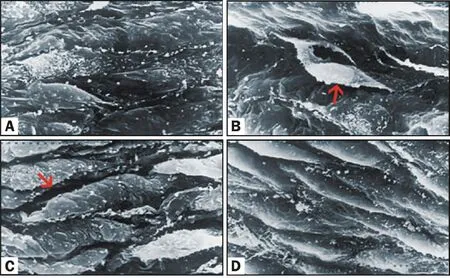
Fig.2 Microphotographs showing structural changes in pulmonary artery of rabbits(HE ×400)
3 讨论
ES是由于感染所导致的以机体血流动力学紊乱为特征的临床危重症,本实验结合文献,静脉注射大剂量LPS后,家兔出现MAP呈持续性降低,标志成功建立家兔ES模型。而ES家兔MPAP迅速升高,0.5 h达高峰,显著高于同时间点对照组;1 h和1.5 h后MPAP稍下降,但均显著高于对照组;2 h后MPAP仍高于对照组。在LPS诱导MAP显著降低的同时,MPAP出现早期增高而晚期下降的改变,MPAP显著增高可引发肺水肿乃至呼吸衰竭。合并与不合并MPAP升高的呼吸障碍患者相比,前者的死亡率明显高于后者[9,10],因此及时有效地纠正ES早期肺循环紊乱对于防治ES具有重要意义。
以往的研究[11-13]显示,H2S是继NO、CO之后的第三种内源性的气体信号分子,近些年越来越引人关注。由于其高脂溶性,故能够自由穿过生物膜,可有效舒张血管,调节心血管系统氧化应激或抑制内质网应激,以及具有抗炎作用等。内源性H2S的供体硫氨基酸主要通过酶促反应产生H2S,而NaHS是外源性H2S供体,因为NaHS的稳定性比较好,因此NaHS溶液常作为外源性H2S供体用于动物试验。虽然H2S被认为是第三种内源性气体信号分子已有近二十年的时间,近年来关于H2S通过调节氧化应激或抑制内质网应激调控PAH及其它疾病的研究越来越多[14,15],并已经证实其在调节血管张力和血管结构重建方面发挥着重要作用[16],但目前关于H2S在ES时PAH中的确切作用及机制仍尚不明确。
本实验发现,MPAP在大剂量LPS入血0.5 h后(早期)出现升高,且预先注射NaHS后,1 h内MPAP亦表现为升高。但随着病程的进展和连续监测时间的延长,MPAP呈现出下降的趋势。与对照组相比,NaHS组家兔各时间点的PAP无显著变化。以上结果提示,NaHS能够逆转大剂量LPS入血后诱发的肺循环紊乱,表现为有效逆转ES家兔MPAP的早期升高,但对正常家兔MPAP没有显著影响,这与本室以往有关内源性H2S可拮抗内毒素血症大鼠引起血管的反应性张力异常变化的研究结果是一致的[3]。与以往研究不同的是,本实验采用的动物是比大鼠体型大的家兔,且LPS的剂量较大(8 mg/kg vs5 mg/kg),动物MAP显著降低,处于ES状态,更接近临床实际。
进一步研究其机制发现,预先给予外源性H2S可改善肺动脉对缩血管剂的高反应性,逆转肺动脉血管内皮依赖性舒张反应性的降低,这与我们以往在复制的大鼠内毒素血症模型上观察到的结果相一致[3]。与以往研究中肺血管张力测定时先制备正常家兔的肺动脉环,然后再在体外加入不同药物的培养基中孵育不同的是,本实验中肺血管张力测定所用的肺动脉环是在整体用药情况下检测完家兔MAP和MPAP后进行取材的,属于在整体水平探讨LPS导致家兔PAH的机制;另外本实验在检测肺血管张力变化的同时,对肺动脉内皮细胞结构也进行形态学观察,结果在光镜和扫描电镜下均观察到肺动脉内皮细胞结构的损伤,且上述变化均可被NaHS所逆转。以上结果提示,ES时由于内皮细胞损伤导致的肺动脉收缩反应增强、内皮依赖性舒张反应降低可以引起PAH的发生,NaHS通过保护内皮细胞改善ES时肺动脉的反应性张力变化可能是其缓解PAH的重要机制之一。
本室以往在盲肠结扎穿孔(cecal ligation and perforation,CLP)法制备的大鼠肺损伤模型上发现,CLP大鼠肺组织中内源性H2S的含量明显增多导致肺损伤的发生[17]。也有其它在大鼠CLP导致的休克或ES大鼠模型上的研究发现,休克时大鼠肺动脉、主动脉等血管组织中内源性H2S的含量均较对照组明显升高[18-20]。因此H2S在ES时的确切作用及其对主动脉和肺动脉作用差异性产生的具体机制仍需进一步的实验研究。

