不同酿造过程中醪糟淀粉的结构与消化性能的变化
黄霭珺,周苏斌,吴洁仪,刘柯萱,叶盛英,司徒文贝
(华南农业大学食品学院,广州 510640)
醪糟是一种传统的淀粉发酵食品,因其味美可口而广受喜爱[1]。醪糟富含营养成分,可迅速补充能量,亦有健脾胃等功效[2]。作为一种淀粉类食品,前人曾对醪糟的消化性能进行研究,结果发现醪糟淀粉中的快速消化淀粉(RDS)含量和抗性淀粉(RS)含量减少,慢消化淀粉(SDS)含量增加[3]。而SDS的血糖生成指数(GI)低,对于餐后血糖以及胰岛素反应等都有良好的改善作用。当食物中SDS含量较高时,可减缓淀粉消化产生葡萄糖的速率,避免葡萄糖在食物食用后20min内快速释放,有效维持人体血糖稳定[4]。
慢消化淀粉的含量以及淀粉的消化性能与其直链淀粉含量、支链淀粉的链长分布等密切相关[5]。刘飞雁等人[6]研究了杂粮挂面中淀粉消化特性的影响因素,发现燕麦和高粱挂面中直链淀粉含量和淀粉结晶度较高,具有较多短程有序结构。且挂面经湿热处理后,淀粉分子链发生重排,淀粉分子链的有序性增强,同时高粱淀粉的分子质量小、短支链淀粉比例低,这在一定程度上抑制了酶对淀粉的水解作用。祖岩岩发现木薯淀粉链长在聚合度(DP)13~24之间时,有利于抗消化淀粉的形成[7]。从分子结构上看,支链淀粉(AP)形成淀粉的结晶区域,直链淀粉(AM)形成无定形区域,二者相互交替,最终形成结晶片层、bl℃klet小体以及环状结构等,而结晶结构和非晶相的堆叠会影响淀粉分子链对酶作用的敏感性[8]。Borah等[9]通过研究淀粉回生与淀粉消化性能的关系,发现回生后带有长链的支链淀粉主要形成SDS,证明了支链淀粉有利于SDS的形成。同时,在淀粉消化过程中,酶可通过A型淀粉表面的孔洞及通道进入淀粉颗粒内部,均匀接触淀粉的结晶区和无定形区域,若要调控淀粉的消化速度,可通过改变淀粉颗粒的孔隙和通道,利用颗粒内部结构的差异,影响淀粉酶的水解速度[10]。淀粉消化主要涉及α-淀粉酶和糖化酶,α-淀粉酶主要水解α-1,4糖苷键,糖化酶可水解α-1,6糖苷键和α-1,4糖苷键,但其α-1,6糖苷键的水解速度比α-1,4糖苷键慢。龚波等[11]发现分子量较大的支链淀粉可限制α-淀粉酶的水解,这与支链淀粉有较多的支叉结构有关。由于α-淀粉酶不能水解α-1,6糖苷键,当α-淀粉酶水解至支叉部位(α-1,6糖苷键附近),则会停止水解,从而降低淀粉的消化速率。
目前,对于醪糟这种传统食品,从淀粉消化角度探讨其营养价值的研究不多,而醪糟制备又涉及多个方面。因此,本实验通过控制醪糟的制备过程,探讨醪糟的消化性能,并通过多种现代仪器分析技术,对醪糟淀粉不同尺度的微观结构进行研究,分析醪糟酿造过程对醪糟淀粉微观结构、醪糟消化性能的影响以及二者之间的相互作用规律,为健康型的醪糟食品开发提供参考。
1 原料与方法
1.1 材料与试剂
KO-KO泰国糯米;太白浓缩甜酒药;Megazyme葡萄糖测定试剂盒,糖化酶(300 AGU/mL)、猪胰酶(250 U/mg);其余化学试剂均为分析纯。
1.2 仪器
UV6100S紫外分光光度仪,MA45红外水分测定仪,EVO 18扫描电子显微镜,X′PertProx X射线衍射仪,Diamond-I差示扫描量热计,DAWN HELEOS多角度激光光散射检测器,Optilab rex示差浓度检测器。
1.3 醪糟的发酵及淀粉提取
称量1 000.00、500.00、200.00 g糯米,分别浸泡于4 000、2 000、800 mL水中,浸泡过夜,沥干,100 ℃条件下蒸煮30min。糯米蒸熟后30 min内,冷却到30 ℃以下,拌入1g酒曲装入密封罐,落罐搭窝,25 ℃发酵15 d。待发酵完成后,将甜酒进行固液分离,醪糟在45 ℃下烘干,称重,粉碎,过60目筛,得醪糟粉,备用。采用1000、500、200 g糯米原料酿造所得的醪糟粉,分别记为WR-1000、WR-500和 WR-200。
取30.00 g醪糟粉,加入100 mL 4 g/L NaOH,在25 ℃下搅拌4 h,3 000 r/min离心20 min,弃去上清液。沉淀物用100 mL蒸馏水清洗,在3 000 r/min下离心20 min,重复2次。沉淀物用100 mL蒸馏水调成淀粉浆,用1 mol/L HCl调整pH至7,3 000 r/min离心20 min,弃去上清液,刮去沉淀物上层的黄色残渣。沉淀物用100 mL蒸馏水清洗,3 000 r/min离心20 min,弃去上清液,沉淀物在45 ℃下干燥48 h,过80目筛,得醪糟淀粉。醪糟粉WR-1000、WR-500和 WR-200所对应的醪糟淀粉,分别记为WR-F-1000、WR-F-500和 WR-F-200。
1.4 醪糟中总糖含量测定
精确称取1 g淀粉样品于50 mL离心管中,加入20 mL pH 5.2乙酸钠缓冲液和3颗直径为1.5 cm的玻璃珠,沸水浴加热30 min,冰水浴15~20 min。随后加入10 mL 7 mol/L KOH溶液,于25 ℃下振荡,摇匀。取1 mL样品溶液,与10 mL 0.5 mol/L 乙酸溶液混合,加入0.2 mL糖化酶,37 ℃下水浴振荡30 min,然后沸水浴10 min,冷却至室温后,定容至50 mL,2 000 r/min离心5 min。取上清液,用试剂盒测定其葡萄糖浓度[12]。
1.5 醪糟消化率测定
将2.8 mL糖化酶加入到8 mL蒸馏水中,待用。分别称量3.0 g胰酶到4个离心管中,移入20 mL蒸馏水,磁力搅拌10 min,在400 r/min下离心10 min,从每一个离心管中移取13.5 mL上清液。54 mL胰酶上清液与6 mL糖化酶溶液混合作为后续实验的酶溶液,溶液现配现用[12]。
为模拟醪糟食用前经高温加热过程,精确称取1.000 g淀粉样品于50 mL离心管中,加入20 mL pH 5.2乙酸钠缓冲液和3颗直径为1.5 cm的玻璃珠,沸水浴加热30 min,振荡,使样品充分糊化,然后冷却至37 ℃。同时,以20 mL醋酸钠缓冲液为空白对照。将高温加热后的淀粉样品置于37 ℃下水浴振荡10min,加入5 mL酶溶液,以酶溶液加入时开始计时,分别在0、20、120、180、240 min从离心管中取0.5 mL溶液于20 mL 66%乙醇溶液,混合均匀,以4 000 r/min速度离心2 min,取上清液,用试剂盒测定其葡萄糖浓度。最后,以样品液中葡萄糖含量占总糖含量的比例,计算样品的消化速率。
1.6 醪糟淀粉的结构与性能表征
1.6.1 表面形貌观察
将淀粉均匀地撒在粘有导电胶的载物台上,用吸耳球吹去多余的淀粉颗粒,在真空条件下喷金处理,最后将前面处理好的淀粉放入电子扫描显微镜(SEM)样品室中进行观察,并将具有代表性的颗粒形貌照片拍摄下来。
1.6.2 X-射线衍射分析(XRD)
淀粉样品水分平衡后,采用波长为0.154 2 nm的单色Cu-K射线,测试条件为:管压40 kV,管流40 mA,起始角4°,终止角40°,步长0.033°,扫描速度10(°)/min,连续扫描,并对其结晶结构进行分析。
同时,利用偏光显微镜,观察淀粉样品的偏光十字。先将淀粉样品置于载玻片上,滴加蒸馏水,调成适当的淀粉乳,盖上盖玻片,放到载物台上,选择合适的放大倍数以及调节光亮度,拍摄一张正常光状态下的照片,然后在偏振光下观察,拍摄样品的偏光十字照片,并进行比较。
1.6.3 小角X射线散射分析(SAXS)
将淀粉样品配成质量分数为65%的淀粉乳,在20 ℃下平衡24 h,待测。根据前人的方法[15],运用SAXSess小角X射线散射系统(Anton Paar,奥地利),在波长λ=0.154 2 nm、管压40 kV、管流50 mA的条件下测试样品,样品与影响板的间距为261.2 mm,曝光时间10 min。
1.6.4 衰减全反射红外光谱分析(ATR-FTIR)
将淀粉样品置于ATR附件上,调节压头使之晶体表面压紧样品。以空气为背景,扫描400~4 000 cm-1,分辨率为4 cm-1,扫描16次,所得谱图进行基线校正处理。利用红外光谱的指纹区(1 300~400 cm-1),分析淀粉分子链螺旋聚集状态,即短程有序结构,分别计算1 047 cm、1 022 cm-1处的强度,并计算强度比R(1 047/1 022),以此表征淀粉颗粒表面的短程有序结构。
1.6.5 淀粉的分子结构分析(SEC-MALS)
参考文献[14],淀粉样品溶于DMSO/LiBr溶液中,用尺寸排阻色谱进行分离,经示差检测器和多角度激光光散射器检测,流动相为DMSO/LiBr,流速0.6 mL/min,柱温80 ℃。
1.6.6 淀粉的热性能分析(DSC)
将淀粉样品配置成含水量为70%的淀粉乳,密闭,在20 ℃下平衡24 h。采用差示扫描量热计进行测定,称取淀粉样品约13 mg,置于高压盘中,压紧密封,待测。测试时升温程序为:从40 ℃加热到115 ℃,升温速率为5 ℃/min;测试时,载气为氮气,记录起始温度(To)、峰值温度(Tp)、结束温度(Tc)和焓值(ΔH),对同一样品重复测试,取平均值。
1.7 数据分析
实验平行重复3次(除XRD、SAXS外),采用Origin 2017软件进行绘图,采用SPSS 21.0软件分析实验数据,数据差异性采用单因素方差分析处理,P<0.05表示具有显著差异。
2 结果与讨论
2.1 不同酿造过程对醪糟得率及其含糖量的影响
原料大米种类、酒曲种类、发酵条件、原料大米的使用量等都是醪糟酿造与消化性能的主要影响因素。当发酵的糯米总量不同时,酒曲中微生物及其分泌的各种淀粉酶在醪糟酿造过程中对糯米淀粉的影响不同,从而得到的醪糟总量、总糖含量存在差异。从表1可以看出,在15 d发酵结束后,随着原料糯米使用量的增加,醪糟得率也逐渐上升。同时,总糖含量也与原料糯米使用量成正比关系。本实验所用的酒曲中含有根霉菌、啤酒酵母和毕赤酵母,可分泌α-淀粉酶和糖化酶,酶活力分别为41.64、507.42 IU/mL。其中,糖化酶既能作用于淀粉中的α-1,4糖苷键,又能缓慢作用于α-1,6糖苷键,能较快地从直链淀粉的非还原性末端依次切下葡萄糖单位,又能将支链淀粉缓慢水解成葡萄糖[15]。糖化酶与α-淀粉酶共同作用得到葡萄糖等,供酒曲中的酵母发酵,产生酒精及风味性成分[16]。
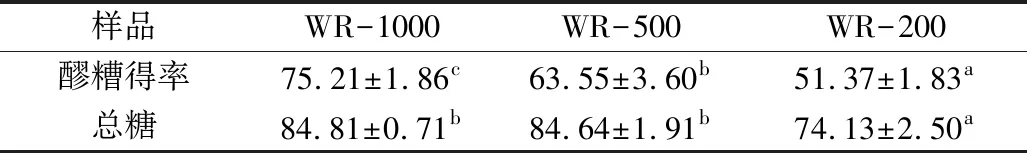
表1 不同酿造过程醪糟得率与总糖含量变化/%
2.2 不同酿造过程对醪糟的消化性影响
不同酿造过程所得的醪糟,其消化情况如图1所示。为模拟日常食用醪糟的过程,在测定醪糟消化情况时,先将醪糟进行沸水浴加热30 min,后冷却至37 ℃后,此时有部分游离的葡萄糖。在样品WR-200、WR-500和WR-1000,此部分葡萄糖占醪糟粉总糖的42.30%、9.96%和0.15%。后续加入酶溶液,模拟醪糟通过食用在人体消化道的消化过程,醪糟样品WR-200、WR-500和WR-1000分别有12.17%、27.90%和57.05%葡萄糖在消化的前20 min释放。在20~120 min内,醪糟样品WR-200、WR-500和WR-1000分别有3.93%、34.56%和10.03%葡萄糖释放。
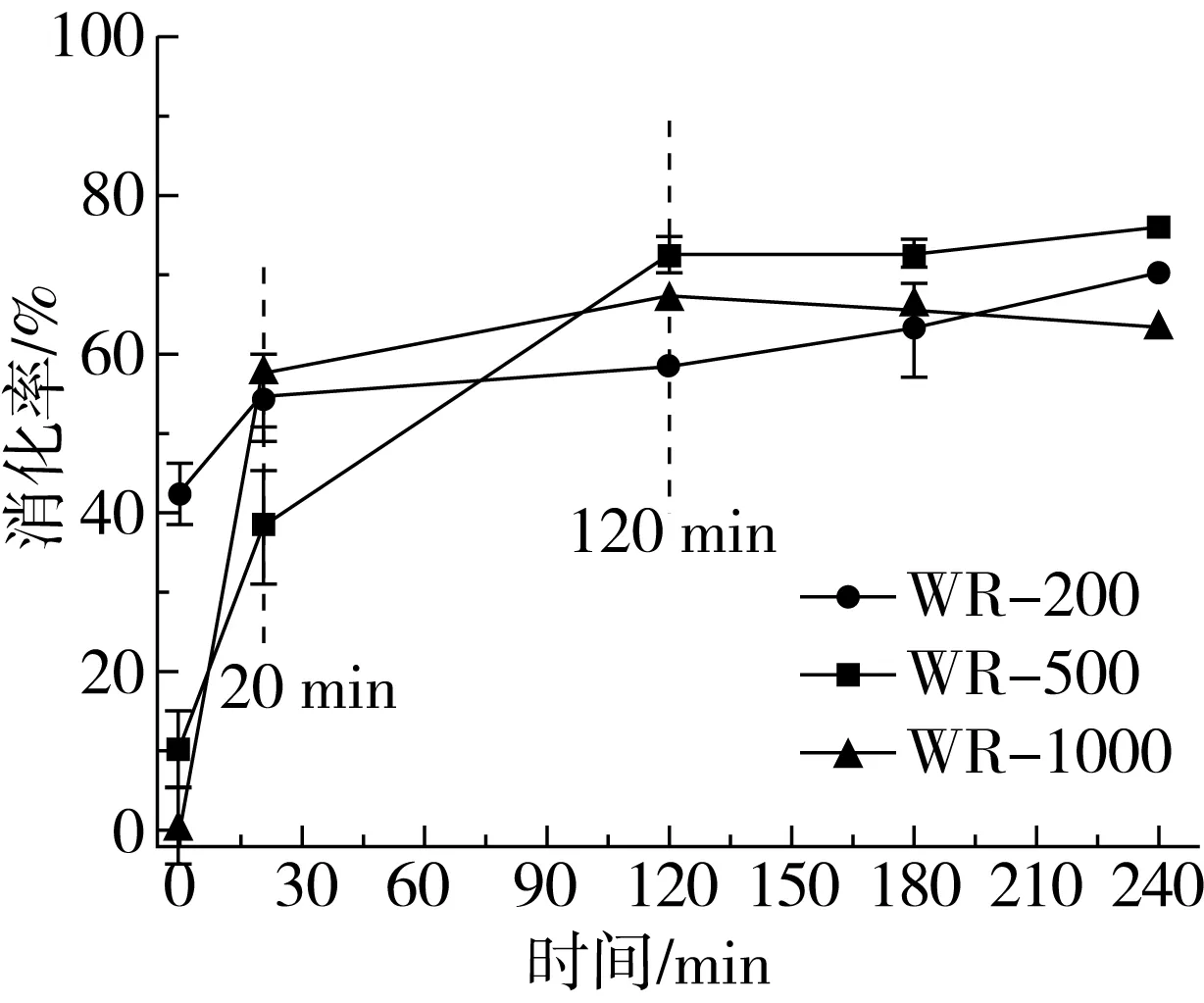
图1 不同酿造过程醪糟的消化情况
本实验醪糟消化过程中使用糖化酶、胰酶等,基本模拟人体胃肠道淀粉消化过程。其中在加热后未经消化已经游离的部分葡萄糖会在进入人体后立刻吸收,迅速提升血糖浓度,与20 min内消化的快速消化淀粉一致。而对于醪糟样品WR-200、WR-500和WR-1000,在醪糟高温加热、食用及消化运转的前20 min这一过程中,消化率分别为54.47%、37.86%、57.17%,酿造过程中糯米原料用量与醪糟在前期的葡萄糖释放速率并不是简单的线性关系。另外,在醪糟消化20~120 min间,醪糟样品WR-500消化率为34.56%,明显高于其他2个样品。由于醪糟中含有大量淀粉,根据淀粉在人体消化道中消化速率及程度的不同,此时醪糟样品WR-500所释放的葡萄糖多来源于慢消化淀粉。不同醪糟消化率之间的差异,与其中淀粉的微观结构密切相关,后续将对不同醪糟淀粉的结晶结构、层状结构以及链结构等进行分析,并探讨醪糟消化性能与其内部淀粉结构之间的相互关系。
2.3 不同酿造过程对醪糟淀粉表面形貌的影响
从醪糟淀粉的扫描电镜图(图2)可以看出,未经过酿造的醪糟淀粉,颗粒完整,表面无孔洞,而酿造后,淀粉颗粒破损,表面存在孔洞,这主要是酒曲中根霉菌、酵母发酵,产生淀粉酶酶解所致。且随着原料糯米用量增加,淀粉颗粒破损程度增大,表面的孔洞数量有所减少。醪糟淀粉颗粒表面形貌的变化,与α-淀粉酶和糖化酶的酶解有关。A型淀粉颗粒表面有孔洞,能够形成从颗粒表面到内部的通道[8],同时,酒曲所产生的淀粉酶可经破损处进入颗粒内部,随后通过颗粒内的通道进入淀粉颗粒的内部,继续进行降解。随着降解的发生,孔洞面积变大、数量增多,因此,在醪糟淀粉WR-F-200、WR-F-500和WR-F-1000的颗粒表面均能观察到孔洞的出现。

图2 不同酿造过程醪糟淀粉的SEM图(2 000×)
2.4 不同酿造过程对醪糟淀粉的结晶结构和热性能影响
2.4.1 偏光显微镜分析
通过偏光显微镜观察,糯米原淀粉颗粒规整,在偏光下,偏光十字清晰地分布在颗粒中心。经过酿造后,醪糟淀粉已失去原有的颗粒形态,同时在偏光下,偏光十字消失,说明在酿造过程中,淀粉已失去原有的结晶结构。
2.4.2 XRD分析
利用X射线衍射仪对淀粉结晶结构做进一步分析,如图3所示,糯米原淀粉在15.12°、17.17°、18.05°和23.01°处存在A型结晶结构衍射特征峰,经Jade软件对淀粉的结晶度进行计算,原淀粉的结晶度为42.1%。经酿造后,3种醪糟淀粉的结晶度均下降,这是由于高温蒸煮过程中,淀粉分子吸水,溶胀,结晶结构被破坏,但后续的糯米酒发酵工艺较为温和,淀粉逐渐回生,分子链重排,从而保持一定的结晶度。
淀粉颗粒由结晶区和无定形区组成,直链淀粉和部分支链淀粉形成无定形区,结晶区域则主要由支链淀粉的侧链以双螺旋的方式形成[17]。在酿造过程中,醪糟淀粉由于淀粉回生而保持一定的结晶度。同时,无序的无定形区域先被糖化酶水解,醪糟淀粉WR-F-200在无定形区被水解后,其淀粉中的结晶区也被糖化酶、α-淀粉酶作用,淀粉的结晶度下降。酒糟淀粉XRD分析结果表明在不同的酿造过程中淀粉颗粒结晶结构发生变化,这与偏光显微镜观察结果一致。受不同酿造过程的影响,不同醪糟淀粉的结晶结构存在差异,醪糟淀粉WR-F-500和WR-F-1000的结晶度高于WR-F-200,这也将影响淀粉的热性能。

注:a~d分别是糯米原淀粉、WR-F-200、WR-F-500和WR-F-1000,下同。图3 不同酿造过程醪糟淀粉的X射线衍射图
2.4.3 DSC分析
图4是在发酵过程中几种醪糟淀粉的热流曲线图,从中可以看出糯米淀粉在74.81 ℃处有一个相变峰,由于糯米淀粉中几乎不含直链淀粉,因此,此处是由支链淀粉分子所形成的结晶结构在加热时熔融吸热所致。在不同的酿造过程中,醪糟淀粉的吸热峰向高温方向移动,酒曲的根霉菌所产生的糖化酶能较快地从直链淀粉的非还原性末端依次切下葡萄糖单位,又能够将支链淀粉缓慢水解成葡萄糖。因此,在醪糟酿造过程中,淀粉中既有直链淀粉又有支链淀粉。经酒曲微生物作用得到的直链淀粉使得相变峰向高温方向移动。其中,醪糟淀粉WR-F-200由于糯米原料量的限制,微生物酶解产生的直链淀粉有限,同时,直链淀粉逐渐被降解成葡萄糖,根霉菌、酵母等利用葡萄糖生成酒精等副产物,减少直链淀粉比例。当糯米原料用量增大,经微生物作用,可供酶解作用的位点增加,醪糟淀粉中直链淀粉含量增大,使得相变峰向高温方向逐渐移动[18]。
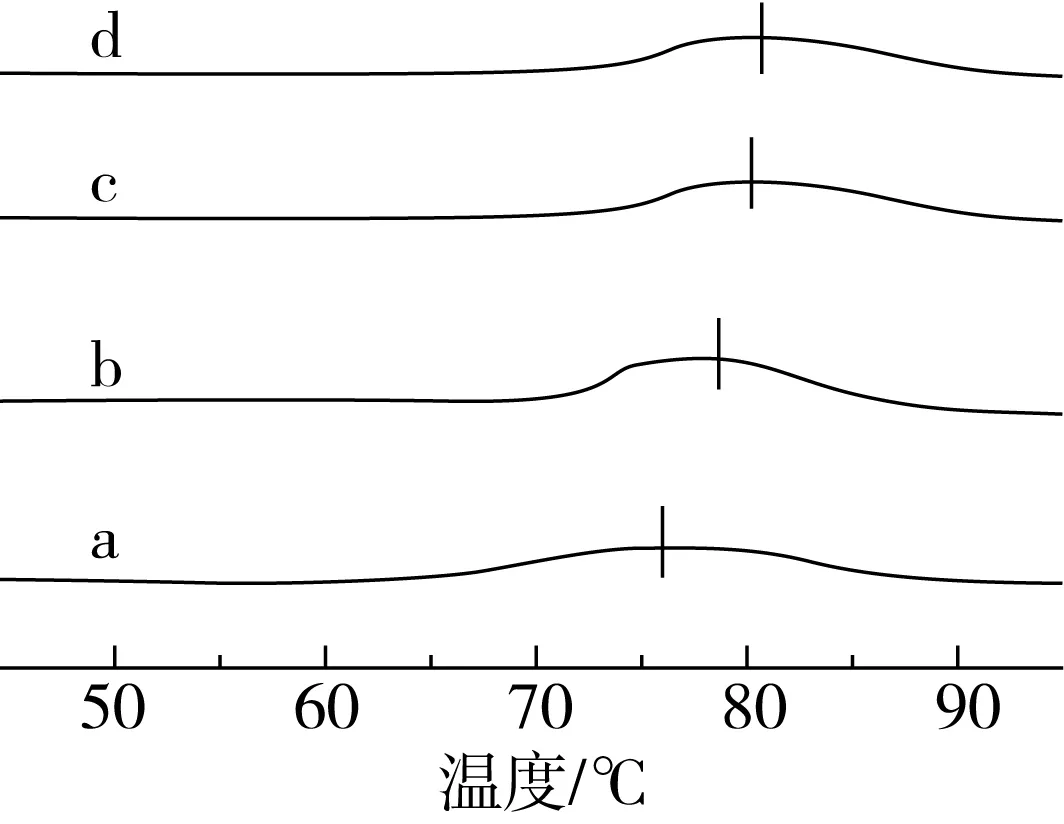
图4 不同酿造过程醪糟淀粉的DSC图
表2是在不同酿造过程中醪糟淀粉的热流参数。与糯米淀粉相比,在不同酿造过程中醪糟淀粉的焓值有所下降,并随糯米原料用量呈先增大后减小的趋势。这与醪糟淀粉结晶结构改变有关,同时糯米原料用量不同,醪糟淀粉的结晶度逐渐上升,淀粉颗粒需要更多的能量去进行相转变,从而焓值升高。
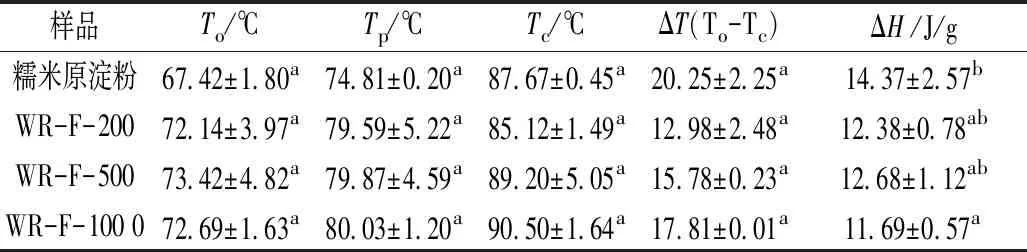
表2 在不同酿造过程中醪糟淀粉的热流参数
2.5 不同酿造过程对醪糟淀粉层状结构的影响
图5是在不同酿造过程中醪糟淀粉的小角X-射线散射双对数图。糯米原淀粉在散射矢量q=0.673 6 nm-1处出现散射峰,对应淀粉颗粒内部厚度d=9.328 nm的周期性层状结构。醪糟淀粉在散射矢量0.620 8~0.667 nm-1范围出现散射峰,对应的淀粉颗粒内部厚度9.42~10.12 nm之间有周期性层状结构,醪糟淀粉的q和d发生变化,与酿造过程糯米原料用量有关。与原淀粉相比,醪糟淀粉的周期性层状结构厚度增大,说明在醪糟酿造过程中,淀粉回生,生成新的层状结构,与原淀粉的周期性层状结构位置相近。
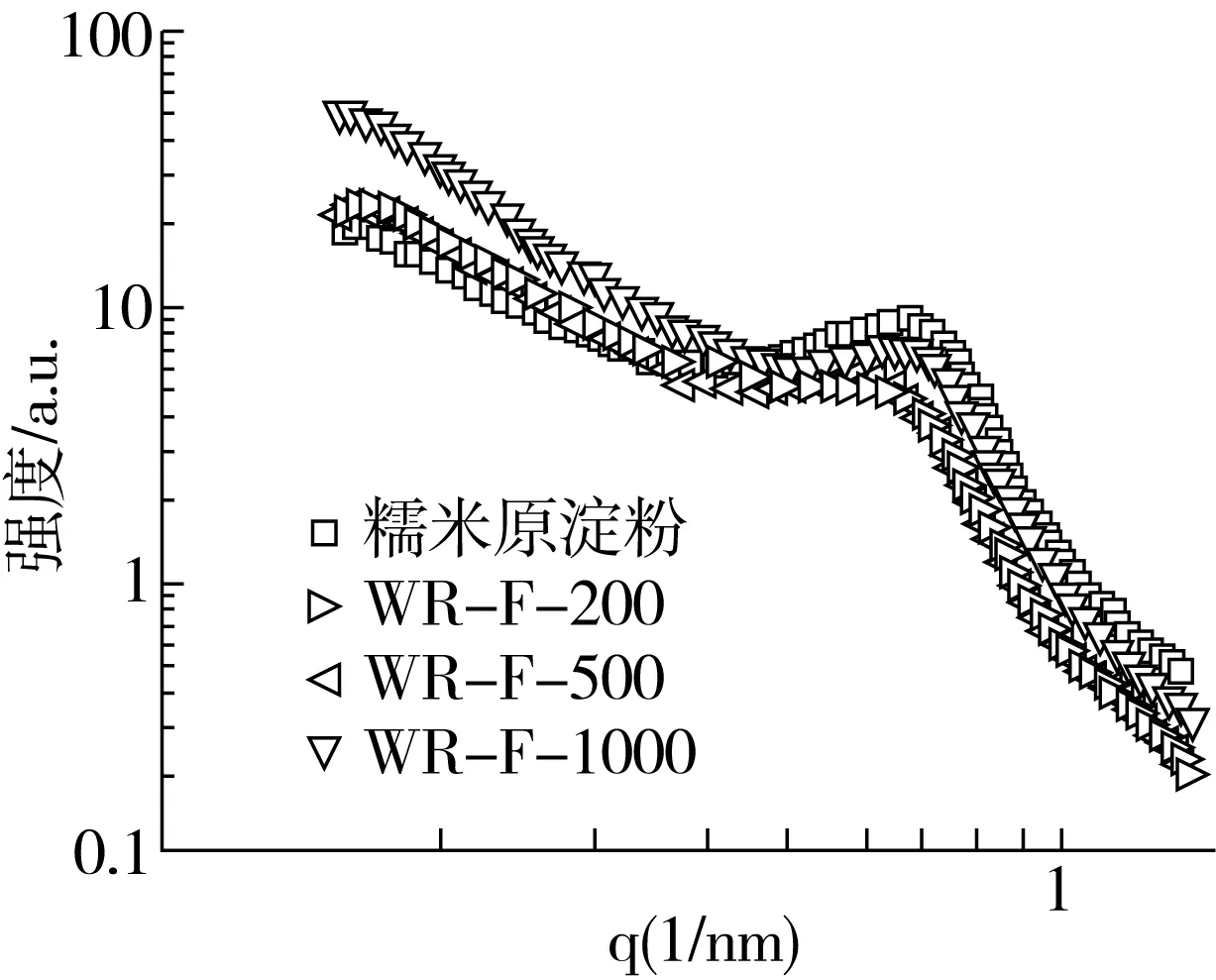
图5 不同酿造过程醪糟淀粉的小角X-射线散射双对数图
根据幂定律(I~q-α,其中,I为小角X射线散射强度,α为介于-4~-1的值),探讨不同酿造过程中醪糟淀粉的分形变化,当-4<α<-3时,散射体为表面分形,其分形维数Ds=6+α;当-3<α<-1时,散射体为质量分形,其分形维数为Dm=-α[19]。从表2中可以看出,糯米原淀粉为质量分形,在不同醪糟酿造过程中,醪糟淀粉仍为质量分形,但对比原淀粉发现,酿造后醪糟淀粉的Dm上升,淀粉颗粒内部变得致密。而随着糯米原料用量的上升,酒曲中微生物可更多作用于醪糟淀粉内部结构,醪糟淀粉颗粒内部致密程度逐渐上升。
2.6 不同酿造过程对醪糟淀粉分子结构的影响
2.6.1 ATR-FTIR分析
图6为醪糟淀粉样品的ATR-FTIR图谱,其中原淀粉的R值为0.72,而酿造后,醪糟淀粉的R值有所下降,表明在酿造过程中淀粉颗粒表面的短程有序结构遭到破坏[20]。且当糯米原料使用量少的时候,酒糟淀粉颗粒的破损程度较大,R值较小,这与酿造过程中可供酒曲微生物作用的淀粉结构数量少、淀粉酶急剧降解淀粉分子链有关。
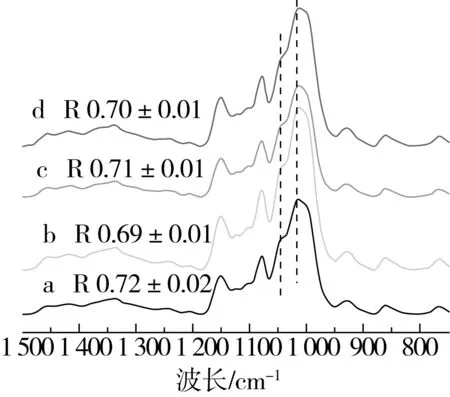
图6 不同酿造过程醪糟淀粉的ATR-FTIR图谱
2.6.2 分子质量与分子半径分析
与糯玉米淀粉相似,糯米淀粉中几乎不含直链淀粉,支叉结构较多,其重均分子质量达到2.120×107g/mol,但由于在浸泡、蒸煮过程中,糯米淀粉糊化,分子结构被破坏,在后续酿造过程中,酒曲所产的糖化酶作用于淀粉的α-1,4糖苷键和α-1,6糖苷键,依次切下葡萄糖单元,将淀粉逐渐水解成葡萄糖,使得部分醪糟淀粉分子质量下降。当糯米原料用量增大至1 000 g时,醪糟淀粉的分子质量和半径与原淀粉接近。这是由于淀粉水解产生的葡萄糖可经酵母发酵产生酒精,酒精的积累会限制糖化酶的活性,而α-淀粉酶又无法水解α-1,6糖苷键,最终留有部分未被酶解的淀粉结构。虽然糯米原料用量增加,可供糖化酶、α-淀粉酶作用的位点增加,但酒曲分泌的淀粉酶活性被限制,此时醪糟淀粉降解程度不明显,分子结构改变不大。
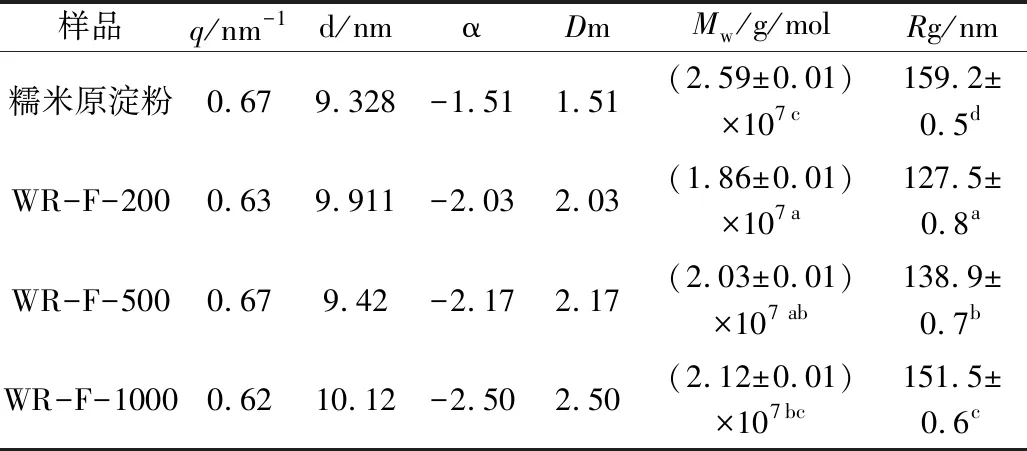
表3 在不同酿造过程中醪糟淀粉分子结构参数
2.7 不同酿造过程中醪糟淀粉分子结构与其消化性能间的相互作用规律
醪糟的酿造过程主要由酒曲中的霉菌和酵母菌将蒸熟的糯米糖化发酵而得,其中糖化酶的作用最为重要,淀粉在糖化酶等的作用下,生成可发酵性糖,这也与醪糟的风味品质相关。酒曲中霉菌活力越强,糖化酶的活力越强,醪糟在酿造过程中风味损失的可能越小。但糖化酶也受酒曲霉菌生长周期的影响,一般在酿造56 h后,霉菌开始衰亡,糖化酶活力也逐渐下降。此外,酒曲中微生物还能分泌α-淀粉酶等。但在酒曲微生物分泌的淀粉酶中,糖化酶既可作用于α-1,4糖苷键,又能作用于α-1,6糖苷键,因此在酿造过程中,可酶解糯米淀粉,产生更多的直链淀粉,形成酶解的作用位点,这对醪糟的糖化酿造及风味形成十分必要。
相比于糯米原淀粉,在醪糟酿造过程中,醪糟淀粉中既存在直链淀粉,又存在支链淀粉。当糯米原料用量较少,如采用200 g时,大量糯米淀粉被降解,使得此时的醪糟得率较低,淀粉的分子链段被糖化酶、α-淀粉酶等大量降解,因此其分子质量、分子半径均明显下降。而升高糯米原料用量时,醪糟中可供酒曲作用的淀粉结构位点增加,其中通过糖化酶可脱支获得支链淀粉,同时糖化酶也可与α-淀粉酶配合,水解α-1,4糖苷键,被急剧降解的淀粉分子链段数量减少。因此,醪糟得率增加,淀粉分子质量及分子半径也有所上升。这都与分子质量、分子半径测定结果吻合。
在酿造过程中,糯米经过高温蒸煮,淀粉颗粒表面有一定破损,酒曲中产生的淀粉酶可先作用于颗粒破损处,随后通过通道,进入淀粉内部区域。进入淀粉颗粒内部的淀粉酶,先对无定形区域进行酶解,酶解得到的葡萄糖可发酵生成酒精等物质。当糯米原料用量较少时,无定形区域数量较少,随着酒精、水分等对结晶区域的渗透以及淀粉酶的水解,淀粉结晶区域逐渐被降解。因此,醪糟淀粉WR-F-200的结晶度最低,其颗粒破损最为严重,且在ATR-FTIR分析中R值最小,淀粉分子链的短程有序性最差。当升高糯米原料用量时,松散的无定形区域被淀粉酶水解,而此时产生的大量酒精又反过来抑制淀粉酶的活性,从而留下规整的结晶区域,所以在小角X-射线散射分析中,样品WR-F-500和WR-F-1000的紧密程度有所提升。
此外,当糯米原料用量较少时,淀粉结构被大量酶解,在其内部形成短链糖类物质。当醪糟被高温加热时,短链糖类物质游离、受热降解,最终形成葡萄糖。由于醪糟淀粉在酿造过程中,其结构被大量破坏,因此在后续消化过程中,生成、释放的葡萄糖较少。但在前期生成的这部分葡萄糖,会被人体直接吸收利用,因此对人体血糖的平衡并不有利。当升高糯米原料用量至500 g时,糯米与酒曲的比例适中,酒曲微生物分泌的淀粉酶均匀地作用于淀粉分子结构中的α-1,4糖苷键和α-1,6糖苷键。随着酿造的进行,醪糟淀粉分子质量与分子链段长度缓慢下降。最终,醪糟淀粉中存在着带有一定支叉结构的淀粉链段。这类结构的淀粉分子在后续的高温加热和消化过程中,可抵御酶、水分等的降解,从而避免葡萄糖大量释放,降低醪糟的消化速度,对人体的健康有利[21]。若再继续升高淀粉原料用量至1 000 g,受酒精对糖化酶、α-淀粉酶活力的影响,部分α-1,6糖苷键被酶解后产生的淀粉链段,未得到进一步的降解。在后续高温加热和消化过程中,此部分淀粉可被消化道中的淀粉酶直接降解,生成葡萄糖,进而引起人体血糖升高。从葡萄糖释放及人体血糖平稳等角度出发,醪糟淀粉WR-F-1000中含有约57.17%快速消化淀粉,人体食用后较难维持餐后的血糖平衡。
3 结论
通过控制糯米原料用量,得到不同的醪糟,当糯米用量与酒曲比例为500∶1时,所得醪糟淀粉的消化速率适中。酿造后醪糟淀粉的表面出现破损,酒曲分泌的淀粉酶可通过孔洞及破损处进入颗粒内部,然后沿着A型淀粉中的通道分布并进行酶解。随着淀粉分子链的降解,淀粉的无定形区被水解,结晶度有所提升,颗粒内部紧密程度增大。醪糟消化性能的差异与其淀粉分子链的有序性改变有关,醪糟淀粉在酿造中形成带有一定支叉结构的淀粉链段,同时其结晶结构和非晶相的堆叠方式发生改变,从而影响消化过程中淀粉酶的酶解作用,减缓了醪糟的消化速率。

