基于氧化应激损伤和炎症反应探讨中风康复膏对脑缺血再灌注损伤模型大鼠的保护作用
汪湛东 毛忠南 张 娜 吴 琳 刘娅楠 陶成斌 张延英 宋 冰 徐晓艳* 王 钢*
1.甘肃中医药大学,甘肃 兰州 730000; 2.甘肃中医药大学附属医院,甘肃 兰州 730020
缺血性脑血管疾病是一种常见病,因其较高的发病率、致残率和死亡率给患者及患者家庭和社会均造成了严重的影响,且发病年龄出现年轻化的趋势[1]。脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)是指脑部出现一段时间的缺血后恢复血供,脑部功能不仅未见好转,反而出现严重障碍的一种现象,也是该病发生、发展的关键组成部分[2]。
中风康复膏(paste of stroke recovery, PSR)是甘肃中医药大学附属医院康复医学科毛忠南主任医师的治疗验方,在十几年的临床诊疗中对于证属肝肾亏虚、气虚血瘀、痰浊阻滞脑窍所致的脑卒中(出血性、缺血性) 恢复期进行干预,效果较为显著[3-4]。研究通过建立大鼠大脑中动脉缺血再灌注(middle cerebral artery occlusion,MCAO)模型,从抗炎、抗氧化应激两个角度研究中风康复膏对脑缺血再灌注损伤的保护作用。
1 材料与方法
1.1 动物 健康雄性SD大鼠50只,SPF级,体质量220~280 g,由甘肃中医药大学实验动物中心提供,生产许可证号:SCXK(甘)2015-0002,使用许可证号:SYXK(甘)2015-0005。
1.2 药物与试剂 中风康复膏药物组成:黄精 25 g,黄芪40 g,当归60 g,制何首乌30 g,熟地黄20 g,生地黄20 g,豨莶草(酒制)15 g,鸡血藤20 g,枸杞子30 g,党参20 g,白术20 g,吴茱萸25 g,陈皮20 g,佛手20 g。所有药材加10倍量水浸泡12 h,应用多功能提取罐提取,按高压法煎煮2次,1煎150 min,2煎120 min,合并滤液加辅料浓缩,浓缩至每毫升药液中含生药7 g(即药液质量浓度为7 g/mL),经高温灭菌,在室温下冷却,放入冰箱中 4 ℃ 冷藏备用。
实验中使用丙二醛(MDA)检测试剂盒(批号A003-1-1)、一氧化氮合酶(NOS)检测试剂盒(批号A014-2)、肿瘤坏死因子-α(TNF-α)检测试剂盒(批号H052-1)、白细胞介素1β(IL-1β)检测试剂盒(批号H002),均购自南京建成生物工程研究所;细胞间黏附分子(ICAM-1)检测试剂盒(批号JCL1238)、血管细胞黏附分子(VCAM-1)检测试剂盒(批号JCL1243),均购自上海晶抗生物工程有限公司;TTC染色液(批号G3003)购自北京索莱宝生物科技公司,MCAO栓线(型号2363-A5,250~280 g),购自北京西浓科技有限公司。
1.3 仪器 3K15型低温高速离心机(上海安亭科学仪器厂);SCIENTZ-48高通量组织研磨器(宁波新芝生物科技有限公司);721/721-100型可见分光光度计(上海光学仪器厂)。
1.4 方法
1.4.1 造模 采用改良的Zea-longa等[2]的线栓法制备SD大鼠大脑中动脉缺血-再灌注模型。栓线采用MCAO鱼线,长4.5 cm,直径0.24 mm,一头顶端为半球形,距头端18~20 mm处有一黑色标记。大鼠术前12 h禁食,4 h禁水,以7%水合氯醛(7 mL/kg体重)腹腔注射麻醉后,将大鼠头部及四肢固定于手术台上,颈部备皮,按外科常规手术用碘伏进行消毒,铺无菌巾,取颈部正中纵向切口,切口长约2 cm,钝性分离皮下组织,使用撑开器充分暴露术区视野,解剖、游离右侧颈总动脉(CCA),颈内动脉(ICA)及颈外动脉(ECA),避免刺激迷走神经。充分暴露右侧ECA约3~5 mm后,用动脉夹夹闭CCA近心端和ICA远心端,在ECA下放置两根3-0手术丝线,于距离CCA分叉≥3 mm处双结扎,用眼科手术剪在两个线结中间偏远心端离断ECA,并在ECA残端剪一“V”形切口,将MCAO栓线由ECA缓慢插入ICA,打开ICA远心端动脉夹,缓慢将鱼线推送入ICA至大脑中动脉,根据鱼线上的黑色标记,推送约18~20 mm,感到有阻力时停止向前推进鱼线,将鱼线与ECA残端一起结扎;逐层缝合并将长约 0.5 cm 鱼线远端旷置、固定。将实验鼠置于单笼饲养,90 min后外拉鱼线使其球端回至ECA,进行缺血后再灌注。凡出现动物术中死亡、蛛网膜下腔出血或无梗死灶均为MCAO模型制作失败,并以相同操作方式随机补充同批次备用大鼠。对假手术组手术时仅作颈部手术切口,手术分离暴露右侧的颈总(CCA)、颈外(ECA)、颈内动脉(ICA),仅离断颈外动脉及其分支,不做插管。
1.4.2 分组与给药 将50只体质量220~280 g大鼠饲养于18~22 ℃,明暗各12 h的SPF级动物实验室内,自由进食饮水喂养1周,采用随机数字表法将其随机分为假手术组、模型组、中风康复膏高剂量组(PSR-H组)、中风康复膏中剂量组(PSR-M组)、中风康复膏低剂量组(PSR-L组),共5组。对各组大鼠于术前 (1次/12 h,3 d)及术后(1次/6 h,3 d)灌胃给药,中风康复膏高、中、低各剂量组按成人与大鼠体表面积比分别给予药液(质量浓度为 7 g/mL):8.75 mL/kg、17.5 mL/kg、35 mL/kg灌胃;对假手术组和模型组给予 4 mL 生理盐水灌胃。
1.4.3 神经功能评分 采用Zea-Longa’s标准评分[5]判断各组大鼠的神经功能情况。0分为活动正常,无任何神经功能缺损症状;1分为提尾时见左侧前爪不能充分伸展;2分为提尾时见左侧前爪不能充分伸展,向左侧转圈;3分为大鼠行走时向左侧旋转或倾斜;4分为不能自发行走,意识丧失。
1.4.4 脑含水量 测定将各组大鼠麻醉后断头、取全脑, 去除小脑和低位脑干后称重大脑组织,即为脑湿重,110 ℃恒温烘烤48 h后称重即为脑干重;根据公式计算脑含水量:脑含水量(%)=(脑湿重-脑干重)/脑湿重×100%。
1.4.5 TTC染色 将全脑置于0.9%氯化钠溶液中洗涤,并在-20 ℃环境下速冻30 min固定脑组织,从大鼠脑组织冠状面将大脑切成7片,每片厚约 1 mm,将切片放入1%的TTC染色液中,37 ℃避光染色,每15 min轻震荡数次后取出,用4%多聚甲醛固定并拍照,正常区域为红色,缺血梗死区域为白色。将照片导入Image J软件计算脑梗死体积占比,体积=厚度×面积。计算公式为:脑梗死体积占比=(梗死区域体积/整个脑的体积)×100%。
1.4.6 脑组织炎症因子及氧化应激指标检测 断头处死各组大鼠,快速取脑,分离缺血侧脑组织,放于低温生理盐水中冰浴,然后用刀片定量切取该侧部分脑组织,滤纸吸干血迹,立即冻存于超低温冰箱(-80 ℃)中。于检测前制备10%脑组织匀浆并称重,用眼科手术剪将其剪碎,按照1∶9的比例尽快加入预冷生理盐水,放入高通量组织研磨器研磨1 min,制成脑组织匀浆,放入高速冷冻离心机,4 ℃,3500 r/min离心15 min,取上清液,测定大鼠缺血侧脑组织中肿瘤坏死因子-α(TNF-α)、白细胞介素1β(IL-1β)、细胞间黏附分子(ICAM-1)、血管细胞黏附分子(VCAM-1)、脂质过氧化物丙二醛(MDA)、一氧化氮合酶(NOS)指标,具体操作严格按照试剂盒说明进行。
2 结果
2.1 脑组织含水量及神经功能评分比较 采用称重法检测大鼠脑含水量变化,并采用Zea-Longa’s标准评分对各组大鼠进行神经功能评分,与假手术组相比,模型组的脑含水量及神经功能评分均显著升高(P<0.01)。与模型组相比,PSR-H组和PSR-M组大鼠的神经功能评分及脑含水量显著降低(P<0.01)。详见表1。
表1 各组大鼠脑组织含水量及神经功能评分比较
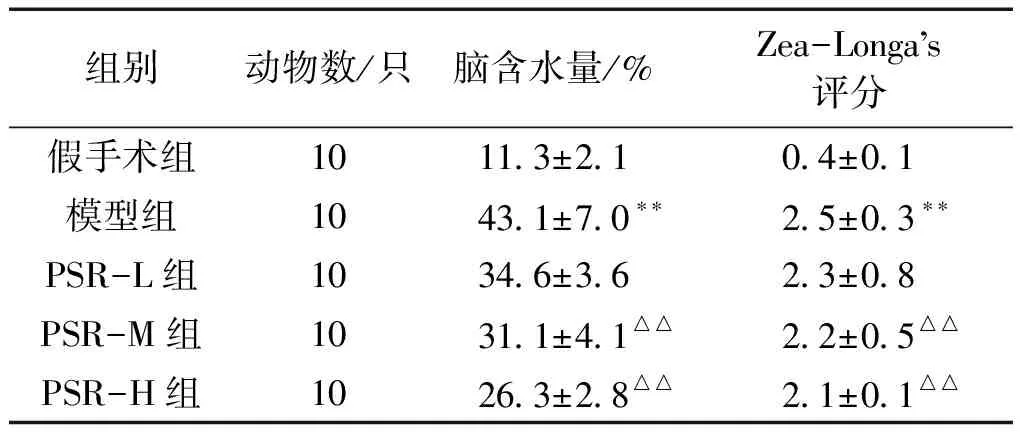
表1 各组大鼠脑组织含水量及神经功能评分比较
组别动物数/只脑含水量/%Zea-Longas评分假手术组1011.3±2.10.4±0.1模型组1043.1±7.0∗∗2.5±0.3∗∗PSR-L组1034.6±3.62.3±0.8PSR-M组1031.1±4.1△△2.2±0.5△△PSR-H组1026.3±2.8△△2.1±0.1△△
注:与假手术组比较,**P<0.01,与模型组比较,△△P<0.01。
2.2 脑缺血再灌注TTC染色结果 采用 TCC 染色法检测各组大鼠脑梗死情况,与假手术组相比,模型组大鼠脑组织切片存在明显白色梗死区,梗死体积百分比显著升高(P<0.01) 。而PSR给药干预后,相对于模型组大鼠,脑组织梗死体积百分比均有所降低,其中PSR-H组大鼠脑组织梗死体积百分比减少最为显著(P<0.01)。详见表2。各组大鼠脑组织TTC染色切片如图1所示。
表2 各组大鼠脑梗死体积比较

表2 各组大鼠脑梗死体积比较
组别脑梗死体积百分比/%假手术组0.0±0.0模型组22.1±2.6∗∗PSR-L组20.3±3.2PSR-M组14.1±1.9△△PSR-H组10.5±2.3△△

图1 各组大鼠脑组织TTC染色切片图
2.3 脑组织炎症因子表达情况 与假手术组相比,模型组大鼠脑组织中炎症因子TNF-α、IL-1β、ICAM-1及VCAM-1的含量均显著升高(P<0.01)。而PSR给药干预后,相对于模型组大鼠,其炎症因子表达量均有所下降,其中PSR-H组大鼠脑组织的炎症因子表达量下降最为显著(P<0.01)。详见表3。
表3 各组大鼠脑组织炎症因子表达情况

表3 各组大鼠脑组织炎症因子表达情况
分组TNF-α/nmoL·L-1lL-1β/nmoL·L-1ICAM-1/pg·mL-1VCAM-1/pg·mL-1假手术组27.2±8.9418.5±37.7129.1±12.423.4±4.0模型组71.8±12.1∗∗878.7±125.2∗∗315.6±39.8∗∗57.8±12.4∗∗PSR-L组60.2±9.8747.0±71.4238.3±31.345.6±6.8PSR-M组52.9±8.7△△596.3±94.9△△235.5±13.2△△37.3±4.1△△PSR-H组47.7±11.6△△501.9±95.3△△179.4±13.5△△30.1±3.6△△
注:与假手术组比较,**P<0.01;与模型组比较,△△P<0.01。
2.4 脑组织氧化应激指标表达情况 与假手术组比较,模型组大鼠脑组织中氧化应激指标MDA含量和NOS活力明显升高(P<0.01)。与模型组比较,PSR给药组MDA含量和NOS活力均有所下降,其中PSR-H组、PSR-M组大鼠脑组织中MDA含量和NOS活力下降较为明显(P<0.01) 。详见表4。
表4 各组大鼠脑组织氧化应激指标的表达情况

表4 各组大鼠脑组织氧化应激指标的表达情况
组别MDA/μmol/g protNOS/U/mg prot假手术组2.6±0.60.5±0.1模型组6.8±1.7∗∗0.9±0.2∗∗PSR-L组4.4±3.50.6±0.1PSR-M组4.4±1.9△△0.5±0.4△△PSR-H组3.8±1.6△△0.5±0.1△△
注:与假手术组比较,**P<0.01;与模型组比较,△△P<0.01。
3 讨论
临床研究认为,由于脑缺血再灌注损伤导致的中风患者多是在气血内虚的根本上,加之劳倦内伤、忧思恼怒、吸烟喝酒等诱因,引起气血瘀滞,脑脉痹阻[6]。本病的关键机制是气滞、血瘀、络阻,“气行则血行”,常以行气、活血、通络的方法进行诊疗[7]。甘肃中医药大学附属医院毛忠南主任医师在治疗中风疾病上积累了丰富的经验,PSR在康复医学科已应用多年,对于中风恢复期、出血性脑中风恢复期、缺血性脑中风恢复期,临床观察疗效明显[3-4]。
中风康复膏中黄精补中益气、滋肾益肺,制何首乌、枸杞子补益肝肾、益气养血,生地黄、熟地黄补血生津、益精补肾,豨莶草强健筋骨,黄芪、党参、鸡血藤、岷当归补益气血、活血通络,吴茱萸、佛手、陈皮调理气机、化痰祛湿,白术补气健脾。诸药配伍,共奏补益肝肾、益气养血、活血化痰之功,可使气血通畅,精气充足,从而脑髓得充,痰瘀自消,灵窍得养。研究[8]表明,中风康复膏可增强脑组织对缺血、缺氧的耐受性,能明显减轻ICS患者认知功能的损害程度,改善患者的日常生活能力,提高患者的生活质量,降低患者病死率和致残率。
神经功能评分常被用作药物研究中的一项重要指标,已成为评价药效的重要依据[9]。本研究采用Zea-Longa’s标准评分评价PSR对脑缺血再灌注大鼠神经功能的改善效果。结果显示,PSR干预后大鼠神经功能评分显著降低,表明PSR能够改善脑缺血再灌注大鼠的神经功能损伤。脑水肿是CIRI的主要并发症之一,能够引起颅内压增高,加重机械性压迫,损害脑微循环和细胞能量代谢,从而加重脑损害[10]。通过检测脑含水量能够有效反映脑缺血再灌注的损伤程度。脑梗死的病灶范围是对脑缺血再灌注损伤中脑组织损伤程度最直观的反映,TTC染色后脑梗死体现为明显白色区域。研究结果表明,模型组大鼠较假手术组脑含水量明显升高,梗死范围缩小,不同浓度的PSR干预下,大鼠的脑含水量和脑梗死面积得到不同程度的降低,明显改善了脑组织缺血再灌注损伤的恢复水平,对脑组织损伤的大鼠具有保护作用。
研究[11-13]表明,炎症反应是与脑缺血再灌注损伤密切相关的病理途径,发挥着关键作用,脑缺血再灌注损伤发生时,通过释放TNF-α、IL-1β、ICAM-1及VCAM-1等炎症因子增大血脑屏障通透性,导致脑组织的水肿更加严重,进而导致炎症因子更容易透过血脑屏障,最终加重炎症反应[14]。TNF-α、IL-1β是重要的炎症因子,在脑缺血中发挥着重要的作用[15]。同时VCAM-1和ICAM-1在炎症和肿瘤等病理过程中扮演着重要的角色[16]。研究显示,模型组大鼠TNF-α、IL-1β、ICAM-1、VCAM-1表达量明显升高,表明模型组大鼠由于CIRI产生明显炎症反应;PSR干预后,大鼠炎症因子表达量显著下调,说明PSR可以有效的抑制CIRI炎症反应。
临床上发现,缺血性脑卒中病人恢复血流供应后,脑损伤反而加重,即缺血再灌注损伤,氧化应激过程是其不可忽视重要环节,降低氧化应激损伤,可能对脑缺血再灌注损伤的减轻以及下游病理生理反应起到关键作用[17],氧化应激发生后产生大量活性氧发生过氧化反应,其终产物为MDA,同时MDA可影响线粒体呼吸链复合物和线粒体内关键酶活性,因此MDA可反映机体脂质过氧化程度和细胞氧化损伤程度[18]。在脑缺血再灌注进程中NO可以和超氧阴离子反应形成强氧化剂,使蛋白质硝基化并损伤DNA,而NOS可催化NO生成,因此许多研究中采用NOS活力反映NO含量[19-20]。本研究结果显示,与模型组比较,PSR给药组MDA含量和NOS活力均有所下降,其中尤其以PSR中、高剂量组大鼠脑组织中MDA含量和NOS活力下降较为明显。
综上所述,研究结果证实,中风康复膏能够改善MCAO模型大鼠的脑缺血再灌注损伤,相关机制可能与抑制炎症因子释放、减少氧化应激损伤有关。本研究只是初步探讨了中风康复膏对MCAO模型大鼠的保护作用,其具体分子作用机制仍需要进一步研究。

