缺氧环境下miR-7851-3p可能通过抑制Wnt8b表达调控子宫内膜腺上皮细胞增殖
王含必,窦帅杰,刘思邈,张婉玉,刘美芝,邓成艳*
(1.中国医学科学院 北京协和医学院 北京协和医院妇科内分泌与生殖中心,疑难重症及罕见病国家重点实验室,国家妇产疾病临床医学研究中心,北京 100730;2.北京致成生物医学科技有限公司,北京 100176)
大量研究证明,子宫内膜厚度和形态是影响妊娠结局的独立因素[1-2]。子宫内膜分为功能层和基底层,当基底层受到损伤后,将使子宫内膜上皮及间质组织中的细胞及腺体数量减少,子宫内膜的血流阻力增加、血流量减少,使子宫内膜处于缺氧微环境,损伤子宫内膜的生理功能,这将导致子宫内膜腺上皮细胞(endometrial glandular epithelial cells,EEC)发育受损[3],出现上皮细胞再生障碍,对激素刺激无反应,而导致薄型子宫内膜。
微小核糖核酸(microRNAs,miRNAs)是包含20~25个核苷酸的小型非编码调控 RNA[4]。miRNA几乎在生物学的所有方面都发挥作用,如增殖、凋亡、侵袭、转移和血管生成。miRNA通过识别mRNA的3′非翻译区(UTR)中的互补靶位点,在转录后抑制基因表达[5]。在胚胎种植过程中,会产生超过500种miRNAs[6],这些miRNAs的表达受环境因素(如缺氧、信号通路、表观遗传修饰和植入的不同阶段)的影响而调节子宫内膜功能[7]。
有研究发现,在异位子宫内膜中miR-488表达降低,其靶基因卷曲类受体7(frizzled class receptor 7,FZD7)表达升高,促进Wnt信号通路激活,从而增加子宫内膜的增殖、迁移和侵润[8],而阻断Wnt信号转导将减少细胞增殖,增加细胞凋亡[9]。Wnt(Wingless/Integrated,Wnt)信号通路在成体细胞发育过程中的增殖、分化以及干细胞更新和维持的发育过程中起着关键作用[10],它直接影响细胞增殖、分化、凋亡和组织稳态等多种关键的生物过程[11]。Wnt信号通路可分为β-连环蛋白依赖性(典型)信号通路及β-连环蛋白非依赖性(非典型)信号通路,而Wnt 家族成员8b(Wnt8b)是典型的Wnt配体之一。在体外和体内Wnt8b敲低都可以抑制经典Wnt信号传导,从而抑制细胞的增殖[12]。
本研究将观察缺氧环境下EEC miRNAs的表达,并探究其差异性表达是否通过影响Wnt信号传导调控子宫内膜的增殖机制,为薄型子宫内膜的发生及治疗提供理论依据。
资料与方法
一、细胞来源
子宫内膜腺上皮原代细胞(CM-H058)购于武汉普诺赛生物。
二、试剂和主要仪器
DMEM培养基(Gibco,美国);多聚甲醛(国药试剂);小牛血清(Gibco,美国);TRizol(Sigma,美国);6孔细胞培养板(Corning,美国);兔抗Wnt8b抗体、鼠抗β-Tubulin(Cell Signaling,美国);5×M-MLV Buffer、M-MLV(200 U/μl)、RNase Inhibitor(40 U/μl)(TaKaRa,日本);q-PCR Μltra Master Mix、dNTP(康为世纪)。
培养箱、低温离心机、PCR仪、酶标仪(Thermo Fisher,美国);显微镜(Nikon,日本)。
三、研究方法
1.子宫内膜腺上皮细胞(EEC)的培养:EEC使用普诺赛(Procell)配套的专用生长培养基及细胞培养操作方法。采用胰酶消化法进行传代培养,待EEC密度增长至80%~90%,使用胰酶消化、计数接种至六孔板,每组5×106/孔,分别在常氧(21%氧浓度)和缺氧(1%氧浓度)条件下培养,培养至细胞融合度至80%左右时,分别用胰酶消化,收集两组细胞进行后续研究。
2.高通量测序分析miRNAs的变化:Trizol法提取两种氧浓度培养条件下EEC的总RNA。miRNA测序由苏州贝康医疗股份有限公司完成。
3.实时荧光定量 PCR(qPCR)法检测miRNA的表达:Trizol法提取两种氧浓度培养条件下EEC的总RNA。采用2 μg定量逆转录生成cDNA,反应体系A为miRNA-RT、Sno-202 RT、dNTP各1 μl,反应条件70℃、10 min一次;反应体系B为5×M-MLV Buffer 4 μl、M-MLV(200 U/μl)、RNase Inhibitor(40 U/μl)各1 μl、DTT(0.1 mmol/L)2 μl,反应条件42℃ 60 min、70℃ 15 min。qPCR检测基因表达量,反应体系为miRNA-Forward、URP-Reverse引物(10 μmol/L)各1 μl,RT-PCR Master Mix 10 μl和无RNA酶水8 μl;snoRNA202为内参基因;采用2-△△Ct表示待测基因mRNA表达水平。qPCR所用引物(表1)由上海生工有限公司合成。

表1 引物序列
4.采用细胞计数(cell counting kit-8,CCK8)检测子宫内膜腺上皮细胞增殖:分别收集在常氧条件下EEC和缺氧条件(1%氧浓度)的EEC,混匀成单细胞悬液,计数,调整细胞密度为2×104/100 μl,接种至96孔板,100 μl/孔。37℃培养箱中培养。分别在12 h、24 h、48 h,每孔加入10 μl CCK8,培养1~4 h上机检测,酶标仪设置吸光度450 nm,每组6重复。
5.免疫印迹法(Western blot)检测Wnt8b蛋白的表达:分别收集常氧条件下EEC和缺氧条件(1%氧浓度)的EEC,加入100 μl细胞裂解液4℃环境下裂解细胞25 min,低温离心机离心25 min,采用BCA蛋白浓度测定试剂进行蛋白定量,加入5×loading buffer煮沸后离心,取30 μg 蛋白上样到10%SDS-PAGE凝胶中进行电泳后转移到PVDF膜上;用封闭液进行封闭,室温30 min;4℃过夜孵育一抗(兔抗Wnt8b及鼠抗β-Tubulin,稀释度1∶1 000);用TBST洗膜3次,每次10 min;加入二抗(山羊抗兔及山羊抗鼠抗体,稀释度1∶1 000),室温孵育 1 h;再用 TBST洗膜3次,ECL化学发光显影。
四、统计学方法

结 果
一、缺氧环境下EEC的miRNAs表达差异
在常氧和缺氧条件(1%氧浓度)下分别培养EEC,通过高通量测序分析探究缺氧条件下EEC的miRNAs表达变化。分析测序结果显示,缺氧条件下EEC的miR-7851-3p、miR-125a-3p、miR-215-5p、miR-516a-5p、miR-3605-3p、miR-141-5p等miRNAs表达升高(图1),提示缺氧损伤导致了子宫内膜腺上皮细胞miRNAs表达谱的改变。
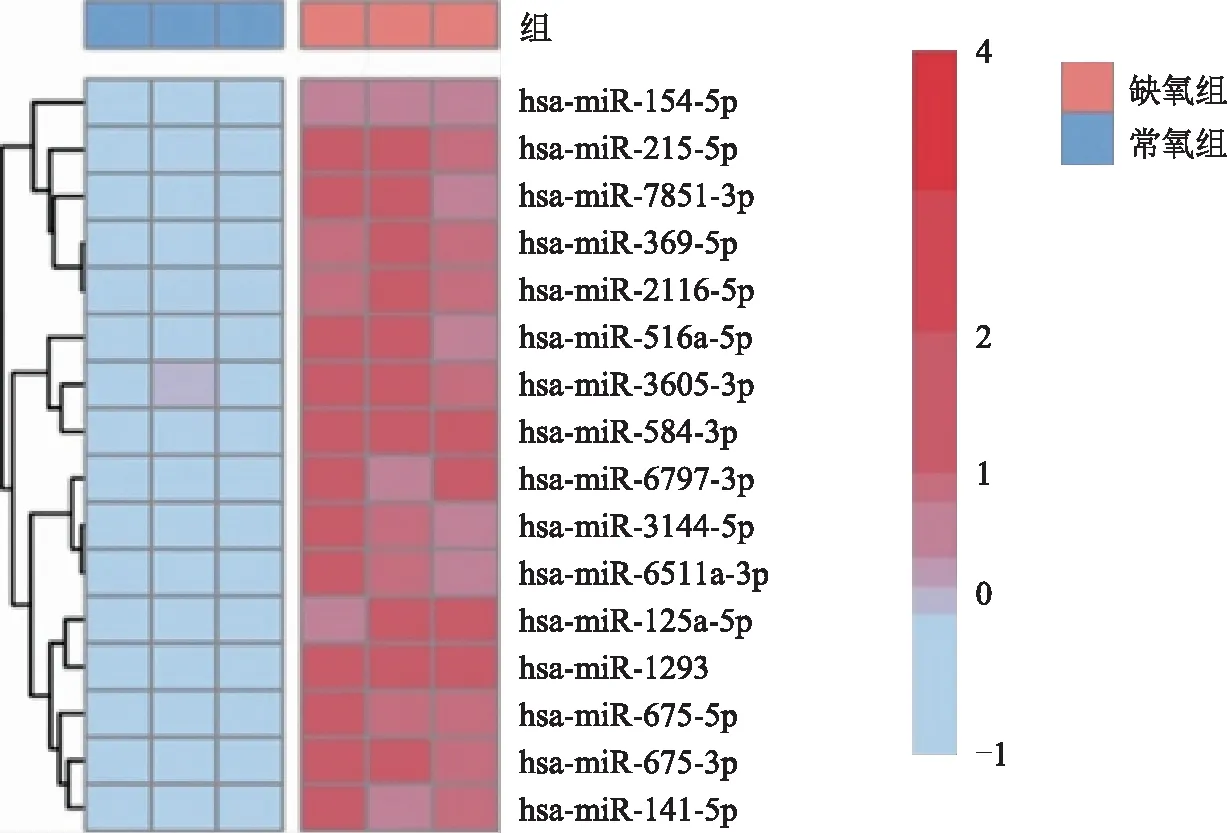
图1 子宫内膜腺上皮细胞在常氧和缺氧(1%氧浓度)条件下miRNAs差异表达热图
二、缺氧引起子宫内膜腺上皮细胞的miR-7851-3p表达上调
高通量测序发现缺氧引起EEC多种miRNAs表达上调,为进一步证实上述差异miRNAs表达,利用qPCR检测差异miRNAs的表达。结果显示,与常氧组相比,miR-7851-3p、miR-141-5p、miR-125a-3p在缺氧的EEC中表达升高(P<0.05~0.001),其中miR-7851-3p表达丰度更高(P<0.001)(图2),提示miR-7851-3p显著升高可能在缺氧损伤中起主导地位。
三、缺氧条件子宫内膜腺上皮细胞增殖能力被抑制
缺氧可以引起细胞生长停滞,因此我们采用CCK8分别检测常氧条件和缺氧条件(1%氧浓度)的EEC增殖情况,发现在两种环境下EEC都可以增殖,但在缺氧环境下,EEC的增殖较常氧环境下增殖缓慢(P<0.05),尤其在培养36 h时差异极为显著(P<0.001)(图3),说明缺氧抑制了EEC的增殖。
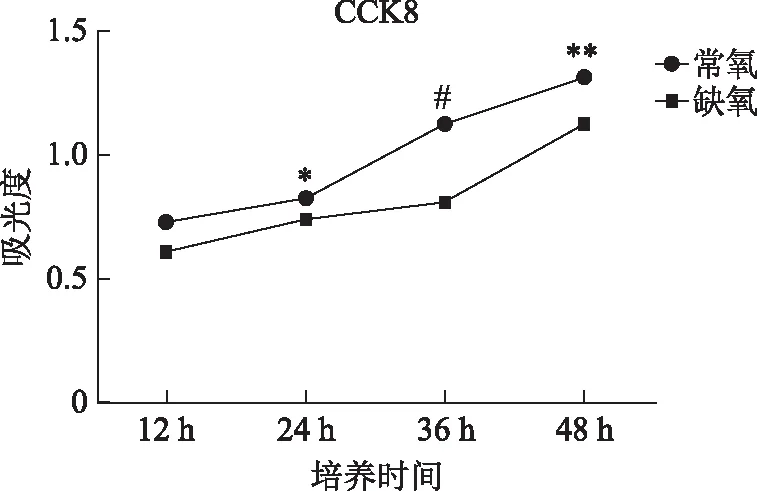
与同时间点常氧组比较,*P<0.05,**P<0.01,#P<0.001。
四、缺氧环境诱导miR-7851-3p的靶基因Wnt8b表达降低
通过对TargetScan数据库分析发现miR-7851-3p的靶基因为Wnt8b,同时我们通过碱基互补配对原则发现miR-7851-3p可与Wnt8b的3’UTR连续7个碱基相匹配(图4 A)。于是采用Western blot分别检测常氧条件下和缺氧环境(1%氧浓度)下的两组EEC的Wnt8b蛋白变化情况。结果显示,在缺氧条件中,EEC上调miR-7851-3p表达的同时,Wnt8b蛋白的表达降低(图4 B)。综合以上结果,我们认为缺氧诱发EEC的miR-7851-3p表达上调,可能通过下调靶基因Wnt8b表达,抑制EEC的增殖活动。
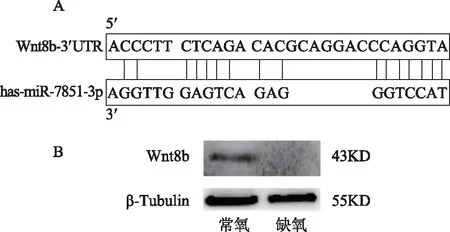
A:生物信息学预测结果显示Wnt8b是miR-7851-3p的潜在靶基因;B:Western blot检测Wnt8b的表达。
讨 论
恒定的氧气供应对于正常的组织功能、发育和体内平衡至关重要。通过提供足以满足组织代谢输出产生需求的氧浓度来控制组织中的氧稳态是必不可少的。但在缺氧微环境下,细胞的代谢将会重编程,激活不同的分子信号通路以适应缺氧环境[13-14],包括血管生成、葡萄糖代谢和细胞增殖等过程[15]。经阴道彩色脉冲多普勒超声检查发现“薄”子宫内膜的特点是子宫桡动脉的血流阻抗高,血供减少致使子宫内膜细胞生长不良、血管内皮生长因子表达降低和血管发育不良[16],子宫内膜血流阻力增加,内膜血供减少使得EEC及血管内皮细胞处于缺氧微环境,导致子宫内膜血管生长不良,EEC增殖受损,反之进一步影响子宫内膜的血流,这一恶性循环过程最终的结果是子宫内膜生长受到限制,腺上皮生长受损[17]。
缺氧是肿瘤微环境的基本特征,研究发现在缺氧环境下培养人类癌细胞系(MDA-MB231、MCF7、HT29和HCT116),27 种miRNA在24 h至少上调1.5倍,由此证明缺氧微环境下可导致miRNAs表达谱的改变[16]。为此我们用缺氧损伤模型模拟体内的薄型子宫内膜的内部环境,通过RNA测序及RT-PCR检测发现缺氧环境下的EEC中miR-7851-3p表达丰度高,而且与常氧环境下的EEC间表达存在显著差异(P<0.001)。同时采用Western blot检测,结果显示Wnt8b蛋白表达显著减低,提示缺氧环境下miR-7851-3p上调,从而下调靶基因Wnt8b的表达的可能。
Wnt8b是经典Wnt配体之一,Wnt信号通路首先在黑腹果蝇的发育过程中发现,是一种复杂的蛋白质作用网络,调节各种细胞过程的信号转导通路[18],Wnt信号通路可分为β-连环蛋白依赖性(典型)信号通路,其中β-连环蛋白易位至细胞核并上调癌基因,以及β-连环蛋白非依赖性(非典型)信号通路。经典和非经典途径都需要 Wnt 配体与相应的膜受体卷曲蛋白(Frizzled)结合以激活信号级联[8]。Wnt8基因是Wnt基因超家族的成员,包括Wnt8a、Wnt8b和Wnt8c。Wnt8b 蛋白的一级结构由350个氨基酸残基组成,研究发现锌指转录因子191(zinc finger transcription factor 191,ZNF191)可以直接与Wnt8b启动子结合,激活Wnt8b基因,随后激活Wnt通路促进细胞增殖[19]。通常miRNA通过碱基互补原则与靶基因的mRNA的3′非翻译区(UTR)结合,阻断mRNA的翻译或降解 mRNA,从而实现对蛋白的调控。而本研究发现EEC在缺氧环境下细胞增殖能力明显被抑制,同时缺氧使得EEC高表达miR-7851-3p,可能靶向抑制调控细胞增殖的靶基因Wnt8b表达,这可能是缺氧引起薄型子宫内膜的重要诱因之一。
总之,我们推测缺氧微环境上调EEC的miR-7851-3p表达,可能通过抑制Wnt8b蛋白的表达,阻断Wnt信号通路传导,抑制EEC增殖,这可能是薄型子宫内膜潜在的发病机制之一。

