症状性颅内动脉粥样硬化性狭窄血管内治疗中国专家共识2022
中国卒中学会神经介入分会
颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS),又称颅内动脉粥样硬化性疾病(i ntracran ial atherosclerotic disease,ICAD),是缺血性卒中的常见原因,其发病具有明显的种族差异,好发于亚裔、黑人及西班牙裔人群,且其所致的全球卒中负担日益增加[1]。伴有ICAS的卒中患者症状更重、住院时间更长,且随血管狭窄程度的增加,卒中复发率升高[2]。鉴于既往对比强化药物与强化药物联合血管内治疗(endovascular therapy,EVT)随机对照试验(randomized controlled trial,RCT)的阴性结果,各国指南及共识仅推荐可考虑EVT作为药物治疗失败后的补充措施[3-6]。近年来,随着更为严格的患者筛选、更优化及多样的介入器械选择,对ICAS的治疗有了新的认识。本共识更新《症状性颅内动脉粥样硬化性狭窄血管内治疗中国专家共识2018》部分内容,对ICAS的血管内治疗方法、材料学进展的重要临床研究进行回顾,根据推荐、评估、发展和评价等级(grades of recommendation,assessment,development,and evaluation,GRADE)工作组循证医学证据[7-8],结合最新研究结果、专家意见给予推荐,旨在为临床提供ICAS患者精准治疗和卒中二级预防的指导。
本共识的证据级别和推荐等级基于GRADE,结合最新的美国心脏学会(American Heart Association,AHA)/美国卒中学会(American Stroke Association,ASA)指南的格式确定(表1)。

表1 推荐强度与证据质量分级
1 颅内动脉粥样硬化性狭窄与卒中
ICAS是世界范围内缺血性卒中发生与复发的重要原因之一。在北美地区,ICAS占卒中病因的8%~10%,在亚洲地区占30%~50%[9-12],在中国,ICAS在卒中/TIA患者中的发生率高达46.6%[2]。
ICAS增加了卒中发生与复发的风险,同时也是卒中预后不良的重要危险因素之一。在华法林-阿司匹林治疗症状性颅内动脉疾病(warfarin and aspirin for symptomatic intracranial disease,WASID)研究和几项前瞻性队列研究中,即使对ICAS患者进行了积极药物治疗和危险因素干预,卒中的复发风险仍较高[13-16]。这促使研究者们致力于寻找包括外科治疗和血管内介入治疗在内的更有效的治疗方法。
ICAS的外科治疗始于1965年,自1985年颅外-颅内动脉搭桥手术研究的阴性结果发表后,因手术并发症高,临床应用受到了很大限制[17]。血管内治疗方面,支架治疗对比积极药物治疗预防颅内动脉狭窄卒中复发(stenting and aggressive medical management for preventing recurrent stroke in intracranial stenosis,SAMMPRIS)研究和Vitesse支架治疗缺血性卒中(Vitesse intracranial stent study for ischemic therapy,VISSIT)研究均因围手术期并发症发生率过高而被提前终止。这2项研究发现经皮腔内血管成形术和支架置入术(percutaneous transluminal angioplasty and stenting,PTAS)联合强化药物治疗组30 d围手术期卒中和死亡的发生率均显著高于强化药物治疗组[5,18]。这2项具有历史意义的大样本、多中心RCT的阴性结果对临床实践产生了极大的影响。在SAMMPRIS研究中,严格的内科治疗方案可使ICAS患者年卒中复发率降低至12.2%,但亚组分析发现头颅MRI中表现为分水岭梗死合并侧支循环代偿不良的患者1年卒中复发率仍高达到37%[19]。而真实世界中,很多患者达不到SAMMPRIS研究中严格的危险因素控制标准,ICAS,尤其是症状性ICAS(symptomatic ICAS,sICAS)仍是卒中发生与复发的重要危险因素,也是卒中预后不良的重要危险因素。许多有经验的神经介入治疗中心仍然继续为药物治疗失败的重度(狭窄程度≥70%)sICAS患者提供PTAS治疗。中国神经科医师应该重视卒中/TIA患者ICAS的筛查、诊断和评估,并在新的证据下,选择性地开展血管内治疗。
2 颅内动脉粥样硬化性狭窄的治疗
ICAS的治疗方法包括内科治疗、外科治疗和血管内治疗。外科治疗因为有较高的并发症,迄今没有得到全球范围内指南的推荐[6],而内科治疗与血管内治疗一直在被探索以求证ICAS的最佳治疗。目前的证据仍然支持内科治疗是ICAS的一线治疗方式。2011年发布的SAMMPRIS和2015年发布的VISSIT这2项RCT结果表明,积极的药物治疗比血管内治疗更有效,也更安全[5,18]。2018年的一篇比较支架置入与积极药物治疗sICAS的综述也指出,对比血管内治疗,内科治疗仍是sICAS的首选治疗方法[20]。
2.1 抗血小板药物治疗
SAMMPRIS研究奠定了强化药物治疗在防治ICAS中的一线地位,包括抗血小板治疗、强化降脂、危险因素的控制及生活方式的改变等。
在WASID研究之后,以阿司匹林为代表的抗血小板治疗已成为ICAS的标准治疗。但WASID研究也表明,单用阿司匹林治疗sICAS仍有较高的卒中复发率[14]。在此基础上,后续多项研究探索了阿司匹林联合其他药物的双联抗血小板治疗(dual antiplatelet therapy,DAPT)的潜在益处。基于SAMMPRIS研究结果[4],AHA/ASA卒中预防指南明确指出,对于重度sICAS(狭窄率70%~99%),在卒中或TIA发病的30 d内采用阿司匹林联合氯吡格雷DAPT治疗90 d可能是合理的[3,6]。需要说明的是,国外的研究应用阿司匹林时维持剂量多采用325 mg/d,而我国临床上多采用的维持剂量为100 mg/d。目前临床上联合阿司匹林的DAPT药物主要有氯吡格雷、西洛他唑和替格瑞洛。
2.1.1 氯吡格雷
氯吡格雷联合阿司匹林与单独使用阿司匹林用于减少急性症状性颈动脉或颅内动脉狭窄患者栓塞事件(clopidogrel plus aspirin versus aspirin alone for reducing embolisation in patients with acute symptomatic cerebral or carotid artery stenosis,CLAIR)研究结果显示,DAPT相比单独使用阿司匹林,可使患者TCD栓子监测发现的微栓子信号数量明显减少(31%vs. 54%),且7 d内卒中复发率降低(0vs. 3.8%)[21]。氯吡格雷用于急性非致残性脑血管病事件高危人群(clopidogrel in high-risk patients with acute non-disabling cerebrovascular events,CHANCE)研究证明短程DAPT可有效预防轻型卒中或TIA患者的卒中复发,对CHANCE研究中481例患者的二次分析显示,与阿司匹林相比,DAPT有减少颅内狭窄相关缺血事件的趋势(HR0.79,95%CI0.47~1.32),另外,该研究再次证实了ICAS患者的90 d卒中复发率显著高于非ICAS患者(12.5%vs. 5.4%,P<0.0001)[22]。因此,对颅内大动脉重度狭窄所致的卒中或TIA患者,使用阿司匹林联合氯吡格雷治疗是合理的。
2.1.2 西洛他唑
西洛他唑治疗s ICAS试验(trial of cilostazol in symptomatic intracranial arterial stenosis,TOSS)发现,相比阿司匹林单药或阿司匹林联合氯吡格雷,阿司匹林联合西洛他唑在预防卒中复发方面并无优势,安全性方面与单药应用相似[23]。西洛他唑联合阿司匹林预防伴颅内动脉狭窄的卒中复发(cilostazol-aspirin therapy against recurrent stroke with intracranial artery stenosis,CATHARSIS)试验显示,西洛他唑联合阿司匹林在预防所有血管事件和新发无症状性缺血性卒中的联合次要终点方面优于单用阿司匹林(10.7%vs. 25.0%,P=0.04),对ICAS进展的防治无显著性差异[24]。西洛他唑联合抗血小板预防卒中研究(cilostazol stroke prevention study for antiplatelet combination,CSPS.com)显示,西洛他唑联合阿司匹林或氯吡格雷与单独阿司匹林或氯吡格雷治疗ICAS相比,有更低的卒中复发风险(HR0.47,95%CI0.23~0.95,P=0.031)[25]。目前推荐对携带CYP2C19功能缺失等位基因的TIA或轻型卒中患者、合并颅内动脉狭窄的患者以及对阿司匹林或氯吡格雷禁忌的患者,西洛他唑替代氯吡格雷或阿司匹林可能是合理的。
2.1.3 替格瑞洛
对氯吡格雷耐药的患者(携带CYP2C19功能缺失等位基因的患者),替格瑞洛联合阿司匹林可作为氯吡格雷联合阿司匹林的替代治疗。阿司匹林或替格瑞洛用于急性卒中或TIA患者的预后(acute stroke or transient ischemic attack with aspirin or ticagrelor and patient outcomes,SOCRATES)研究的亚组分析表明,当卒中或TIA源于同侧动脉粥样硬化性狭窄时,替格瑞洛可能比阿司匹林更有效,但该亚组同时包含了颅内和颅外的血管狭窄[26]。替格瑞洛和阿司匹林治疗急性缺血性卒中或TIA预防卒中和死亡(acute stroke or transient ischaemic attack treated with ticagrelor and ASA for prevention of stroke and death,THALES)研究比较了阿司匹林单药与联合替格瑞洛用于轻、中度缺血性卒中或高风险TIA患者的疗效,结果显示替格瑞洛联合阿司匹林组的卒中或死亡风险低于安慰剂-阿司匹林组(5.5%vs. 6.6%,HR0.83,95%CI0.71~0.96,P=0.02),但2组之间的总体残疾率相似,并且替格瑞洛联合阿司匹林组发生严重出血的风险更高[27]。该研究的亚组分析显示,对于合并有同侧ICAS(狭窄率>30%)的患者,DAPT相比于单药抗血小板治疗可显著性降低30 d卒中复发及死亡率(9.9%vs. 15.2%,HR0.66,95%CI0.47~0.93,P=0.016)[28]。2021年《新英格兰医学杂志》发表了CHANCE 2研究的结果,该研究纳入了携带CYP2C19功能缺失等位基因的TIA或轻型卒中患者,发现在阿司匹林的基础上,联合替格瑞洛治疗相比联合氯吡格雷治疗可显著降低90 d卒中复发的风险,卒中复发率降低23%,且不增加中重度出血事件的风险。亚组分析显示,在1638例合并ICAS的患者中,采用替格瑞洛有一定的获益趋势,但该趋势未达统计学意义(HR0.76,95%CI0.55~1.04)[29]。THALES研究和CHANCE 2研究结果均显示,替格瑞洛治疗后出血风险高于阿司匹林联合氯吡格雷。目前推荐对于携带CYP2C19功能缺失等位基因的TIA或轻型卒中患者,以及合并ICAS的患者,替格瑞洛替代氯吡格雷联合阿司匹林治疗可能是合理的。
2.2 危险因素管理
2.2.1 血压管理
关于预防卒中的最佳血压目标的高级别证据有限。几项RCT的事后分析显示,ICAS患者在随访中平均收缩压<14 0 m m H g(1 mmHg=0.133 kPa)与较低的卒中及血管事件风险相关[30-31]。虽然多数ICAS患者可能受益于较低的血压,但一些小型研究表明,对于已知存在血流动力学障碍的患者或卒中急性期患者并不能从控制收缩压<120 mmHg中获益,且可获益的血压控制低限尚不明确[32-33]。对于ICAS患者,建议血压目标值为<140/90 mmHg,如果患者神经系统功能及症状稳定,在卒中后48~72 h内降低血压是相对安全的。
2.2.2 血脂
脂蛋白代谢紊乱是动脉粥样硬化重要的危险因素之一,TC、LDL-C升高及HDL-C降低与ICAS的发生密切相关[1]。指南推荐对ICAS所致的卒中或TIA患者采取强化降脂治疗。强化降低胆固醇水平预防卒中(stroke prevention by aggressive reduction in cholesterol levels,SPARCL)试验的亚组分析探索了降脂治疗对不同原因所致卒中或TIA患者的二级预防作用,结果发现与LDL-C>100 mg/dL(安慰剂组)相比,LDL-C<70 mg/dL(阿托伐他汀钙80 mg/d)的患者卒中风险显著降低[34-36]。在在WASID研究中,总胆固醇≥200 mg/dL是卒中复发的独立预测因素(HR1.95,95%CI1.29~2.97,P=0.002)[30]。SAMMPRIS研究的事后分析也显示血脂控制不达标(目标为LDL-C<70 mg/dL)与3年内血管事件的发生率增加相关(OR1.8,95%CI1.0~3.6)[31]。对于他汀不耐受或疗效欠佳的患者,前蛋白转化酶枯草溶菌素kexin 9型(proprotein convertase subtilisin/kexin type 9,PCSK9)抑制剂是可能的替代选择,但其在ICAS中的疗效尚待进一步的研究证实。
2.2.3 血糖
糖尿病和血糖异常是sICAS的独立危险因素,目前尚缺乏控制血糖对动脉粥样硬化的疗效以及预防ICAS患者卒中复发的研究。SAMMPRIS研究对药物治疗组中糖尿病患者的3年随访显示,糖化血红蛋白>7%可增加缺血性卒中的风险(OR2.3,95%CI1.0~5.0)[31]。目前指南建议对多数患者将糖化血红蛋白控制在≤7%,以降低微血管并发症的风险[37-38]。
2.2.4 生活方式
健康的生活方式对卒中的一级和二级预防都至关重要,包括戒烟、充分的体育活动和建立健康的饮食习惯[6]。对SAMMPRIS试验的事后分析表明,每周3~5次中等强度的运动可独立降低ICAS患者血管事件复发的风险(OR0.6,95%CI0.4~0.8)[31]。
推荐意见:
(1)对于sICAS患者,应在发病后尽早启动以阿司匹林为基础的抗血小板治疗及强化内科治疗(B-R级证据,强推荐)。
(2)ICAS发病早期,推荐双联抗血小板治疗以降低血栓栓塞导致的早期卒中复发风险。建议阿司匹林和氯吡格雷双联抗血小板治疗90 d(B-NR级证据,中等推荐);对氯吡格雷耐药的患者(如携带CYP2C19功能缺失等位基因),替格瑞洛联合阿司匹林治疗是合理的(B-NR级证据,弱推荐),西洛他唑(200 mg/d)治疗是合理的(B-NR级证据,中等推荐)。
(3)合并高血压的ICAS患者应积极控制血压,降压治疗的启动时机及血压目标值应个体化。如无特殊,长期血压控制目标宜<140/90 mmHg,原则为逐步平稳降压(B-NR级证据,强推荐);选择降压药物应充分考虑患者全身靶器官损害及对药物耐受性的情况,可优先考虑长效降压药物(C-EO级证据,中等推荐)。
(4)推荐对ICAS患者早期启动强化降脂治疗(B-R级证据,强推荐);推荐使用他汀类药物将LDL-C降至<1.8 mmol/L(70 mg/dL)(B-NR级证据,中等推荐);必要时可考虑加用依折麦步和(或)PCSK9抑制剂(C-EO级证据,弱推荐)。
(5)对于伴糖尿病的ICAS患者,血糖控制目标为糖化血红蛋白≤7%可能是合理的(B-NR级证据,中等推荐)。
(6)倡导健康生活方式,每周3~5次中等强度的体育运动、控制其他危险因素以降低卒中复发风险(B-NR级证据,中等推荐)。
2.3 血管内治疗
对于sICAS的血管内治疗,虽然因为对比药物和药物联合血管内治疗RCT的阴性结果而变得更加谨慎,但一直在向前推进中。部分高质量的针对sICAS血管内治疗的临床RCT正在进行,数据在陆续更新,如刚结束的颅内支架联合药物治疗对比单纯药物治疗的中国血管成形术及支架置入用于严重sICAS(China angioplasty and stenting for symptomatic intracranial severe stenosis,CASSISS)研究(NCT:01763320)[39],正在进行的颅内单纯球囊扩张联合药物对比单纯药物治疗的球囊血管成形术用于sICAS(balloon angioplasty for symptomatic intracranial artery stenosis,BASIS)研究(NCT:03703635)。近年来关于sICAS的血管内治疗的临床进展有:单纯球囊扩张的理念,包括对富穿支部位血管的亚满意扩张(亚满意扩张定义为球囊选择小于正常管径0.5 mm或大小约为正常血管直径的50%~80%)理念的临床应用[40],超说明书使用支架的临床应用,以及为了解决再狭窄问题的,针对ICAS的神经专用药物涂层支架(drug-eluting stent,DES)、药物涂层球囊的问世。
2.3.1 血管内治疗的临床研究
早在1980年,神经科医师借鉴冠状动脉狭窄治疗的思路,进行了第1例ICAS患者的血管成型治疗[41],此后ICAS的血管内治疗便蓬勃发展起来。
2009年,Miao等[42]报道了113例sICAS患者采用冠状动脉球扩支架治疗的单中心回顾性研究,技术成功率为96.5%,30 d内卒中/死亡的发生率为4.42%,在平均29个月的随访中,卒中/TIA的复发率为6.74%,支架内再狭窄(in-stent restenosis,ISR)发生率为20.25%。该研究提示球扩式支架是治疗sICAS安全、有效的方法。
2011年,Chimowitz等[18]于《新英格兰医学杂志》发表了Wingspan自膨支架的SAMMPRIS研究,结果显示对于sICAS患者,强化内科治疗优于Wingspan支架治疗。支架组30 d内卒中/死亡发生率高于强化内科治疗组(14.7%vs. 5.8%,P=0.002),在后续随访期间,支架组1年的卒中/死亡发生率高于强化内科治疗组(20.0%vs. 12.2%,P=0.009)。该研究一方面提示强化内科治疗较阿司匹林单抗治疗大幅降低了sICAS患者30 d卒中/死亡的发生率,同时也证明了支架治疗围手术期并发症明显高于药物治疗,也明显高于既往的支架登记研究结果。该研究32个月的随访结果显示,强化内科治疗组的责任血管供血区缺血性卒中/死亡事件发生率较支架组更低(15%vs. 23%,P=0.0252)[4]。
2013年,Park等[43]报道了115例sICAS患者行支架治疗的单中心回顾性研究,该研究以既往选用球扩式支架治疗的患者为对照组(71例),观察组是术者可以根据病变特点自主选择球扩式支架或自膨式支架治疗的患者(44例),结果发现观察组手术成功率为100%,30 d内卒中/死亡的发生率低于对照组(2.3%vs. 14.0%,P=0.049)。进一步分析发现,球扩式支架有更低的残余狭窄发生率(18%vs. 32%,P<0.001)。研究提示在富含穿支的病变处,要避免使用球扩式支架,因为球扩时的雪犁效应可能导致更多的穿支事件发生。与无穿支梗死相比,有穿支梗死的患者使用球扩式支架后发生穿支梗死事件的比例更高(8.2%vs. 0.8%,P<0.001)[44]。球扩支架与自膨式支架的选择主要需要考虑以下3个因素:血管的迂曲程度、病变远端和近端的血管直径差异以及是否有穿支事件的发生。2013年,Shin等[45]也发表了1项单中心回顾性研究,针对内科治疗无效的77例sICAS患者进行了Wingspan支架置入治疗,结果显示技术成功率为100%,30 d内卒中/TIA的发生率为5.3%,无死亡病例,在平均18.9个月的随访期间,TIA/卒中的复发率为8.1%,死亡率为0。
2015年,Zaidat等[5]于JAMA杂志发表了与SAMMPRIS研究同期进行的VISSIT研究,结果显示,在sICAS患者中,球扩式支架治疗30 d(24.1%vs. 9.4%,P=0.05)及12个月(36.2%vs. 15.1%,P=0.02)终点事件的发生率高于内科治疗。同年,Miao等[46]发表的中国多中心前瞻性sICAS支架治疗注册研究(registry study of stenting for symptomatic intracranial artery stenosis in China,Aire/Wire-China)共纳入300例sICAS患者,根据路径、病变血管的形态等由术者自主选择球扩式支架或自膨式支架,结果发现30 d主要终点事件(卒中、TIA、死亡)的发生率仅为4.3%,1年靶血管供血区缺血性卒中、任何出血性卒中、血管源性死亡事件的发生率为8.1%。研究结果提示支架治疗sICAS是安全有效的。
2016年,Wang等[47]报道了单中心196例连续患者应用Wingspan支架治疗症状性重度大脑中动脉(middle cerebral artery,MCA)狭窄的回顾性研究结果,技术成功率为98.0%,30 d围手术期卒中/死亡的发生率为7.1%,并且早期阶段围手术期并发症的发生率明显高于技术成熟后(16.0%vs. 4.1%,P<0.01),在1年、2年的随访期间,累计卒中发生率分别为9.6%和12.1%,在6~69个月(平均10.9±8.5个月)的影像随访中,ISR的发生率为20.4%。研究结果提示在高容量介入中心,Wingspan支架治疗症状性重度MCA狭窄是安全、有效的。同年Bai等[48]回顾性分析了该中心应用Wingspan支架治疗症状性重度基底动脉狭窄的91例患者的资料,技术成功率100%,治疗前后血管狭窄率由平均82.2%降至15.9%。30 d卒中/死亡的发生率为14.3%(缺血性卒中为13.2%,蛛网膜下腔出血为1.1%),在平均31.3个月的随访中,缺血性卒中/TIA的发生率5.2%,24个月累计卒中发生率为16%。在平均9.5个月的影像随访中,ISR的发生率13%,其中症状性ISR占4.3%。研究提示围手术期并发症发生率低是支架治疗症状性重度基底动脉狭窄可获益的前提。同样在2016年,Zhao等[49]报道了单中心278例连续患者应用Wingspan支架治疗sICAS的回顾性研究结果,技术成功率为99.6%,30 d卒中/死亡的发生率为4.3%(出血性卒中为2.9%,缺血性卒中为1.4%,死亡2例),在1年与2年的随访中,卒中/死亡的发生率分别为5.8%(95%CI5.0%~15.7%)和7.2%(95%CI4.3%~10.1%)。研究结果提示应用Wingspan支架治疗sICAS是安全、有效的,在长期的随访中,支架置入后卒中的复发率较低。
2018年,Baik等[50]回顾性分析了该中心应用球扩式支架治疗症状性重度MCA狭窄的34例患者资料,技术成功率100%,30 d卒中/死亡的发生率为0,在61~108个月(中位数为67.5个月)的随访期中,有14.7%(5/34)的患者出现TIA(复查影像发现1例血管再闭塞,3例ISR),其余患者在随访期无任何缺血事件和ISR。
2019年发表的Wingspan支架系统上市后监测(Wingspan stent system post market sur vei l lance,WEAV E)研究结果显示,Wingspan支架置入的围手术期并发症(卒中、TIA和死亡)发生率仅为2.6%[51]。Wingspan支架后1年血管事件与神经功能结局(Wingspan one-year vascular events and neurologic outcomes,WOVEN)研究结果显示,1年卒中与死亡的发生率仅为8.5%[52]。进一步证明了在严格把握手术适应证后,支架置入治疗sICAS是安全有效的。
2020年,Wang等[53]对支架治疗sICAS的研究进行了系统回顾和meta分析。研究对象来自16个国家、92项研究的8408例患者,结果显示,短期卒中/死亡的发生率为6.68%(95%CI5.60%~8.36%),长期卒中/死亡的发生率为4.43%(95%CI2.61%~6.60%),校正年龄、性别等因素后,西方国家的短期及长期卒中/死亡的发生率明显高于东方国家(10.27%vs.5.52%,P=0.018)。
2021年,Li等[54]报道了1项来自中国真实世界的单中心颅内动脉支架与标准药物治疗后循环颅内动脉症状性重度狭窄的回顾性研究,共纳入238例患者,其中62例患者接受标准内科治疗,174例患者接受了支架置入治疗。支架置入技术成功率为98.9%,在1个月、6个月及12个月的随访中,支架治疗组的主要终点事件(出血、死亡及责任动脉供血区缺血性卒中)的发生率均低于标准药物治疗组(1个月:8.6%vs.17.7%,P=0.049;6个月:14.4%vs. 29.0%,P=0.01;12个月:17.2%vs. 32.2%,P=0.013)。6个月ISR的发生率为13.8%,其中40%为无症状再狭窄。12个月随访中,标准药物治疗组严重卒中(NIHSS较基线增加3分以上)的发生率为9.7%,而支架置入组为0。研究结果提示,对于中国真实世界中的后循环sICAS患者,支架置入是相对安全的,与标准药物治疗相比,支架置入可能有更好的长期神经功能改善效果及更低的致残性卒中风险。2021年,Mohammaden等[55]报道了1项多中心球扩式支架治疗sICAS的回顾性研究结果,2010-2020年间,15个中心的232例患者接受了球扩式支架治疗,治疗后72 h内卒中发生率为5.6%(3.9%为缺血性,1.7%为出血性),死亡率为0.9%。在中位数为6个月的随访期中,TIA的发生率为6.3%,卒中的发生率为3.7%,非卒中所致死亡率为1.6%。药物涂层支架组ISR发生率为21.4%,裸支架组为28.6%,两者没有显著差异。ISR患者中症状性ISR的发生率为11.3%(药物涂层支架组为10.0%,裸支架组为12.7%)。
2022年发表的CASSISS研究对比了支架(winspan支架系统)联合药物治疗与单纯药物治疗对sICAS患者卒中和死亡的影响,为sICAS的治疗提供了新的医学证据[56]。该研究在2014年3月-2016年11月,从8家中国高容量中心共纳入380例sICAS患者,随访期为3年。研究结果显示,对于重度sICAS患者,支架联合药物治疗在预防卒中或死亡方面,与单纯药物治疗效果相当[8.0%(14/176)vs. 7.2%(13/181),HR1.10,95%CI0.52~2.35,P=0.82],次要结局,如责任血管区卒中、致残性卒中、死亡率等的差异均未达统计学意义。该研究也首次证实了在高容量中心,对经过严格筛选的sICAS患者进行血管内治疗并不增加额外手术风险。
从颅内动脉狭窄的血管内治疗发展历程可以看出,虽然被寄予厚望的SAMMPRIS、VISSIT和CASSISS研究没有显示出血管内治疗对比内科治疗的优势,但在真实世界中,由于药物治疗下仍然存在较高的卒中复发风险,所以探索更安全、更有效的血管内治疗方法,包括材料的发展和进步,一直没有停止。在后SAMMPRIS时代,越来越多的临床研究注重严格筛选患者、控制手术适应证,如WEAVE研究和来自中国的多中心注册登记结果等,都表明在成熟的神经介入中心对sICAS进行血管内治疗,具有较高的安全性与可期待的疗效[46,52]。而CASSISS研究也为未来sICAS的研究提供了启示,聚焦于疾病诊断评估的理念和技术革新,以及介入治疗器械的进步。
对本部分研究的汇总见附表1。
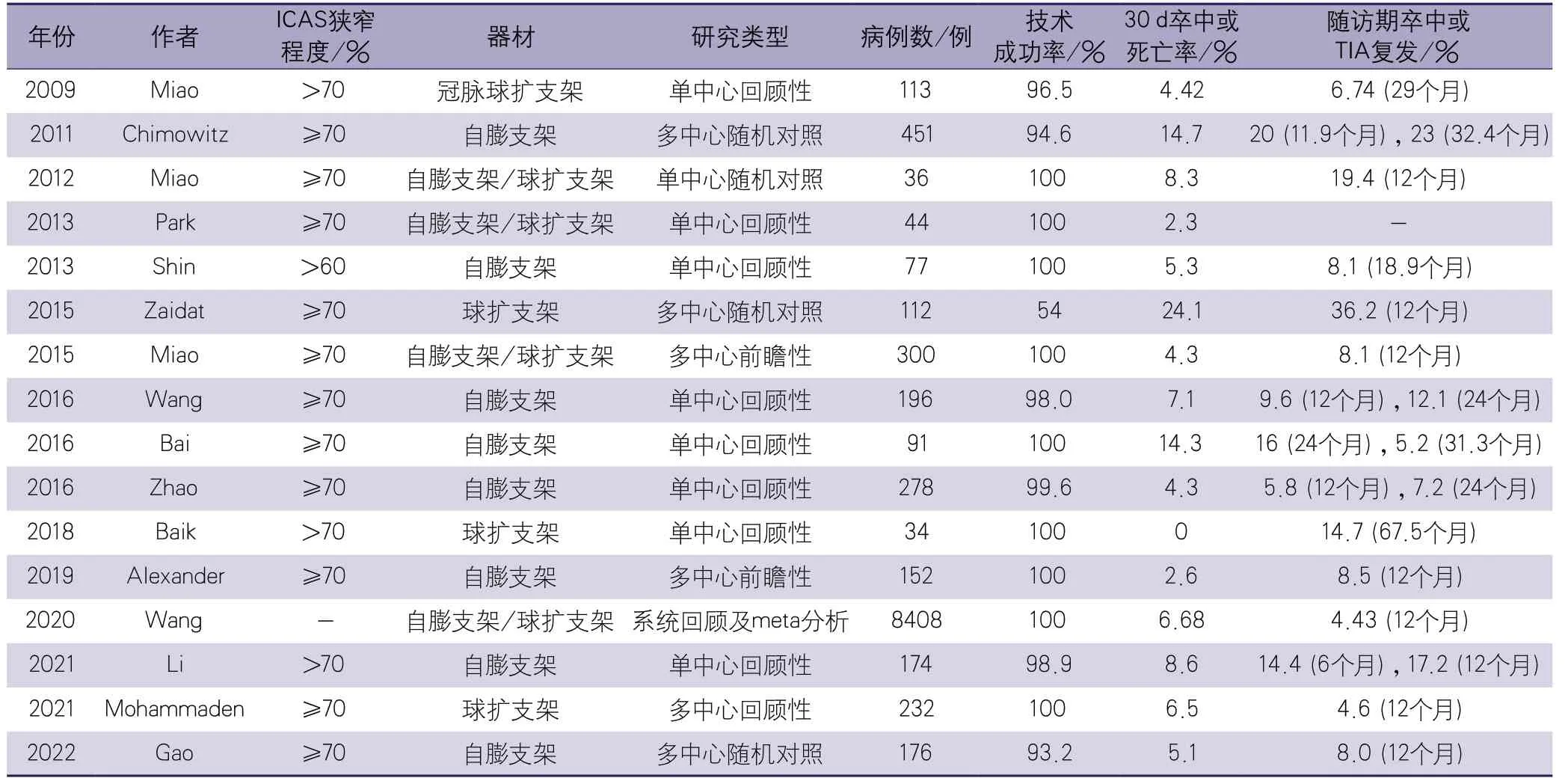
附表1 球囊扩张支架/自膨支架治疗ICAS的相关研究
推荐意见:
(1)强化内科治疗是sICAS患者的基础治疗,sICAS患者无论是否选择血管内治疗均应接受强化内科治疗(包括抗血小板治疗和控制危险因素)(B-R级证据,强推荐)。
(2)经过培训的医师在有丰富经验的医疗中心,在患者满足筛选条件的情况下,进行支架置入治疗sICAS是安全的,可以考虑作为强化内科治疗以外的有效、安全的补充治疗(B-R级证据,弱推荐)。
(3)对于sICAS高风险(经过强化内科治疗无效、重度狭窄、责任血管供血区存在低灌注、侧支循环代偿不良)人群,选择支架置入治疗sICAS可能是合理的(C-LD级证据,弱推荐)。
2.3.2 超说明书使用支架的应用
超说明书使用支架是指非专为ICA S设计的,用于其他颅内疾病的支架,通常是动脉瘤辅助栓塞的支架。该支架可以经过0.0165~0.0270 in(1 in=2.54 cm)的微导管释放,所以通过迂曲血管到达靶病变血管的能力较ICAS专用支架更强,同时该支架适度的支撑力及更多的尺寸选择可以适用于不同的血管内径,因而被越来越多的神经介入医师选择[57-58]。常用的超说明书使用支架与Wingspan支架的物理特征比较见表2。

表2 常用的超说明书使用支架与Wingspan支架的物理特征比较
2012年,Vajda等[59]报道了单中心应用Enterprise(EP)支架治疗189例sICAS患者的回顾性研究结果。技术成功率为100%,围手术期并发症为8.1%,30 d死亡率为0.9%。174例患者完成了平均10.2个月的DSA随访,≥50%的ISR发生率为24.7%,其中9.3%为症状性ISR。在平均10.2个月的随访期中,支架置入相关区域缺血性卒中的发生率为2.2%。研究结果提示,EP支架治疗sICAS是安全、有效的。研究者同时指出,支架治疗后的ISR发生率很有可能被低估,因为在多数研究中,只有出现症状的患者才进行影像评估。
2015年,Feng等[60]报道了单中心EP支架治疗sICAS的回顾性研究,共纳入44例患者,技术成功率为100%,围手术期卒中发生率为9.0%(缺血性卒中6.8%,出血性卒中2.2%),在平均22个月的随访期中,≥50%的ISR发生率为6.81%。研究结果提示EP支架可作为治疗sICAS的替代选择并提出了EP支架治疗sICAS的适应证:①由DSA确认的>70%狭窄率;②尽管接受了强化内科治疗,但仍有低血流动力学性的TIA或非致残性缺血性卒中复发或狭窄进展;③病变较长、位于动脉分叉处、病变远近端血管直径差别较大和(或)曲折通路。
2016年,Lee等[61]回顾性分析了其中心应用EP支架治疗的30例sICAS患者,技术成功率100%,治疗后血管狭窄率由81%降至18%,30 d卒中/死亡的发生率为10%,在平均15.8个月的随访中无卒中/死亡发生,ISR的发生率为5.0%。同年,Wang等[62]报道了单中心60例EP支架治疗sICAS的回顾性研究,技术成功率为100%,围手术期并发症发生率为8.3%(支架内血栓、支架后夹层、支架后血管痉挛各1.7%,缺血性卒中3.2%),30 d死亡率为0,6个月DSA随访发现ISR发生率为13.3%,其中症状性ISR占83%。研究结果提示EP治疗sICAS具有较高的技术成功率和较低的围手术期并发症发生率。
2018年,Du等[63]报道了应用Neuroform EZ支架治疗sICAS的单中心回顾性研究,共纳入45例患者,技术成功率为100%,30 d血管相关的并发症发生率为2.2%,随访7.3个月无ISR发生。研究者同时指出,相对于Wingspan支架,较小的径向支撑力可能是Neuroform EZ支架穿支事件和ISR发生率较低的原因。
2019年,Salik等[64]报道了EP支架治疗sICAS的单中心研究结果,共68例患者接受了EP支架治疗,技术成功率99%,围手术期卒中/死亡发生率0,围手术期颅内出血发生率1.5%。60例患者接受平均22个月的随访,ISR发生率为3.3%,无TIA和卒中复发。2019年,Xu等[65]还报道了单中心Neuroform EZ支架治疗sICAS的回顾性研究,共纳入71例患者,技术成功率100%,30 d内同侧卒中、颅内出血及死亡的发生率0。
2020年,Meyer等[66]报道了3个高容量卒中中心应用Acclino(flex)支架治疗sICAS的回顾性研究,共纳入76例患者,平均年龄69岁,围手术期卒中发生率为6.5%(致死性卒中为2.6%,非致死性卒中为3.9%),在中位数为110 d的随访期中,卒中与TIA的复发率为6.7%。6个月随访中,DSA检查发现ISR发生率为25%,其中11.6%的患者接受了再次球囊扩张治疗。
2021年,Su n等[67]报道了EP支架治疗sICAS的单中心回顾性研究并进行了系统分析,该研究共纳入105例接受了EP支架治疗的患者,手术成功率为100%,30 d卒中/死亡发生率为6.7%。作者进一步系统分析了7项研究,共557例患者,结果显示EP支架治疗30 d卒中/死亡的发生率为7.4%,责任动脉供血区缺血性卒中/TIA的发生率为3.2%,ISR的发生率为10.1%,其中症状性ISR发生率为4.1%。同年,Zhou等[68]回顾性比较了单中心Neuroform EZ支架与Wingspan支架治疗sICAS的安全性与有效性。研究共纳入190例患者,其中113例患者接受了Wingspan支架置入治疗,77例接受EZ支架治疗,结果发现2组围手术期卒中/死亡的发生率差异无统计学意义(7.4%vs. 5.6%,P=1.00),在平均8.3个月的随访期间,ISR的发生率也无显著差异(23.3%vs. 14.3%,P=0.41)。
2022年,Li等[69]报道了Neuroform EZ支架治疗70例sICAS患者的单中心回顾性研究结果,技术成功率为100%,30 d卒中/死亡的发生率为0,在1年的随访期中,卒中、TIA及死亡的发生率为0。42例患者在1年时接受了影像学的随访,ISR的发生率为9.5%。
超说明书使用支架因为其适中的径向支撑力、更容易通过迂曲路径、操作更简单、更多尺寸选择等优势,正被大量应用于ICAS的治疗,如强生医疗科技的Enterprise二代支架已获得了治疗ICAS适应证的欧盟标准认证,但目前仍需更高级别的临床证据,尤其是RCT来进一步证实超说明书使用支架在sICAS治疗中的安全性和有效性。
对本部分研究的汇总见附表2。

附表2 超说明书使用支架治疗ICAS的相关研究
推荐意见:
基于目前的临床经验及报道,经微导管释放的自膨支架在治疗中降低了操作难度,有助于提高技术成功率并降低手术并发症发生率,超说明书使用支架在sICAS治疗中选择性应用可能是合理的(C-EO级证据,中等推荐)。
2.3.3 单纯球囊扩张治疗
既往单纯球囊扩张治疗sICAS的效果并不令人满意,30 d内卒中/死亡的发生率为4%~40%[70-77],且随访期的再狭窄率高达24%~40%[73,77]。该技术早期存在以下弊端:多为冠状动脉球囊,球扩后病变血管的即刻弹性回缩、血管夹层发生率高且常有>50%的残余狭窄及较高的再狭窄率。但在后续的研究中,随着球扩理念的更新(如缓慢扩张、缓慢泄球囊技术,亚满意扩张技术等)、充分的药物治疗以及颅内专用球囊的不断改进,目前单纯球囊扩张在治疗sICAS中逐渐被临床认可。
2006年,Marks等[78]报道了美国3个中心,120例单纯球囊扩张治疗sICAS的回顾性临床研究,技术成功率为100%,治疗前平均狭窄率为82.2%,治疗后平均狭窄率为36%,围手术期卒中/死亡的发生率为5.8%,在平均42.3个月的随访期间,有8.3%的患者死于非神经系统疾病,靶血管供血区年卒中发生率为3.2%,所有卒中的发生率为4.4%,再狭窄的发生率为23.9%。有12.9%的患者在单纯球囊扩张后狭窄没有改变甚至加重(即刻弹性萎缩、血管内膜损伤导致血栓形成),或因球囊扩张后出现动脉夹层而采用支架补救治疗。
2008年,Siddiq等[79]报道了单纯球囊扩张与支架置入治疗sICAS的回顾性对比研究,共纳入3个中心的190例患者(193处病变),结果发现球囊扩张组术后即刻残余狭窄率高于支架置入治疗组(15%vs. 4.1%,P=0.001),2组的围手术期(30 d)卒中/死亡发生率无显著差异(8.4%vs. 9.2%,P=0.85)。在中位12个月的影像随访中,2组ISR的发生率也没有显著差异(38.9%vs. 34.0%,P=0.93)。研究提示尽管单纯球囊扩张术后即刻的残余狭窄率高于支架置入术,但是两者在疗效及安全性上没有显著差异,而且单纯球囊扩张具有手术时间短和花费少的优势。
2013年,Qureshi等[80]发表了比较单纯球囊扩张与支架置入治疗sICAS有效性和安全性的单中心、前瞻性RCT,共纳入18例患者,2组治疗后<30%残余狭窄的比例无显著差异(50.0%vs. 62.5%),30 d内2组的卒中/死亡率也无显著差异,所有的患者在随访期(6~8个月)中无卒中复发,单纯球囊扩张组ISR的发生率为0,支架置入治疗组ISR发生率为42.9%。
2015年,Okada等[81]回顾性分析了该中心单纯球囊扩张治疗的症状性重度MCA狭窄患者的资料,共入组47例患者,技术成功率为95.7%,治疗后血管狭窄率由治疗前的79.9%降至39.5%。30 d卒中/死亡率为6.4%,平均随访51.5个月,卒中/死亡率为9.4%,再狭窄发生率为26.9%,均为无症状性再狭窄。
2016年,Dumont等[82]报道了单纯球囊亚满意扩张治疗(球囊直径为正常血管的50%~70%)sICAS的单中心前瞻性研究结果。该研究共纳入24例患者,技术成功率为100%,治疗前血管平均狭窄程度为80.16%,治疗后血管平均狭窄程度为54.62%,30 d内卒中/死亡发生率为0,在1年的随访期内,靶血管供血区卒中复发率为5.55%。研究结果提示单纯球囊亚满意扩张治疗sICAS是安全有效的。作者还指出,亚满意扩张足够改善血流灌注,亚满意缓慢充盈(1 atm/min,1 atm=101 kPa)及泄压(2 atm/min)技术能最大限度地减少动脉损伤、避免斑块破裂导致的血栓栓塞、减少穿支雪犁效应的发生,从而减少围手术期并发症及ISR的发生。2016年还发表了1项来自2005-2011年美国住院患者数据库(nationwide inpatient sample,NIS)的研究数据,比较了单纯球囊扩张与支架置入治疗sICAS的有效性和安全性。该研究共纳入2059例患者,其中71%接受了支架置入治疗,单纯球囊扩张与支架置入相比有更高的围手术期死亡率(17.6%vs. 8.4%,P<0.001),2种治疗方式的医源性卒中发生率没有显著差异(3.4%vs. 3.6%,P=0.826)。该研究提示,支架置入治疗的安全性优于单纯球囊扩张术,不过研究也指出,纳入数据的偏倚可能是导致这种差异的原因之一[83]。
2018年,Wang等[84]报道了单纯球囊扩张治疗sICAS的单中心回顾性研究,共纳入35例患者,平均狭窄程度为88.4%,平均随访时间为9.7个月,技术成功率100%,30 d卒中/死亡的发生率为2.9%,随访期卒中/死亡的发生率为2.9%,随访期血管内再狭窄发生率为12%,且均为无症状性再狭窄。
2020年,Seyedsaadat等[85]对19项研究共777例接受亚满意扩张治疗的sICAS患者进行了meta分析。技术成功率为93%,30 d和1年所有卒中的发生率分别为3%和5%,死亡率分别为1%和2%,卒中和死亡的发生率分别为5%(95%CI3%~8%)和9%(95%CI7%~12%)。1年再狭窄的发生率为20%。研究结果提示亚满意球囊扩张治疗sICAS是安全的治疗方式。同年,Stapleton[40]对亚满意扩张治疗sICAS进行了系统分析,共纳入9项研究的395例患者,发现30 d卒中/死亡的发生率为4.9%(95%CI3.2%~7.5%),30 d后卒中/死亡率为3.7%(95%CI2.2%~6.0%)。在有详细记录不良事件的6项研究中,255例患者随访期内再狭窄发生率为18.4%,症状性再狭窄仅占2.7%。
2021年,Peng等[86]对14项比较药物治疗、单纯球囊扩张和支架置入治疗sICAS的研究,共1520例患者进行了meta分析,结果发现,3组的主要终点事件(30 d内所有卒中/死亡和30 d后责任血管供血区的缺血性卒中)发生率无显著差异;药物治疗组较支架组30 d内卒中/死亡(OR0.31,95%CI0.17~0.56)、缺血性卒中(OR0.43,95%CI0.23~0.81)和颅内出血(OR0.12,95%CI0.02~0.71)的发生率均显著降低,但与单纯球囊扩张组相比,差异无统计学意义;在30 d后的随访期间,各组责任血管供血区缺血性卒中的发生率无显著差异;单纯球囊扩张组在长期预防卒中复发方面有降低趋势,但差异未达统计学意义。
单纯球囊扩张治疗sICAS,尤其是缓慢充盈球囊至亚满意度再缓慢泄压技术,可减少血管损伤、血栓栓塞及防止穿支发生雪犁效应,从而降低围手术期并发症和远期血管内再狭窄的发生率。因此,单纯球囊扩张治疗sICAS可能是一种安全、有效的方法。鉴于脑血管肌层薄等解剖学特点,治疗ICAS过程中球囊压力大小成为影响结局的另外一个可考虑的因素。2020年我国国家药品监督管理局批准的首款Neuro LPSTM快速交换颅内低压球囊(命名压3 atm,现常用球囊6 atm),其推送性、通过性、顺应性进一步优化,安全性和实用性得到更大的提高。低压颅内球囊可降低血管内膜损伤、急性血小板/血栓沉积、急性闭塞的发生率,使手术安全性得到提高[77,86-87]。与强化药物治疗相比,联合球囊扩张治疗的临床疗效是否更佳还有待更高级别的临床研究去证实。目前正在进行的BASIS研究正是评价单纯球囊扩张与联合积极药物治疗对sICAS的安全性和有效性的前瞻性、多中心、随机、平行对照临床研究,期待其研究成果的发表。
对本部分研究的汇总见附表3。

附表3 单纯球囊扩张治疗ICAS的相关研究
推荐意见:
(1)单纯球囊扩张治疗sICAS可能是安全、有效的,治疗中可优先选择颅内专用球囊及低压、半顺应性球囊以提高手术的安全性(C-LD级证据,中等推荐)。
(2)单纯球囊扩张成形技术操作上建议缓慢充盈和缓慢泄压,扩张后进行较长时间的血流观察,出现限流性夹层或弹性回缩应进行补救性支架置入治疗。建议球囊选择直径为责任血管参考直径的50%~80%(亚满意扩张)(C-EO级证据,弱推荐)。
2.3.4 药物涂层球囊/支架治疗
药物涂层支架(drug-eluting stent,DES)治疗冠状动脉狭窄的短期和长期有效性及安全性在心血管领域早已得到证实。2012年1项纳入76项RCT的荟萃分析提示,DES可降低39%~61%的靶血管再狭窄,同时明显降低心肌梗死的复发率[88]。
早在2005年,Abou-Chebl等[89]为了防止颅内动脉支架置入后再狭窄,采用冠状动脉的Cypher(Cordis Corp)和Taxus(Boston Scientific Inc)DES置入治疗了8例sICAS患者,治疗后平均随访11.1个月,期间无卒中复发,同时平均9.6个月的影像随访期间也未发现≥50%的ISR。
2006年,Gupta[90]报道了2个中心共59例应用冠状动脉DES[Cypher(Cordis Corp)和Taxus(Boston Scientific Inc)]治疗sICAS的回顾性研究结果,技术成功率为100%,围手术期并发症发生率为3%,在中位数为4.2个月的随访期间,Cypher(Cordis Corp)支架治疗的ISR发生率仅为5%。2006年,Qureshi等[91]也报道了18例冠状动脉DES[Cypher(Cordis Corp)和Taxus(Boston Scientific Inc)]治疗sICAS的单中心回顾性研究结果。技术成功率为100%,30 d内卒中发生率为5.6%,无死亡发生,在6个月的随访期间也无卒中及死亡发生,ISR的发生率为14%。1年随访的卒中/死亡的发生率为11%。
2011年,Fields[92]报道了DES[Cypher(Cordis Corp)和Taxus(Boston Scientific Inc)]治疗症状性重度椎动脉狭窄的单中心回顾性研究结果,共纳入26例患者,技术成功率100%,30 d内严重致残性卒中的发生率为8%,在14个月的平均随访期间,死亡率为27.3%,ISR发生率在颅内段为37.5%。该研究提示DES是安全的,但是该研究未发现DES有更好的防治ISR的作用。
2012年,Vajd a等[93]报道了冠状动脉DES[Coroflex®Please(B.Braun,Melsungen,Germany)]治疗sICAS的单中心回顾性研究结果,技术成功率93%,30 d卒中/出血/死亡的发生率为4.6%,在平均16个月的随访中,无症状ISR的发生率是3.8%,晚期支架内血栓形成发生率为0.9%。研究结果提示DES治疗sICAS安全、有效,但是由于该支架偏硬,其技术成功率不高。
2018年,Gruber等[94]比较了药物涂层球囊Neuro Elutax SV(Aachen Resonance)与Wingspan支架治疗sICAS患者的效果,共回顾性纳入了19例患者。结果显示两者的技术成功率和围手术期不良事件发生率无显著差异,在近1年的随访期间,支架治疗组卒中的复发率远高于药物涂层球囊组(45%vs. 0,P=0.03),同时支架治疗组临床复合终点事件(缺血性卒中复发/再狭窄)的发生率也远高于药物涂层球囊组(64%vs. 13%,P=0.03),2组再狭窄的发生率分别为55%和13%。
2019年,Han等[95]报道了药物涂层球囊SeQuent Please(B. Braun,Berlin,Germany)治疗sICAS的单中心回顾性研究。共30例sICAS患者接受了治疗,所有的患者都成功进行了球囊扩张,93.5%(29/30)的患者获得了良好的前向血流,6.7%(2/30)的患者进行了支架治疗补救。围手术期卒中发生率为6.7%,无死亡病例;在平均9.8个月的随访期间内无症状性卒中复发;在平均7个月的影像随访期间,再狭窄的发生率为3.2%,均为无症状性再狭窄。
2019年,Ye等[96]发表了1项关于DES治疗sICAS的meta分析,共纳入13项研究,336例患者(364处病变),影像随访时间为4~56个月,临床随访时间为4~67个月。结果发现,支架置入技术成功率为85.4%~100%;30 d内没有死亡发生,30 d内所有卒中的发生率为6.0%,30 d内所有卒中/TIA的发生率为8.1%,30 d后靶血管供血区缺血性卒中的发生率为2.2%;随访期内ISR发生率为4.1%,其中症状性ISR发生率仅为0.5%。
2020年,Hassan等[97]报道了应用第2代冠状动脉DES(佐他莫司包被,R-onyx DES)治疗sICAS的单中心回顾性研究结果,共19例患者,技术成功率100%,围手术期卒中/死亡率为0,在6个月的随访期间,仅有1例患者发生TIA,6个月的ISR发生率为0。
2022年首都医科大学附属北京天坛医院缪中荣团队[98]发表在JAMA Neurology上的比较裸支架和DES(NOVA)治疗sICAS的多中心、大样本、随机对照、优效性临床研究结果显示:与颅内球扩式裸支架系统Apollo支架相比,NOVA支架可显著降低sICAS患者1年的ISR发生率(9.5%vs. 30.2%,P<0.001),显著降低31 d至1年的缺血性卒中复发率(0.8%vs.6.9%,P=0.03);2组30 d内任何卒中或死亡的发生率无显著差异(7.6%vs. 5.3%,P=0.46)。WEAVE/WOVEN、Aire/Wire-China研究中1年ISR发生率分别为17.6%和27.6%,1年任何卒中的复发率分别为8.5%和8.1%,与这些结果相比,天坛医院NOVA支架的研究显示DES可进一步降低颅内裸支架系统置入后的ISR和卒中复发率。
现有的研究提示药物洗脱球囊/支架治疗sICAS的技术成功率为93.5%~100%,30 d卒中/死亡的发生率为3%~7.6%,1年卒中复发/死亡的发生率为0~11%,再狭窄的发生率为0~27.3%(平均8.96%)。
迄今,神经介入领域中全球已经上市的DES产品有3种(表3),均使用以雷帕霉素为基础的药物涂层。雷帕霉素因抑制DNA复制的G1~S期,所以受到抑制的平滑肌细胞在药物作用消除后仍能完成正常的生物学功能[99]。基础研究表明,雷帕霉素能够增强血脑屏障的完整性,使其渗出降低,从而改善水肿相关的不良反应;另外还能作用于神经胶质细胞、血管内皮细胞和平滑肌细胞,改善血管灌注,减少脑梗死的面积[99-100]。

表3 国内外已上市的脑血管药物涂层支架
支架置入后血管内皮功能的恢复是确定置入术有效性和安全性的关键,而涂层药物精准释放及其载药聚合物层及时降解是解决内皮愈合的突破口。以2021年国家药品监督管理局批准的NOVA支架为例,基于电子接枝技术(通过电化学反应将2种不同种类的物质,如聚合物与金属,在分子水平结合在一起的技术)的载药涂层使药物支架置入后达到最佳的药物释放,保证动脉壁的药物浓度同平滑肌细胞增殖时程相匹配,精准抑制平滑肌细胞的过度增殖;另一方面,30 d后药物零残留可减少药物对内皮细胞的抑制,生物可降解涂层在6~8周内降解吸收,其最终代谢产物为CO2、H2O等小分子物质,可通过新陈代谢作用排出体外[101]。
对本部分研究的汇总见附表4。

附表4 药物涂层球囊/支架治疗ICAS的相关研究
推荐意见:
(1)药物涂层支架治疗sICAS可能是解决sICAS再狭窄和卒中复发问题的新的治疗手段。可根据患者的具体病变及路径特点选择(B-R级证据,中等推荐)。
(2)药物涂层球囊治疗sICAS可能是解决sICAS再狭窄和卒中复发问题的新的治疗手段。可根据患者的具体病变及路径特点选择,还需要更高级别证据证实(C-EO级证据,弱推荐)。
(3)对于症状性再狭窄患者,推荐优先选用颅内专用治疗sICAS的药物涂层支架(C-EO级证据,弱推荐)。
3 再狭窄及预防
与冠状动脉狭窄的血管内治疗一样,球囊扩张/支架置入治疗后血管重度再狭窄是sICAS患者卒中复发及预后不良的独立危险因素[102-103]。再狭窄的定义为支架内或相邻范围(5 mm内)狭窄率>50%,绝对管腔丢失>20%[104-106],其一直是困扰球囊扩张/支架置入治疗动脉狭窄的瓶颈问题,尤其是颅内血管重度再狭窄[支架内或相邻范围(5 mm内)狭窄率>70%,或较基线直径狭窄率增加>30%]与脑缺血症状及卒中复发相关[51,107]。在心血管领域,较早就采用药物涂层球囊/支架来降低再狭窄的发生率,目前在脑血管领域也开始有这样的研究和临床应用[98]。sICAS血管内治疗后,症状性再狭窄与卒中复发关系密切,所以对术后再狭窄的随访和治疗也是sICAS血管内治疗的重点之一。
球囊扩张/支架置入后再狭窄的准确机制尚不清楚,内膜增生是再狭窄的主要原因,可能与扩张创伤、支架置入后血栓形成以及血管壁对支架的炎症反应有关[108],其他的再狭窄危险因素还包括病变长度、治疗后的残余狭窄程度、患者年龄等[106,109]。不同研究中sICAS的治疗方式、随访时间及随访的影像设备不同,再狭窄发生率的报道结果有很大的差异。
2004年,1项早期sICAS支架置入的研究发现球扩式支架有较高的技术成功率(95%)及较低的围手术期卒中发生率(1个月内6.6%),但6个月ISR的发生率高达35%[110]。
2007年,Levy等[105]报道了应用Wingspan支架治疗78例(84个病变)sICAS患者的研究,在1.5~15.5个月的随访中,总体的ISR发生率为29.7%(25/84),症状性ISR为12%。
2008年,中国1项纳入了300例sICAS患者的多中心支架置入登记研究显示,12个月ISR(MRA/CTA证实狭窄≥50%)发生率为27.6%;球扩式支架与自膨式支架12个月ISR的发生率无显著差异(27.7%vs. 27.5%,P=1.000);DSA证实的≥70%的ISR发生率为18.4%;78.9%的ISR是无症状性ISR[111]。
2009年,1项系统分析纳入了31项研究,1134例支架置入治疗的sICAS患者[112],在中位随访时间(6个月)内,ISR的发生率为14.4%,其中症状性ISR占32.7%。自膨式支架与球扩式支架相比,ISR发生率显著升高(17.4%vs. 13.8%,P<0.001),但两者症状性ISR的发生率没有显著差异(41.6%vs. 12.5%,P=0.080)。
2013年,Shin等[45]报道了对内科治疗无效的77例sICAS患者行支架置入的单中心回顾性研究。在中位数为1年的影像随访期间,ISR的发生率为24.6%,其中17.6%为症状性ISR。快速球囊扩张及病变长度过长是支架置入后ISR的独立危险因素。同年,Jin等[113]报道了支架置入治疗sICAS的单中心前瞻性研究,其中1年ISR发生率为33.7%,症状性ISR为21.1%。研究同时还发现ISR组缺血性卒中的发生率显著高于无ISR组,提示ISR是支架置入后责任血管卒中复发的高危因素(21.1%vs. 8.5%,HR2.94,95%CI1.37~6.30,P=0.005)。
2017年,对SAMMPRIS研究中支架置入组的ISR发生情况再分析发现,未发生围手术期并发症的183例患者中,在35个月的中位随访期间,有27例发生了靶血管供血区的症状性梗死,16例出现了TIA。27例症状性梗死中有24例进行了充分影像学评估,ISR的发生率高达66.7%;16例TIA患者中有10例进行了充分影像学评估,ISR的发生率高达80%。1年、2年和3年随访ISR的发生率分别是9.6%、11.3%和14%[104]。研究结果提示,在随访期间,至少每7例患者中就有1例会出现症状性ISR,症状性ISR主要发生在支架置入后第1年,是非围手术期缺血性卒中发生的重要原因。
2021年,针对WOV EN研究的1年影像(CTA/MAR/DSA)随访发现,ISR的发生率为17.6%[51]。Haidegger等[114]报道了115例sICAS患者支架置入治疗的单中心回顾性研究的结果,在11个月的平均随访期中,ISR的发生率33%,其中症状性ISR占11%。为找出预测ISR的生物学标志物,研究者分析了与动脉粥样硬化性硬化发展密切相关的CRP、中性粒细胞/淋巴细胞比例、血小板/淋巴细胞比例及平均血小板体积等指标,结果未发现这些生物学标志物与ISR的关联。Guo等[115]的1项来自中国的多中心回顾性研究发现,在平均12.7个月的影像学(CTA)随访中,≥50%的ISR发生率为24.7%,进一步分析发现hs-CRP是ISR的生物学标志物,回归分析发现支架长度、球扩式支架及局部麻醉是ISR的危险因素。Jia等[116]报道了132例sICAS患者支架置入治疗的单中心前瞻性研究,结果表明随访2年的ISR发生率为8.16%。
sICAS患者无论是接受支架置入治疗还是单纯球囊扩张治疗,治疗后6~12个月血管再狭窄的发生率在8.16%~35%,在卒中复发的患者中,再狭窄的发生率更高。再狭窄是导致卒中复发及预后不良的重要危险因素,应重视sICAS血管成形治疗后再狭窄的防治及监测。
对本部分研究的汇总见附表5。

附表5 血管内治疗ICAS后再狭窄相关研究
推荐意见:
无症状再狭窄再发卒中风险相对较低,原则上推荐药物治疗下随访;对药物治疗无效的症状性重度再狭窄患者可以考虑通过血管介入的方式进行治疗(C-EO级证据,中等推荐)。
4 血管内治疗的术前评估
2012年,美国食品和药品管理局更新了Wingspan支架系统在ICAS患者中的适用范围,建议更严格地筛选患者,所以血管内治疗作为sICAS的治疗手段之一,应该在患者中选择性开展,只有通过严格的术前评估筛选的患者才能够通过手术获益。术前评估包括:患者临床特点,手术时机,缺血性卒中病因分型,血管情况(狭窄率、位置、长度、形态、成角、斑块性质、钙化分级、血流分级、路径、远端导丝着陆区、病变与分支关系、合并其他血管病变等),脑侧支循环情况等。
4.1 手术时机
与症状性颈动脉狭窄患者相似,导致缺血事件的严重sICAS短期内再发相同血管供血区域缺血事件的风险较高。但亚急性期责任血管斑块不稳定,术中操作易发生脱落导致远端栓塞等并发症。
1项有关ICAS血管内治疗时机的研究共纳入115例患者,41例患者接受早期支架治疗(发病2周内),74例患者接受晚期支架治疗(发病2周后),其中早期组有8例,晚期组有4例的再狭窄程度≥50%(P=0.018)。早期组有2例再狭窄程度≥70%,晚期组有3例再狭窄程度≥70%,差异无统计学意义。早期组中缺血性卒中、TIA、出血性卒中和死亡的总发生率高于晚期组(22.0%vs. 8.1%,P=0.035),单独缺血性卒中的复发率也高于晚期组(5/41vs.2/74,P=0.041)。两组TIA的发生率(1/41vs.3/74,P=0.651)、出血性卒中的发生率(1/41vs. 0/74,P=0.177)和死亡率(2/41vs. 1/74,P=0.256)差异无统计学意义[117]。国内多项多中心、前瞻性研究也提示最近1次缺血性卒中距离血管内干预的时间间隔应>3周,但最佳时机仍未确定[118]。综上,ICAS患者在急性缺血性卒中发生至少2周后行血管内治疗是比较合理的。
4.2 侧支循环评估
WASID研究的亚组分析提示脑侧支循环状态可能影响sICAS患者的卒中复发风险。对于动脉狭窄率在70%~99%的sICAS患者,具有良好的脑侧支循环的患者与较差和差的侧支循环患者相比,卒中再发风险较低,提示脑侧支循环的评估是筛选适合血管内治疗患者的重要依据之一[119]。据此推测,经结构影像学和功能影像学方法评估脑侧支循环,并证实为血流动力学障碍引起的缺血症状发作的患者,可能更适合进行血管内治疗。最近的1项多中心、前瞻性研究表明,远端灌注或血流受损的sICAS患者在药物治疗后卒中复发的风险更高。椎基底动脉血流评估及TIA和卒中风险(vertebrobasilar flow evaluation and risk of transient ischemic attack and stroke,VERITAS)研究表明,在症状性椎基底动脉狭窄的患者中,远端血流受损是卒中复发的1个强有力的预测因子(HR11.55,95%CI1.88~71.00,P=0.008)[120]。另外1项单中心回顾性研究提示,对于波及颅内段颈内动脉或MCA近端的sICAS病变,最大达峰时间(Tmax)>6 s的延迟灌注区域≥15 mL的患者与<15 mL或无延迟灌注的患者相比,其卒中复发率更高[121]。国内的1项多中心研究纳入了167例侧支循环不良的ICAS患者,结果提示灌注不足或侧支循环不良的患者可能比那些来自穿支闭塞、动脉到动脉栓塞或隐源性卒中的患者从基于支架的再通中获益更多。该研究对侧支循环不良的定义为:与对侧半球相比,狭窄动脉区域的脑血流量下降了40%以上,或者美国介入和治疗神经放射学会/介入放射学会(American Society of Interventional and Therapeutic Neuroradiology/Society of Interventional Radiology,ASITN/SIR)侧支血流量评分<3分[122]。同样,1项多中心研究纳入了300例侧支循环不良且随访超过1年的ICAS患者,结果提示低灌注或侧支循环不良的患者可能比其他发病机制(如穿支闭塞)的患者从血管内治疗中受益更多,该研究评估侧支循环不良的标准为术前2周内影像学检查确定责任动脉区域血流动力学障碍,采用以下任一标准:①CTP显示前循环病变较对侧脑血流灌注下降≥30%,后循环病变较前循环灌注下降≥30%;②基于DSA的ASITN/SIR评分<3分;③MRI显示血流动力学缺血性病变;④单光子发射CT显示低灌注;⑤TCD显示责任血管的收缩期峰值速度≥200 cm/s,且可以探测到的侧支血管少于1支[111]。综上,血管内治疗的术前评估侧支循环非常重要的,侧支循环不良的ICAS患者可能会从血管内治疗中获益更多。
推荐意见:
(1)手术时机:ICAS患者在急性缺血性卒中发生至少2周后行血管内治疗可能是安全的(进展性卒中除外)(C-LD级证据,中等推荐)。
(2)侧支循环:对ICAS的患者,进行术前的侧支循环评价对筛选合适的手术患者是有益的,术前影像学评估侧支循环较差的患者可能更适合血管内治疗(C-LD级证据,中等推荐)。
(3)针对ICAS患者的病因、狭窄部位的形态学分析选择个体化血管内治疗会有更好的获益(C-EO级证据,中等推荐)。
5 围手术期管理
围手术期血压管理:多项多中心、前瞻性研究均建议将患者围手术期收缩压控制在100~120 mmHg,长期血压控制在收缩压<140 mmHg(糖尿病患者<130 mmHg)[87,92,114]。
急性、亚急性血栓形成是ICAS血管内治疗围手术期常见的并发症,并与抗栓药物的使用情况密切相关[123]。1项单中心研究提示预防性输注血小板膜糖蛋白Ⅱb/Ⅲa受体拮抗剂可以降低术中急性支架内血栓形成(acute intraprocedural stent thrombosis,AIST)的发生率,且不会增加围手术期脑出血的风险和30 d的总死亡率,然而在减少围手术期缺血事件方面没有优势。该研究共选择分析236例匹配患者,其中替罗非班组和非替罗非班组各118例。接受替罗非班治疗的患者仅有1例发生AIST,而非替罗非班组AIST有8例。替罗非班组AIST的发生率显著低于非替罗非班组(0.8%vs. 6.8%,P=0.039)。2组围手术期缺血事件(8.5%vs. 5.1%,P=0.424)、颅内出血(4.2%vs. 0.8%,P=0.219)和30 d总死亡率(3.4%vs. 0,P=0.125)差异无统计学意义[124]。另1项单中心研究提示静脉滴注血小板糖蛋白膜Ⅱb/Ⅲa受体拮抗剂对ICAS支架置入期间的AIST是有效和安全的,且不增加出血并发症和死亡发生率。该研究共纳入194例患者,其中12例发生AIST,对于AIST的患者给予血小板糖蛋白膜Ⅱb/Ⅲa受体拮抗剂抢救治疗,所有患者均实现再通,无出血并发症或死亡[125]。因此,血小板膜糖蛋白Ⅱb/Ⅲa受体拮抗剂预防性应用于ICAS患者血管内治疗的围手术期可能是获益的,但仍需多中心、前瞻性RCT进行临床验证。
推荐意见:
(1)围手术期血压管理及抗血小板、抗凝治疗应用未更新,同2018版。
(2)围手术期麻醉方式、并发症管理未更新,同2018版。
(3)围手术期应用血小板膜糖蛋白Ⅱb/Ⅲa受体拮抗剂,在减少血栓并发症,尤其预防术中急性支架内血栓形成方面可能是获益的,但仍需高级别临床研究证据来证实(C-LD级证据,弱推荐)。
执笔作者:
孙 瑄 首都医科大学附属北京天坛医院
杨 明 首都医科大学附属北京天坛医院
余泽权 首都医科大学附属北京天坛医院
李康悦 首都医科大学附属北京天坛医院
齐中奇 首都医科大学附属北京天坛医院
邓一鸣 首都医科大学附属北京天坛医院
陈 林 陆军军医大学附属西南医院
李光建 陆军军医大学附属西南医院
缪中荣 首都医科大学附属北京天坛医院
陈康宁 陆军军医大学附属西南医院
参与讨论专家(按姓名拼音排序):
蔡艺灵 中国人民解放军战略支援部队特色医学中心
曹亦宾 唐山市工人医院
陈康宁 陆军军医大学附属西南医院
董可辉 首都医科大学附属北京天坛医院
高 峰 首都医科大学附属北京天坛医院
高连波 中国医科大学附属第四医院
高小平 湖南省人民医院
耿晓坤 首都医科大学附属北京潞河医院
郭富强 四川省人民医院
洪 波 海军军医大学第一附属医院(上海长海医院)
姬云翔 广州医科大学附属第二医院
李天晓 河南省人民医院
刘建民 海军军医大学第一附属医院(上海长海医院)
刘丽萍 首都医科大学附属北京天坛医院
刘亚杰 南方医科大学深圳医院
马 宁 首都医科大学附属北京天坛医院
莫大鹏 首都医科大学附属北京天坛医院
缪中荣 首都医科大学附属北京天坛医院
史怀璋 哈尔滨医科大学附属第一医院
史树贵 重庆北部宽仁医院(松山医院)
帅 杰 陆军军医大学新桥医院
孙 瑄 首都医科大学附属北京天坛医院
汪 阳 首都医科大学附属北京朝阳医院
王大明 北京医院
王守春 吉林大学第一医院
王伊龙 首都医科大学附属北京天坛医院
王拥军 首都医科大学附属北京天坛医院
吴 伟 山东大学齐鲁医院
吴云虎 安徽中医药大学第一附属医院
徐安定 暨南大学附属第一医院(广州华侨医院)
徐 运 南京大学医学院附属鼓楼医院
于加省 华中科技大学同济医学院附属同济医院
曾进胜 中山大学附属第一医院
张晓龙 复旦大学附属华山医院
张 勇 青岛大学附属医院
赵振伟 空军军医大学唐都医院
郑洪波 四川大学华西医院
朱良付 河南省人民医院
朱其义 临沂市人民医院

