Tim-4对kupffer细胞分泌Th1/Th2类细胞因子及抗原呈递功能的影响
陶劲 何益平 赵常春 樊艺
(重庆市中医院 1肿瘤科,重庆 400021;2重症医学科)
在肝切除、肝移植、肝创伤修复等临床手术中,肝门阻断引起肝脏的缺血再灌注损伤几乎是不可避免的〔1〕,会产生急性炎症反应进而引起各种病理生理问题,严重威胁患者身心健康〔2〕。Kupffer细胞(KCs)是定居于肝血窦内的巨噬细胞,具有吞噬功能、处理和传递抗原、调节机体免疫应答等作用〔3〕,其在调节肝脏免疫中起重要作用〔4〕。研究发现,KCs参与介导肝脏再灌注损伤,激活的KCs即可通过高表达核转录因子(NF)-κB及表面共刺激分子MHC-Ⅱ、CD80、CD86等诱导分泌炎症因子及大量的氧自由基、Th1类细胞因子,引起急性炎症反应及肝脏缺血再灌注损伤〔5〕,又可通过上调细胞相关自杀因子(FasL)表达,诱导T细胞凋亡及促进Th2分泌细胞因子,进而通过抑制免疫反应负向调控肝脏缺血再灌注损伤〔6〕。T细胞免疫球蛋白黏蛋白(Tim)-4可在KCs表达,在调控机体免疫功能中发挥着重要作用〔7〕。Tim-4与Tim-1相结合,可促进T淋巴细胞向Th2细胞分化,诱导Th1/Th2免疫平衡向Th2偏移,参与哮喘、过敏及自身免疫性疾病的发生、发展过程〔8〕,因此推测Tim-4参与调解KCs的免疫功能。本研究通过过表达Tim-4、Tim-4-shRNAs质粒及Tim-4单克隆抗体处理KCs,探讨Tim-4对KCs分泌Th1/Th2类细胞因子及抗原呈递功能的影响。
1 材料与方法
1.1实验动物 SPF级雄性BALB/c小鼠3只,8~10周龄,体重16~22 g,许可证号:SCXK(川)2017-0041,成都中医药大学实验动物研究中心提供。在自然光照,清洁、安静的环境下饲养,定时更换饲料、饮水、清理鼠笼。
1.2主要试剂与仪器 TIM-4、GAPDH引物由上海生工生物工程股份有限公司合成;Percoll原液(批号SY0531-CRI)购自北京百奥莱博科技有限公司;小鼠Tim-4Tim-4-shRNAs质粒(批号ABIN3540482)、Tim-4过表达质粒(批号ABIN3336325)购自Genemics-online公司;脂多糖(LPS,批号L8880)、RPMI1640培养基(批号31800)、胎牛血清(FBS,批号11011-8611)、磷酸盐缓冲液(PBS,批号P1022)、胰蛋白酶-乙二胺四乙酸(EDTA)消化液(批号T1300)、100×青链霉素混合液(批号P1400)、凝血酶(批号T8021)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒(批号P1200-50T)均购自Solarbio公司;CD80-PE(批号130-102-613)、CD86-PE(批号130-102-604)、CD40-异硫氰酸荧光素(FITC,批号130-102-533)购自上海恒斐生物科技有限公司;MCH-Ⅱ-FITC(批号130-081-601)购自天津泰泽兴业生物科技有限公司;Opti-MEM培养基(批号51985091)、LipofectamineTM2000(批号11668019)购自美国Invitrogen公司;卵清蛋白(批号9006-59-1)购自Sigma公司;T细胞分离用尼龙毛柱(批号143-07041)购自上海新睿生物科技有限公司;RNAiso Plus(批号9108)、逆转录试剂盒(批号RR037Q/A/B)、荧光定量聚合酶链反应(PCR)试剂盒(批号639519)均购自TaKaRa公司;兔源GAPDH一抗(批号ab181602)、兔源Tim-4一抗(批号ab47637)、兔源CD68一抗(批号ab125212)、羊抗兔二抗(批号ab150077)、肿瘤坏死因子(TNF)-α酶联免疫吸附试验(ELISA)试剂盒(批号ab208348)、白细胞介素(IL)-1β ELISA试剂盒(批号ab100704)、IFN-γ ELISA试剂盒(批号ab252352)、IL-10 ELISA试剂盒(批号ab108870)均购自Abcam公司;亲和素-生物素-过氧化物酶复合物(ABC)免疫组化试剂盒(批号PK-6100)购自美国Vector Laboratories公司;膜联蛋白V(AnnexinV)-FITC/碘化丙啶(PI)凋亡检测试剂盒(批号V13242)购自美国Cell Singaling Technology公司;CKK-8试剂盒(批号C0037)、RIPA裂解液(批号P0013K)、二喹啉甲酸(BCA)试剂盒(批号P0011)购自碧云天生物技术研究所。Eclipse E200实验室教学生物显微镜购自日本尼康公司;小型垂直电泳系统、Elx800酶标仪购自美国Bio-Rad公司;CFX96 Touch Deep Well荧光定量PCR仪购自美国Bio-Rad公司;3900型高通量DNA合成仪购自美国应用生物系统公司;CytoFLEX流式细胞仪购自美国贝克曼库尔特公司;Centrifuge 5424R低温高速离心机购自德国 Eppendorf 股份公司;XB-70制冰机、恒温水浴锅,购自上海析达仪器有限公司。
1.3完全培养基的配制及KCs的分离、培养、鉴定 完全培养基:在RPMI1640基础培养基中加入10%胎牛血清、100 U/ml的青霉素、链霉素混合液混匀。参照文献〔9〕,采用乙醚吸入麻醉BALB/c小鼠,固定于鼠板上,75%酒精喷洒消毒,在无菌操作台中逐层打开腹腔,暴露下腔静脉、门静脉,用10 ml注射器吸入37℃预热的D-Hank液,穿刺门静脉近端,剪断下腔静脉放血,缓慢灌注肝脏,待肝脏颜色从红色变成黄白色,改用5 ml 37℃预热的Ⅳ型胶原酶灌注,然后无菌取得肝脏,以PBS漂洗后剪碎,转入50 ml离心管中加入10 ml Ⅳ型胶原酶,37℃水浴中孵育消化30 min,200目筛网过滤得细胞悬液,加入PBS至50 ml,4℃离心,300 g,5 min,重复4次,所得细胞沉淀备用。以PBS稀释Percoll原液得到75%、25%浓度的Percoll液,75%浓度的在底层,25%浓度的在中层,顶层缓慢加入细胞悬液2 ml,4℃离心,500 r/min,15 min,两层Percoll液层面之间出现一层白色絮状物,吸管小心吸出,置于另一离心管,加入PBS,4℃离心,300 r/min,5 min,重复1次,取细胞沉淀,加入完全培养基重悬后备用。取上述细胞液接种于24孔板,置于37℃、5%CO2细胞恒温培养箱中培养,待细胞长至85%左右时,弃去培养液,PBS漂洗,6个孔细胞以4%多聚甲醛固定,加入1%过氧化氢,室温孵育5 min,加入1.5%血清,室温封闭2 h,加入CD68一抗,4℃孵育过夜,然后使用ABC免疫组化试剂盒进行免疫组化染色,操作步骤按照说明书,在光学显微镜下观察染色情况并拍照。配制0.4%台盼蓝染液,加入6个培养孔,对细胞进行染色,死亡细胞可被染为蓝色,活细胞拒绝蓝染,以此观察判断细胞活性。
1.4细胞分组1.3中的细胞液接种至12孔板,置于37℃、5%CO2细胞恒温培养箱中培养过夜后,随机分为对照组、Tim-4过表达组、Tim-4-shRNAs组、Tim-4单克隆抗体组。Tim-4过表达组、Tim-4-shRNAs组细胞各取50 μl Opti-MEM减血清培养基置于2个Ep管中,分别向其中加入1 μl LipofectamineTM2000、质粒(Tim-4过表达或Tim-4-shRNAs质粒)轻轻混匀,静置5 min后将2个Ep管中溶液小心混匀,继续静置20 min,最后将其加入培养板中处理细胞,6 h后将Opti-MEM培养基换为细胞完全培养基,以100 ng/ml LPS活化〔10〕,在24 h后收集各组细胞及培养基(质粒浓度及处理时间参照说明书及前期预实验)。Tim-4单克隆抗体组细胞根据抗体说明书的推荐及前期预实验,以终浓度2.5 μg/ml,的单克隆抗体处理细胞,以100 ng/ml LPS活化,24 h后收集各组细胞及培养基。
1.5qRT-PCR及Western印迹检测细胞中Tim-4表达 取1.4中收集的细胞,以RNAiso Plus提取总RNA,采用逆转录试剂盒、荧光定量PCR试剂盒将总RNA逆转录为cDNA,在荧光PCR仪中进行荧光定量PCR,操作步骤,反应体系的配制,反应条件的设定严格按照各个试剂盒的说明书进行,使用GAPDH基因作为内参,采用2-ΔΔCt算法分析数据,qRT-PCR引物序列为:GAPDH:正义链5′-TGGAATCCTGTGGCATCCATGAAAC-3′,反义链5′-TAAAACGCAGCTCAGTAACAGTCC-3′;Tim-4正义链5′-CTACAGACATAGCCGTACTCA-3′,反义链5′-GGATCCGAGAGTGAAGATCCCGTC-3′。取1.4中收集的细胞,加入RIPA裂解液提取总蛋白,采用BCA试剂盒测定蛋白浓度,操作步骤严格按照各自说明书进行,各组蛋白根据测定结果调整浓度使之相同,使用SDS-PAGE试剂盒配制浓缩、分离胶,配制方法参照说明书,取20 μg蛋白进行电泳分离,得到的目的蛋白转移至硝酸纤维膜上,5%脱脂牛奶室温封闭2 h,兔源GAPDH、Tim-4一抗4℃孵育过夜,TBST漂洗3次,羊抗兔二抗室温孵育2 h,以电化学发光(ECL)显色,使用BioRad系统观察拍摄条带,以Quantity one软件分析结果。
1.6流式细胞仪检测各组KCs表面共刺激分子MHC-Ⅱ、CD80、CD86、CD40表达水平 取1.4中收集的细胞,加入培养基吹打均匀制成单细胞悬液,计数后调整密度为1×106个/ml,吸取1 ml细胞液置于EP管中,1 000 r/min离心5 min,细胞沉淀加入300 ml缓冲液及抗体CD80-PE、CD86-PE、CD40-FITC、MCH-Ⅱ-FITC轻轻吹打混匀,常温避光孵育20 min,1 000 r/min离心5 min,然后加入200 ml缓冲液混匀,使用流式细胞仪上机检测。
1.7ELISA检测KCs分泌Th1/Th2类细胞因子水平 取1.4中收集的各组细胞培养液,使用ELISA检测试剂盒检测细胞因子水平,操作步骤参照说明书。
1.8混合培养KCs及T细胞后T细胞增殖、凋亡的检测 参照文献〔11〕,取BALB/c小鼠皮下注入卵清蛋白免疫2次,吸入乙醚麻醉,解剖取出脾脏,剪碎后,加入胰酶消化,过滤后得脾细胞悬液,取小鼠淋巴细胞分离液3 ml置于10 ml离心管中,向其中缓慢加入脾细胞悬液3 ml,2 000 r/min,4℃离心20 min,吸管轻轻吸取分离液与细胞悬液之间的一层白色絮状物,置于另一离心管中以PBS洗涤细胞2次,4℃离心,1 500 r/min,5 min;加入完全培养基混匀得细胞悬液。根据文献的方法,细胞悬液使用尼龙毛柱过滤后可得到纯化的T细胞。纯化的T细胞加入培养基吹打均匀制成单细胞悬液,计数后调整密度为5×105个/ml,将其与1.4中收集的各组KCs以10∶1的比例混合接种在96孔培养板中,培养72 h后,加入CCK-8, 2 h后使用全自动酶标仪中测定450 nm波长下各孔吸光度(OD),计算各组T细胞的相对增殖率。相对增殖率(%)=处理组OD值/对照组OD值×100%。将5×105个/ml的T细胞与1.4中收集的各组KCs以10∶1的比例〔12〕混合接种在12孔培养板中,培养72 h后,收集悬浮的T细胞,使用AnnexinV-FITC/PI凋亡检测试剂盒,在流式细胞仪中检测T细胞凋亡情况,操作步骤参照试剂盒说明书。
1.9统计学分析 采用SPSS20.0软件进行t检验。
2 结 果
2.1KCs鉴定及活性检测 KCs CD68强表达,免疫组化染色呈现深棕色;KCs呈贴壁生长,形态完整,轮廓清晰,拒绝台盼蓝染色,活性高,见图1。

图1 KCs鉴定及活性检测(×200)
2.2各组KCs Tim-4 mRNA表达 与对照组相比,过表达Tim-4组细胞Tim-4 mRNA及蛋白表达明显升高(P<0.05),Tim-4-shRNAs组细胞Tim-4 mRNA及蛋白表达明显降低(P<0.05),Tim-4单克隆抗体组细胞Tim-4表达无明显变化(P>0.05),见图2、表1。

1~4:对照组,过表达Tim-4组,Tim-4-shRNAs组,Tim-4单克隆抗体组图2 各组Tim-4蛋白表达
2.3各组KCs分泌Th1/Th2类细胞因子水平 与对照组相比,过表达Tim-4组细胞分泌Th1类细胞因子TNF-α、IL-1β、IFN-γ水平明显降低,分泌Th2类细胞因子IL-10水平明显升高(P<0.05);Tim-4-shRNAs组、Tim-4单克隆抗体组细胞分泌Th1类细胞因子TNF-α、IL-1β、IFN-γ水平明显升高,分泌Th2类细胞因子IL-10水平明显降低(P<0.05),见表1。
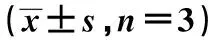
表1 各组KCs Tim-4 mRNA及蛋白表达和KCs分泌Th1/Th2类细胞因子水平比较
2.4各组KCs表面共刺激分子MHC-Ⅱ、CD80、CD86、CD40表达水平 与对照组相比,过表达Tim-4组细胞表面共刺激分子MHC-Ⅱ、CD80、CD86、CD40表达水平明显降低(P<0.05);Tim-4-shRNAs组、Tim-4单克隆抗体组细胞表面共刺激分子MHC-Ⅱ、CD80、CD86、CD40表达水平明显升高(P<0.05),见图3、表2。
2.5各组KCs混合T细胞培养后T细胞增殖、凋亡比较 与对照组相比,过表达Tim-4组T细胞相对增殖率明显降低,凋亡率明显升高(P<0.05);Tim-4-shRNAs组、Tim-4单克隆抗体组T细胞相对增殖率明显升高,凋亡率明显降低(P<0.05),见表2、图4。
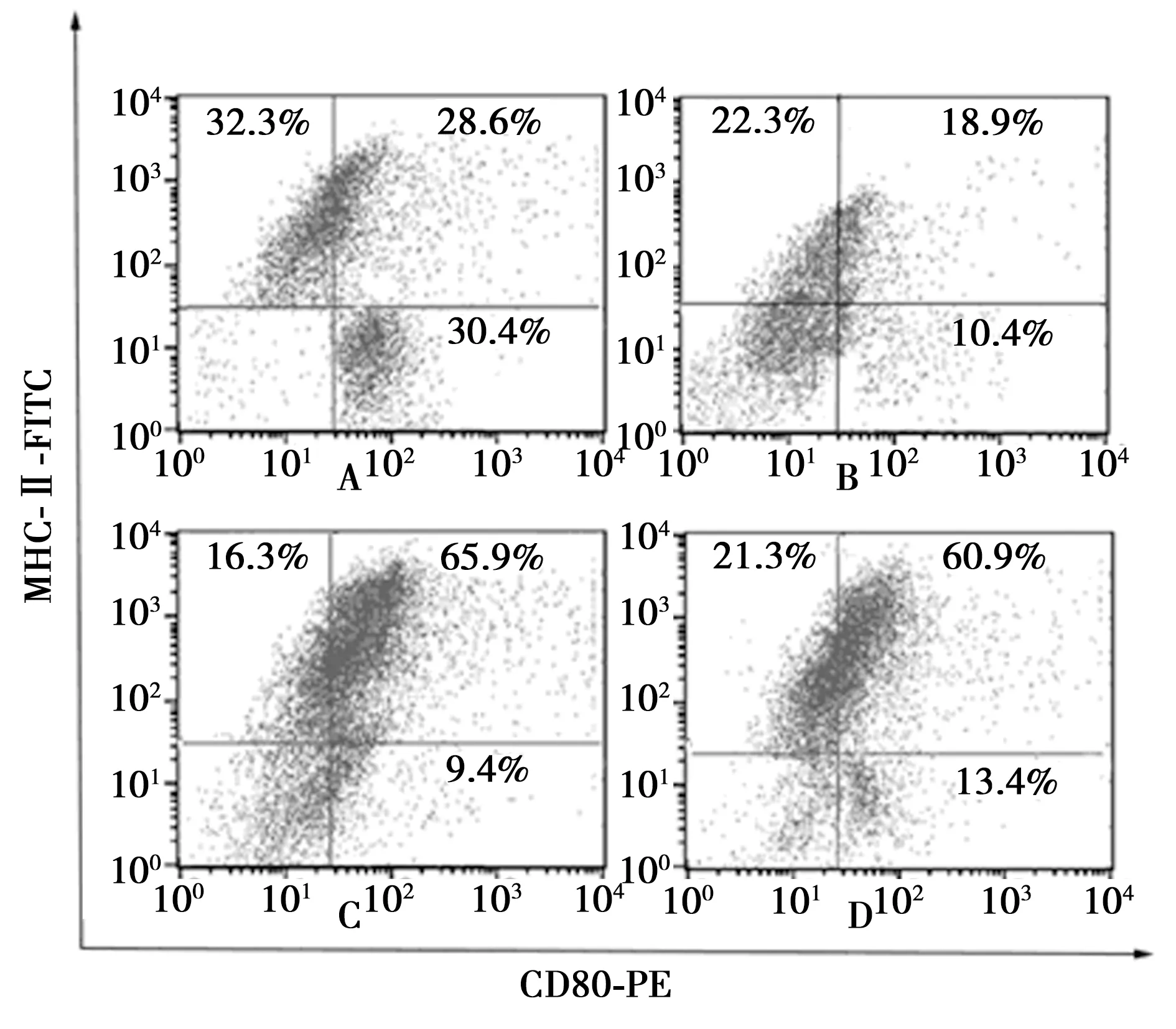
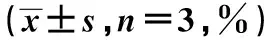
表2 各组KCs表面共刺激分子MHC-Ⅱ、CD80、CD40、CD86表达和KCs混合T细胞培养后T细胞相对增殖率与凋亡率比较

图4 各组KCs混合T细胞培养后T细胞凋亡情况
3 讨 论
缺血再灌注损伤是导致临床各种肝脏手术后肝功能受损甚至肝衰竭的重要原因〔13〕。炎症因子过度表达、炎症细胞浸润引起炎症反应导致细胞凋亡是肝脏缺血再灌注损伤发生的中心环节,KCs在其中发挥关键作用〔14〕。KCs可改变促炎及抑炎细胞因子分泌水平、调控Th1/Th2平衡、介导凋亡细胞的吞噬清除等过程〔15〕。KCs是体内最大的抗原提呈细胞群,重要功能是抗原提呈及诱导初始T细胞活化、亚群分化及炎性细胞因子分泌等〔16〕,将LPS活化后的KCs与T细胞共培养,通过检测T细胞的增殖、凋亡情况可判断KCs抗原提呈能力。Tim-4选择性表达于抗原提呈细胞群中,比如髓系来源的树突状细胞、巨噬细胞等,在机体免疫功能调控中发挥重要作用,Tim-4是Tim-1的天然配体,Tim-1优先表达于 Th2 细胞表面,两者相结合,可激活Th2细胞,使之分泌IL-10抑炎因子,减轻炎症反应〔17〕。Tim-4还可与凋亡细胞表面分子(PtdSer)结合,促使凋亡抗原特异性T细胞及时有效清除凋亡细胞〔18〕,并可促进巨噬细胞分泌免疫抑制因子,诱导Th17/Treg细胞向Treg偏移,从而发挥免疫负调控效应〔19〕,参照以上研究,可推测Tim-4可调控KCs分泌Th1/Th2类细胞因子及其抗原呈递功能。本研究结果表示研究中分离得到的KCs纯度高,活性好,为后续研究提供了坚实基础。
本文后续研究结果表明,上调Tim-4可促使活化的KCs分泌IL-10,抑制其分泌TNF-α、IL-1β、IFN-γ,抑制其表面共刺激分子MHC-Ⅱ、CD80、CD86、CD40表达,活化的KCs与T细胞共培养后,上调Tim-4可抑制T细胞增殖,促使其凋亡。IL-10为Th2类抑炎因子,TNF-α、IL-1β、IFN-γ为Th1类促炎因子〔20〕,本文研究结果揭示Tim可诱导活化的KCs因子分泌谱向Th2类细胞因子偏移,减轻炎症反应,降低其抗原呈递功能,对免疫起负调控作用。下调Tim-4可逆转上述作用,为临床预防及治疗肝脏缺血再灌注损伤提供了新思路,但本文对Tim-4调控KCs抗原提呈功能的研究仅限于现象观察,其详细分子作用机制尚有待进一步探索。

