榨菜BjuFIP蛋白纯化及非生物胁迫下基因表达模式分析
颜 论, 陈国建, 陈明飞, 游经番, 彭姣姣, 程春红
(长江师范学院生命科学与技术学院,重庆 408100)
泛素介导的蛋白降解系统是真核生物中广泛存在的调节系统,具有蛋白降解效率高、专一性和选择性强等特点,参与细胞周期调控、细胞分化、细胞程序性死亡和生物体对逆境胁迫的应答等[1-2].泛素蛋白酶体降解系统包含4个组分:泛素分子(ubiquitin, Ub)、泛素激活酶 E1(activating enzyme, E1)、泛素结合酶 E2(conjugating enzyme, E2)和泛素连接酶 E3(ligating enzyme, E3)[3-4].其中,SCF型的E3泛素连接酶是多亚基泛素连接酶中种类最多的一类,根据它们组分中的3个亚基即SKP1(s-phase kinase-associated protein 1)、CUL1(cullin 1 scaffold)和F-box蛋白来命名[5].其中,CUL1蛋白是复合体中的桥梁蛋白;F-box蛋白是复合体中的底物受体,负责特异性的识别靶蛋白;SKP1蛋白则负责将桥梁蛋白CUL1和受体蛋白F-box连接在一起,形成一个复合体发挥功能[6-7].F-box蛋白通过其N端的F-box domain和SKP1蛋白发生相互作用,而其C端的WD40基序或者富含亮氨酸重复区域LRR(Leucine-rich repeat)作为底物识别区域,特异性地靶作用底物蛋白.
SCF型E3泛素连接酶在植物逆境胁迫过程中具有重要作用.COI1编码一个F-box蛋白,是茉莉酸的受体,能够形成SCFCOI1复合体参与到茉莉酸信号通路中,调控茉莉酸介导的植物的发育和防御反应[8].F-box蛋白作为SCF型E3泛素连接酶复合体中的关键组分,在植物生长发育、激素信号传导、花器官发育和自交不亲和反应中发挥重要的调节作用.研究表明[9],F-box蛋白AtPP2-B11可形成SCFAtPP2-B11复合体,通过促进蛋白激酶SnRK2.3的蛋白降解,调控植物对ABA的响应.拟南芥中过表达AtPP2-B11后,植株的抗旱性显著降低,对盐胁迫的耐受性提高[10-11].小麦TaFBA1编码一个含有F-box结构域的蛋白,能够与SCF型E3泛素连接酶复合体中的其他成员互作,TaFBA1显著受热胁迫、ABA和干旱胁迫的诱导表达,在烟草中过表达TaFBA1后可以显著提高植株对于热胁迫、ABA和干旱胁迫的耐受性[12-13].
榨菜,又名茎瘤芥(Brassicajunceavar.tumida),为十字花科芸薹属芥菜种叶芥亚种大叶芥变种的变种,是我国特有的蔬菜之一,其膨大茎是腌制榨菜的主要原料[14-15].榨菜作为世界三大名腌菜(涪陵榨菜、欧洲酸黄瓜和德国甜酸甘蓝)之一,是中国名特产品.然而,榨菜在生长过程中常遭受非生物逆境胁迫(如低温、盐碱、干旱胁迫等),制约瘤茎膨大,对其产量带来影响,造成巨大经济损失[16-18].因此,挖掘榨菜抗逆基因,探究抗逆分子机制迫在眉睫.
在榨菜中筛选出AtPP2-B11的同源基因,将其命名为BjuFIP-1和BjuFIP-2,对其在非生物逆境胁迫处理下的基因表达模式进行分析,同时通过对BjuFIP-1和BjuFIP-2进行克隆,构建了BjuFIP-GST原核表达载体,筛选出最佳诱导及纯化条件,分离纯化出大量纯度较好的BjuFIP-GST融合蛋白,为后续深入研究BjuFIP调控底物蛋白降解,以及榨菜抗逆提供依据.
1 材料与方法
1.1 试验材料
大肠杆菌菌株DH5a、BL21、pGEX4T-1以及榨菜栽培品种 “永安小叶”为长江师范学院现代农业与生物工程学院榨菜栽培生理试验室保存.RNA提取试剂盒、RNA反转录试剂盒、PCR产物回收试剂盒、质粒提取试剂盒,荧光定量PCR试剂盒购自杭州新景生物试剂开发有限公司.无缝克隆试剂盒Smart Assembly Cloning和Glutathione Beads购自常州天地人和生物科技有限公司.KOD FX购自TOYOBO公司.EcoRⅠ和BamHⅠ限制性内切酶购自赛默飞世尔(中国)有限公司.
1.2 试验方法
1.2.1 榨菜BjuFIP-1和BjuFIP-2基因的克隆及原核表达载体构建 利用RNA提取试剂盒提取7 d的永安小叶幼苗总RNA,按照反转录试剂盒说明书进行RNA反转录为cDNA.在芸薹属数据库网站(http://brassicadb.cn/#/)中下载F-box蛋白编码基因BjuFIP-1(BjuA043602)和BjuFIP-2(BjuB001057)的CDS序列.利用Primer 5软件合成无缝克隆特异引物,含有BamHⅠ(上游引物)和EcoRⅠ(下游引物)酶切位点,上游引物BjuFIP-1/2-F:5′-GATCTGGTTCCGCGTGGATCCATGAATAATCTGCCAGAGGACTG-3′;下游引物BjuFIP-1-R:5′-CGGCCGCTCGAGTCGACCCGGGAATTCGGGCAGTACTGGCCTAATCTC-3′;下游引物BjuFIP-2-R:5′-CGGCCGCTCGAGTCGACCCGGGAATTCGGGCAGTAGTGGCCTAATCTCC-3′.PCR产物回收目的片段后,与BamHⅠ和EcoRⅠ线性化的大载体pGEX4T-1进行无缝克隆连接,连接产物转化大肠杆菌DH5a感受态,重组质粒通过菌落PCR和酶切鉴定正确后,送华大基因有限公司测序.将测序正确的重组质粒转化大肠杆菌表达菌株BL21,菌落PCR鉴定正确后,进行蛋白诱导检测.
1.2.2 蛋白诱导时间及温度的优化 将含有重组质粒BjuFIP-1-GST和BjuFIP-2-GST的BL21大肠杆菌分别接种于LB培养基中(100 mg·L-1氨苄霉素),37 ℃ 220 r·min-1振荡培养过夜,按照1∶100比例接种扩培,37 ℃ 220 r·min-1振荡培养至D600 nm为0.4~0.6,加入IPTG(终浓度1 mmol·L-1),分别进行16 ℃诱导过夜,25 ℃诱导0、3、5 h以及37 ℃诱导0、3、5 h,分别离心收集菌体,进行SDS-PAGE电泳分析.
1.2.3 蛋白的可溶性分析 将BL21重组菌进行16 ℃ 220 r·min-1诱导过夜及37 ℃ 220 r·min-1诱导3 h,离心收集菌体,用10 mL GST binding buffer重悬,加入DTT(终浓度1 mmol·L-1),溶菌酶(终浓度200 mg·mL-1)以及PMSF(终浓度0.5 mmol·L-1),混匀,冰上孵育30 min后超声破碎至溶液清亮.4 ℃ 12 000 r·min-1离心30 min后收集上清和沉淀,进行SDS-PAGE电泳分析.
1.2.4 融合蛋白的纯化 在最佳诱导条件下诱导蛋白,超声破碎,收集超声后上清,用平衡液GST binding buffer(140 mmol·L-1NaCl,2.7 mmol·L-1KCl,10 mmol·L-1Na2HPO4,1.8 mmol·L-1KH2PO4,pH 7.4,10 mmol·L-1DTT)平衡Glutathione beads 3次.将0.45 μmol·L-1滤膜过滤后的上清置于含有Glutathione beads的亲和层析柱内,室温缓慢旋转孵育1 h.GST binding buffer洗涤3遍后,使用GST elution buffer(50 mmol·L-1Tris-HCl,10 mmol·L-1还原型谷胱甘肽,pH 8.0,10 mmol·L-1DTT)进行洗脱,每次洗脱室温孵育15 min后收集洗脱液,共洗脱3~4次,得到的洗脱液即为纯化后的目的蛋白,SDS-PAGE电泳及Western blot检测蛋白纯化效果.
1.2.5 基因表达模式检测 将7 d的榨菜幼苗分别施加低温(4 ℃)、高温(37 ℃)、50 μmol·L-1ABA、200 mmol·L-1NaCl以及300 mmol·L-1Mannitol处理,分别在处理后0、3、6、12和24 h进行取样.在RNA提取及cDNA反转录后进行BjuFIP表达模式分析.采用杭州新景生物试剂开发有限公司的荧光定量PCR试剂盒以及Roche LC480荧光定量PCR仪进行表达分析,反应体系与程序参照试剂说明.采用比较CT(循环阈值)法计算转录丰度,以BjuActin3作为内参,试验重复3次,每个样品设3个重复.定量引物如下BjuFIP-1-qPCR-F:5′-CTTCTTCTCCCTCGTCCATAAC-3′;BjuFIP-1-qPCR-R:5′-CTAGCAGCCATCATGTAGCA-3′.BjuFIP-2定量引物BjuFIP-2-qPCR-F:5′-CACTTCTTACCTTCCGAGTTCC-3′;BjuFIP-2-qPCR-R:5′-CGTGGAGAAGAAGAGGGTAATG-3′.BjuActin3定量引物BjuActin3-qPCR-F:5′-GGCTACTCTTTCACCACGAC-3′;BjuActin3-qPCR-R:5′-GGATACCAGCATTCTCCATAC-3′.
1.2.6 BjuFIP蛋白序列及启动子顺式作用元件分析 采用Clustal X软件对BjuFIP-1,BjuFIP-2以及AtPP2-B11蛋白序列进行分析.采用在线分析软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)以及New PLACE(https://www.dna.affrc.go.jp/PLACE/?action=newplace)对BjuFIP-1和BjuFIP-2的启动子顺式作用元件进行分析.采用在线分析软件SMART(http://smart.embl-heidelberg.de/)对BjuFIP蛋白结构域进行分析.
2 结果与分析
2.1 BjuFIP基因原核表达载体的构建
利用BjuFIP-1和BjuFIP-2上下游特异引物进行PCR扩增获得771 bp(编码256个氨基酸)的BjuFIP-1和BjuFIP-2蛋白编码序列(图1A).将目的载体pGEX4T-1经BamHⅠ和EcoRⅠ线性化后,分别与回收纯化的BjuFIP-1和BjuFIP-2目的片段进行无缝克隆连接,转化大肠杆菌DH5a感受态.阳性克隆进行菌落PCR以及酶切鉴定,在771 bp处均可切出目的条带(图1B和图1C).质粒送公司测序,测序正确的重组质粒命名为BjuFIP-1-GST和BjuFIP-2-GST.
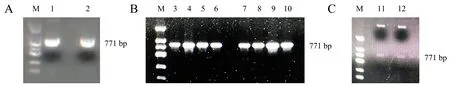
A:BjuFIP-1和BjuFIP-2蛋白编码序列PCR扩增;B:BjuFIP-1-GST 和BjuFIP-2-GST原核表达载体转化大肠杆菌感受态DH5a后菌落PCR鉴定;C:BjuFIP-1-GST和BjuFIP-2-GST质粒双酶切鉴定.M:DL2000 DNA Marker;1:BjuFIP-1基因;2:BjuFIP-2基因;3~6:BjuFIP-1-GST菌落PCR鉴定;7~10:BjuFIP-2-GST菌落PCR鉴定;11:BjuFIP-1-GST重组质粒EcoRⅠ和BamHⅠ双酶切;12:BjuFIP-2-GST重组质粒EcoRⅠ和BamHⅠ双酶切.
2.2 诱导温度及诱导时间对融合蛋白表达量的影响
将重组质粒BjuFIP-1-GST和BjuFIP-2-GST分别转化BL21并进行菌落PCR鉴定.选择鉴定正确的单克隆菌株,分别进行16 ℃过夜小量诱导,25 ℃小量诱导0、3、5 h以及37 ℃小量诱导0、3、5 h.SDS-PAGE电泳结果表明,不同温度以及不同时间的诱导条件下均可诱导出55 ku的BjuFIP-GST融合蛋白,并且随着诱导时间的增加,融合蛋白的表达量逐渐增高(图2).通过蛋白诱导条件筛选,16、25、37 ℃均可诱导出BjuFIP-GST融合蛋白,因此分别选取16 ℃过夜以及37 ℃诱导3 h条件进行蛋白的诱导,为后续进行融合蛋白的可溶性分析提供材料.

A:16 ℃;B:25 ℃;C:37 ℃.M:Marker.1:BjuFIP-1-GST诱导0 h;2:BjuFIP-1-GST过夜诱导;3:BjuFIP-2-GST诱导0 h;4:BjuFIP-2-GST过夜诱导;5:BjuFIP-1-GST诱导0 h;6:BjuFIP-1-GST诱导3 h;7:BjuFIP-1-GST诱导5 h;8:BjuFIP-2-GST诱导0 h;9:BjuFIP-2-GST诱导3 h;10:BjuFIP-2-GST诱导5 h;11:BjuFIP-1-GST诱导0 h;12:BjuFIP-1-GST诱导3 h;13:BjuFIP-1-GST诱导5 h;14:BjuFIP-2-GST诱导0 h;15:BjuFIP-2-GST诱导3 h;16:BjuFIP-2-GST诱导5 h.
2.3 BjuFIP-GST融合蛋白的可溶性及纯化
将16 ℃过夜以及37 ℃诱导3 h的BjuFIP-1-GST蛋白和16 ℃过夜诱导的BjuFIP-2-GST蛋白收集菌体后进行超声波破碎,离心收集上清和沉淀进行SDS-PAGE电泳分析.结果表明,BjuFIP-1-GST融合蛋白在37 ℃虽然诱导量高,但大部分在沉淀中以包涵体的形式存在,以可溶性蛋白形式存在于菌液裂解后的上清中很少,不能进行后续蛋白纯化试验;在16 ℃的诱导条件下BjuFIP-1-GST和BjuFIP-2-GST融合蛋白诱导量也高,也有较多的蛋白以可溶性蛋白的形式存在于菌液裂解后的上清中,能用于进行后续的纯化试验(图3A).因此,选择16 ℃过夜诱导条件下的蛋白超声破碎上清液进行后续蛋白纯化.
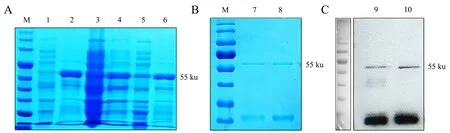
A:BjuFIP-GST融合蛋白的可溶性分析;B:SDS-PAGE电泳检测BjuFIP-GST融合蛋白纯化情况;C:Western blot检测BjuFIP-GST融合蛋白纯化情况.M:marker;1:BjuFIP-1-GST在37 ℃诱导3 h后的裂解上清;2:BjuFIP-1-GST在37 ℃诱导3 h后的裂解沉淀;3:BjuFIP-1-GST在16 ℃过夜诱导后的裂解上清;4:BjuFIP-1-GST在16 ℃过夜诱导后的裂解沉淀;5:BjuFIP-2-GST在16 ℃过夜诱导后的裂解上清;6:BjuFIP-2-GST在16 ℃过夜诱导后的裂解沉淀;7:16 ℃过夜诱导条件下BjuFIP-1-GST纯化蛋白;8:16 ℃过夜诱导条件下BjuFIP-2-GST纯化蛋白;9:16 ℃过夜诱导条件下BjuFIP-1-GST纯化蛋白;10.16 ℃过夜诱导条件下BjuFIP-2-GST纯化蛋白.
将16 ℃诱导过夜,离心收集的菌体进行超声波破碎,离心后的上清置于含有Glutathione beads的亲和层析柱内,室温缓慢旋转孵育1 h,通过3次洗涤和3次洗脱,获得了大量分子质量为55 ku的纯度较好的BjuFIP-1-GST和BjuFIP-2-GST融合蛋白(图3B).采用western blot技术,对纯化的BjuFIP-1-GST和BjuFIP-2-GST融合蛋白进行检测,可以观察到GST抗体能够检测出目的条带,且条带单一,表明获得了大量纯度较好的BjuFIP-1-GST和BjuFIP-2-GST融合蛋白(图3C).
2.4 BjuFIP序列、蛋白结构域及BjuFIP启动子顺式作用元件
BjuFIP-1(BjuA043602)和BjuFIP-2(BjuB001057)分别与AtPP2-B11间具有高达84%和83%的蛋白同源性.基因结构分析结果表明,BjuFIP含有3个外显子和2个内含子,蛋白结构上在N端含有1个F-box结构域,说明该蛋白很可能作为SCF型泛素E3连接酶发挥功能.对茎瘤芥BjuFIP基因家族启动子上的顺式作用元件进行分析,发现在BjuFIP-1和BjuFIP-2的启动子上含有ABA响应元件ABRE motif(ABA response),说明BjuFIP可能被ABA诱导表达,同时在它们的启动子上还含有在干旱响应过程中起重要作用的MBS(drought response)作用元件、胁迫及防御响应元件TC rich repeat(defense and stress response)以及茉莉酸信号通路响应元件CGTCA motif(MeJA response),说明BjuFIP在ABA、干旱以及其他逆境胁迫条件下能够被诱导表达,同时在ABA等逆境胁迫信号通路中具有重要功能(图4).
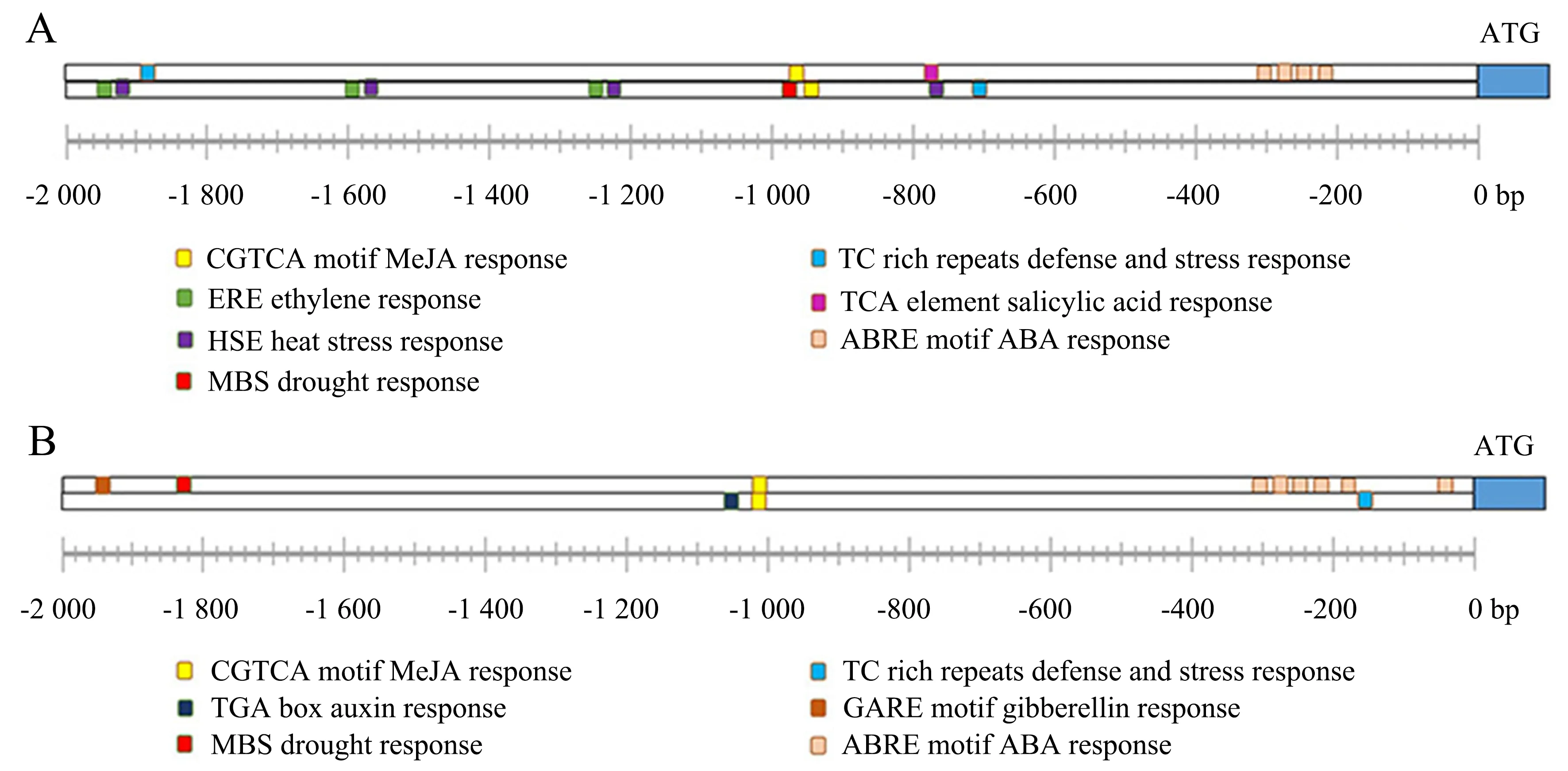
A.BjuFIP-1启动子顺式作用元件;B.BjuFIP-2启动子顺式作用元件.
2.5 BjuFIP在非生物逆境胁迫下基因表达模式
在非生物逆境胁迫下对候选基因进行荧光定量分析的结果表明,在低温(4 ℃)、高温(37 ℃)、50 μmol·L-1ABA、200 mmol·L-1NaCl以及300 mmol·L-1Mannitol处理下,与0 h相比,BjuFIP-2基因表达水平都受到显著诱导,并且该基因的表达水平随着低温、高温以及Mannitol处理时间的延长,一直被显著诱导表达,而在ABA和NaCl处理下,随着时间的延长,BjuFIP-2的表达水平先上升后下降;BjuFIP-1基因表达水平只在低温(4 ℃)、高温(37 ℃)和200 mmol·L-1NaCl的诱导下显著表达,并且BjuFIP-1的表达水平随着低温和NaCl的诱导,表现出先上升后下降的表达趋势(图5).研究结果说明,BjuFIP-2在榨菜响应低温、高温、ABA、NaCl 以及干旱胁迫过程中具有作用,而BjuFIP-1却只在低温、高温和盐胁迫下具有一定的功能(图5).
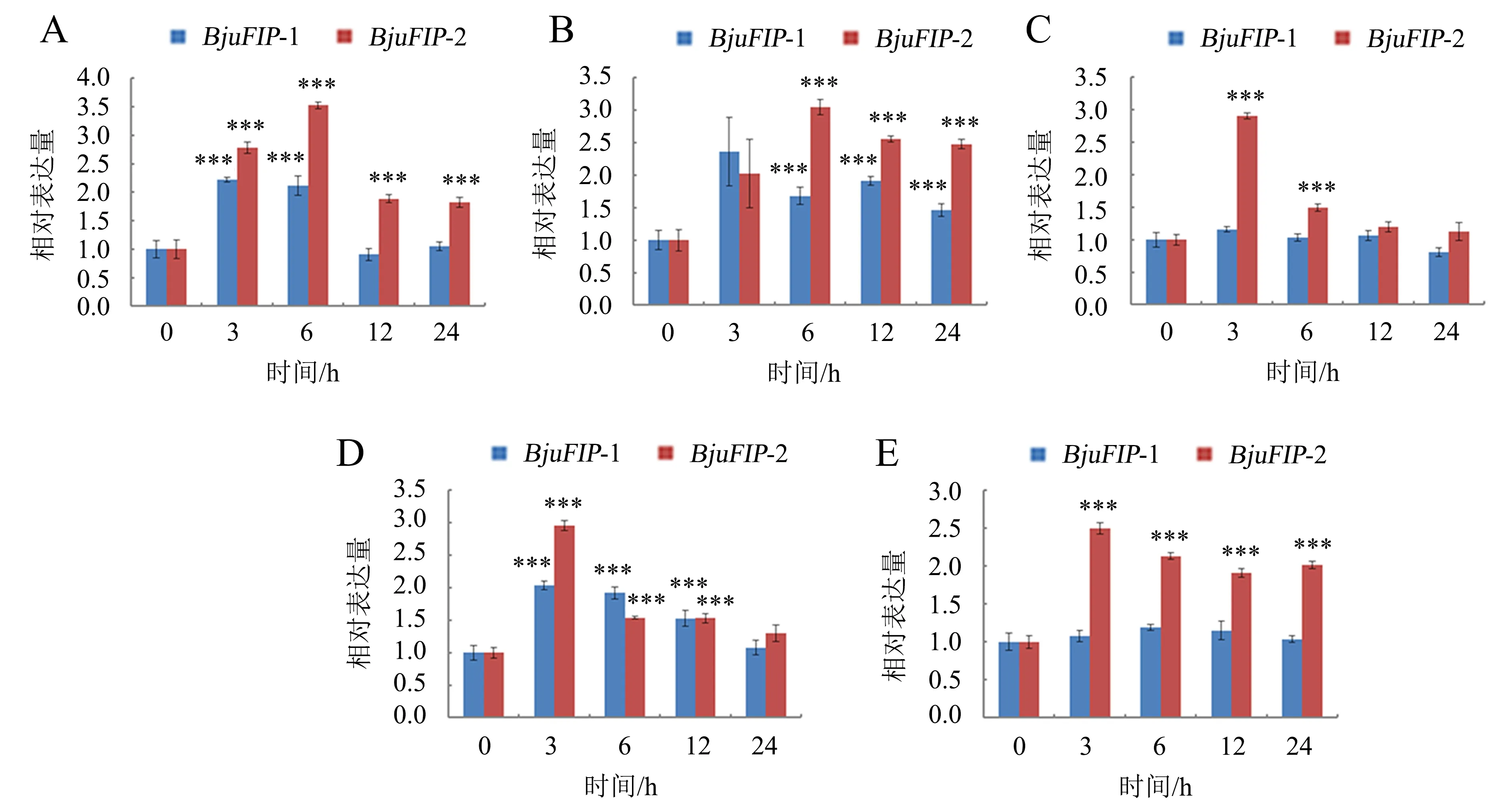
A:4 ℃处理;B:37 ℃处理;C:50 μmol·L-1 ABA处理;D:200 mmol·L-1 NaCl处理;E:300 mmol·L-1 Mannitol处理.“***”代表P<0.001.
3 讨论与结论
茎瘤芥其膨大瘤茎是制作榨菜的主要原材料,然而在其生长发育过程中常遭受非生物逆境胁迫(如盐碱,冻害等)和生物逆境胁迫(如根肿菌等)的影响,制约瘤茎膨大,严重制约榨菜产业的可持续发展.榨菜BjuFIP-1和BjuFIP-2在拟南芥中的同源基因为AtPP2-B11.拟南芥F-box蛋白AtPP2-B11可以形成SCF型E3泛素连接酶复合体,作为ABA信号通路中的负调控因子,通过促进ABA信号通路中蛋白激酶SnRk2.3的降解,来调控ABA信号通路,从而介导植物对非生物逆境胁迫的响应[9].拟南芥中过表达AtPP2-B11后,植株的抗旱性显著降低,对盐胁迫的耐受性提高,表明AtPP2-B11调控植物对逆境胁迫的影响[10-11].榨菜BjuFIP-1和BjuFIP-2作为AtPP2-B11的同源基因,与其具有相似的基因结构和相同的F-box结构域,很可能也参与调控榨菜对逆境胁迫的响应.为了进一步研究BjuFIP的生物学功能,本研究对BjuFIP启动子顺式作用元件以及在逆境胁迫下BjuFIP的基因表达模式进行了分析,构建了BjuFIP原核表达载体,优化蛋白诱导条件,并获得了大量纯度较好的BjuFIP-GST融合蛋白.
为了研究不同诱导温度以及不同诱导时间对BjuFIP-GST蛋白表达的影响,分别采用16 ℃诱导过夜,25 ℃诱导0、3、5 h以及37 ℃诱导0、3、5 h的处理,SDS-PAGE电泳结果表明,不同诱导温度以及诱导时间均可诱导出融合蛋白.然而对其诱导蛋白超声破碎后检测结果表明,37 ℃诱导的BjuFIP-1-GST蛋白绝大多数以包涵体的形式存在,而16 ℃诱导的BjuFIP蛋白较多的以可溶性蛋白形式存在,因此本试验最终选取16 ℃诱导过夜作为BjuFIP-GST融合蛋白的最佳诱导条件.
本试验对BjuFIP启动子进行顺式作用元件分析,采用荧光定量PCR技术对BjuFIP在低温(4 ℃)、高温(37 ℃)、50 μmol·L-1ABA、200 mmol·L-1NaCl 以及300 mmol·L-1Mannitol的胁迫处理下的基因表达模式进行分析,构建BjuFIP-1-GST和BjuFIP-2-GST原核表达载体,筛选最佳蛋白诱导条件,以及通过含有Glutathione beads的亲和层析柱获得了大量纯度较高的BjuFIP-GST融合蛋白,为后续研究BjuFIP下游互作蛋白及其生物学功能奠定了研究基础.

