糯性低葡萄糖当量麦芽糊精的制备及结构表征
常江涛,刘 洁,刘亚伟
河南工业大学 粮油食品学院,河南 郑州 450001
麦芽糊精是淀粉不完全降解产物,通过α-1,4糖苷键连接α-D-吡喃葡萄糖残基形成线性长链,分支处通过α-1,6糖苷键连接。麦芽糊精的葡萄糖当量(DE)小于20,摩尔质量介于淀粉和淀粉糖之间[1]。淀粉经水解后,DE小于6,称为低DE麦芽糊精,其组分中几乎为四糖以上的较大分子,性质与原淀粉相接近,黏度大,吸湿性小[2-3]。低DE麦芽糊精具有良好的溶解性、增稠性,能抑制糖结晶,也可加工成直径1~3 μm的微凝胶[4],与脂肪颗粒的大小相似,因此具有类似脂肪的行为和特征,多被作为脂肪替代品[5-7]。
目前制备麦芽糊精的方法主要有酸法、酶法或二者结合。其中酶法工艺最大优点在于反应可控[8],多用来生产低DE麦芽糊精。低DE麦芽糊精,含有较多的线性分子,摩尔质量分布不均匀。同时,在低DE麦芽糊精中,溶胶-凝胶的转变是一个缓慢的过程,伴随着脱水,高聚合度的长链螺旋结构被一些短链、无序区干扰[9]。低DE麦芽糊精与低聚糖共混,低浓度时表现为类牛顿流体特性[10];与阿拉伯胶作用,起到增稠稳定效果[11]。然而,低DE麦芽糊精产品质量并不稳定,受体系中低分子量糖的类型和含量影响。研究表明,影响麦芽糊精制备的因素有水解类型和条件[12],DE是表征麦芽糊精流变和功能特性的主要参数,淀粉的来源(玉米、燕麦片、木薯粉、大米或土豆)、酶的作用方式也会影响麦芽糊精分子的链长分布[13]。因此,即使相同DE的麦芽糖糊精也可能表现出不同的理化性质。显然,DE作为参数不能完全描述麦芽糊精的性质[7],而麦芽糊精黏度取决于体系中分子链的长短,分子链长度越大,流动阻力增加,黏度越大,越有利于促进凝胶结构的形成[5]。
相比其他谷物淀粉,糯米淀粉中支链淀粉含量可达到95%以上。此外,糯米淀粉具有抗老化、高透明度、消化缓慢以及良好冻融稳定性等特性[14-15]。选用糯米淀粉为原料,以DE和黏度为指标,利用耐高温α-淀粉酶对糯米淀粉进行改性,通过正交试验设计优化,制备低DE和高黏度的麦芽糊精,并对其结构进行表征,以期为获得物化性质稳定的低DE麦芽糊精提供理论依据。
1 材料与方法
1.1 材料与试剂
糯米粉(蛋白5.53%、脂肪1.04%、灰分0.24%、淀粉87.17%):河南裕丰粮业有限责任公司;耐高温α-淀粉酶:64.17 U/mL,白银赛诺生物公司;氢氧化钠、盐酸:天津市科密欧化学试剂有限公司。
1.2 仪器与设备
RW20搅拌器:德国艾卡(IKA)公司;Rapid Visco Analyzer:美国perten公司;SHZ-D3型循环水式真空泵:巩义予华仪器有限责任公司;pH 计:梅特勒-托利多仪器公司;喷雾干燥器:GEA Niro,Soeborg,丹麦;TA Q20差示扫描热量仪、TA Q50热重分析仪:美国TA公司;Nicolet FT-IR红外光谱仪:赛默飞世尔科技公司;D8-ADVANCE X射线衍射仪:美国布鲁克公司。
1.3 试验方法
1.3.1 糯米淀粉提取
采用碱法分离工艺[16]提取糯米淀粉,制得的糯米淀粉组成为蛋白0.49%、脂肪0.14%、灰分0.12%、淀粉92.95%。
1.3.2 麦芽糊精制备
取75 g糯米淀粉加入蒸馏水中,调节至pH 6.0,制成一定浓度的均匀乳液,移入500 mL圆底烧瓶,置于一定温度水浴中,开始搅拌,预热2 min,立即添加耐高温α-淀粉酶,开始计时(5~15 min)。结束后立即加HCl调节使pH≤3,灭酶,终止反应。冷却至室温后,加NaOH调节pH至中性。经喷雾干燥,收集粉末,制备出麦芽糊精(MD)。干燥参数:入口温度180 ℃、出口温度90 ℃、雾化气压0.3 MPa。
1.3.3 DE测定
根据Lane-Eynon方法测定还原糖,并将结果用于计算DE,以总淀粉含量的百分比表示[17-18]。
1.3.4 黏度测定[19-20]
将麦芽糊精与去离子水混合,制备质量分数为15%的乳液,使用Rapid Visco Analyzer,参考GB 24852—2010,测定其黏度。
1.3.5 单因素试验
以DE和黏度为指标,基础条件:酶添加量100 μL,酶解时间7.5 min,酶解温度95 ℃,底物浓度20%。选取酶添加量(50、100、150、200、250 μL),酶解时间(5.0、7.5、10.0、12.5、15.0 min),酶解温度(80、85、90、95、100 ℃),底物浓度(10%、15%、20%、25%、30%)进行单因素试验。
1.3.6 正交试验设计
根据单因素试验结果,以样品DE和黏度为指标,选取酶添加量、酶解时间、酶解温度、底物浓度进行4因素3水平的正交试验。
1.3.7 基本理化指标测定
样品水分含量测定采用快速水分测定仪。粗脂肪含量测定参照GB/T 22427.3—2008 索氏抽提法;蛋白含量测定参照GB 5009.5—2016;灰分含量测定参照GB/T 22427.1—2008;淀粉含量测定参照GB/T 20378—2006旋光法。
1.3.8 热力学特性测定
参照Tang等[21]使用的方法,使用TA Instruments Universal Analysis软件分析热焓图以获得糊化焓。
1.3.9 热降解特性的测定
称取10 mg样品置于热重分析仪(TGA)吊篮,进行测试。程序设定:以10 ℃/min升温,升温范围40~600 ℃,氮气吹扫速率为40 mL/min[22]。
矫正之后的失重率=校正前高聚物的失重率/(1-水的失重率)。
1.3.10 红外光谱分析
采用傅里叶变换红外光谱测定[23]。结果通过OMNIC 8.0去卷积,去卷积条件:半峰宽度为19 cm-1,增强因子为1.6。使用在1 047、1 022 cm-1处的吸光度的比值来代表样品的短程有序结构。
1.3.11 晶型结构的分析测定
结晶结构测定采用X-射线衍射仪,扫描步长0.02°,扫描速率4°/min,2θ为5°~50°,计算结晶度[24]。
1.4 数据处理与分析
对试验数据进行3次测定,结果以平均值±标准差表示。采用Origin 9.6软件作图,采用IBM SPSS Statistics 20.0进行统计学分析,使用Duncan方法进行方差分析(ANOVA,α=0.05)。
2 结果与分析
2.1 单因素试验
2.1.1 酶用量对DE和黏度的影响
由图1可以看出,DE随着高温α-淀粉酶用量增加,呈现线性增加趋势,黏度呈相反趋势。随酶用量的增加,酶分子与糯米淀粉的碰撞概率增加,促进糯米淀粉链水解产生短链糊精等低聚糖,反应体系的黏度迅速下降,同时反应过程中断裂的α-1,4糖苷键含量增加,因此还原糖含量增加,DE增大。这与文献[12,25]的结果相似。
2.1.2 酶解时间对DE和黏度的影响
由图2可以看出,麦芽糊精的DE随着酶解时间的延长而呈现显著升高趋势。7.5 min时,淀粉的黏度急剧下降。相比其他谷物淀粉,糯米淀粉具有颗粒直径小、结构疏松的特点[26],α-淀粉酶作为内切酶快速作用,产生低分子量聚合物。随着反应时间的延长,更多的酶与淀粉发生接触,还原糖含量增加,同时反应体系中低分子量的聚合物增多,黏度降低[25]。
2.1.3 酶解温度对DE和黏度的影响
由图3可以看出,麦芽糊精的DE随着温度升高呈现显著下降趋势,黏度呈现先降低后升高趋势。温度升高,α-淀粉酶活性受到抑制,同时还原端与氨基端发生羰氨反应,从而导致还原糖含量减少[27-28]。95~100 ℃,酶继续作用,淀粉链被水解,黏度不再显著升高,这与分子链水解转化为分子量不均匀的聚合物有关[12]。
2.1.4 底物浓度对DE和黏度的影响
由图4看出,麦芽糊精的DE随着底物浓度增加而呈现降低趋势,体系黏度随底物的浓度增加而呈现升高趋势。DE在底物浓度为15%~20%时没有显著性差异。随着底物浓度的增加,在淀粉糊化过程中糯米淀粉中支链淀粉被完全释放,体系的黏度显著升高。同时随底物浓度的增加,体系中干物质含量增加,阻碍酶有效扩散,对底物-复合物的缔合和解离均不利,体系黏度升高,也会阻碍酶与底物的充分作用,这与Kong等[18]的研究结果类似。
2.2 低DE麦芽糊精正交试验结果与分析
由表1可以看出,影响DE的因素依次为酶用量>酶解时间>底物浓度>温度,影响黏度的因素依次为酶用量>底物浓度>酶解时间>温度。表2和表3方差分析结果显示各因素对结果均有极显著影响。得出优化低DE的水平组合为A1B1D3C3,优化黏度的水平组合为A1D3B1C3,两个水平组合为相同处理。制备低DE麦芽糊精的最佳工艺条件为酶用量50 μL,酶解时间7.5 min,底物浓度25%,温度95 ℃。在此条件下制备的样品DE为1.6,黏度为104.96 mPa·s。

表1 正交试验结果与分析
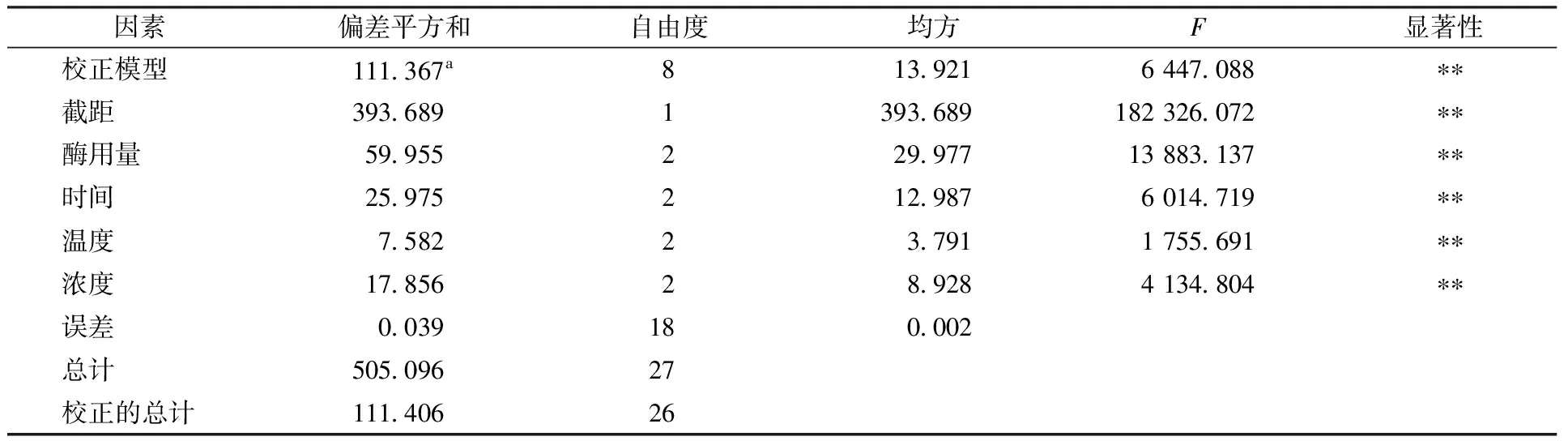
表2 DE方差分析
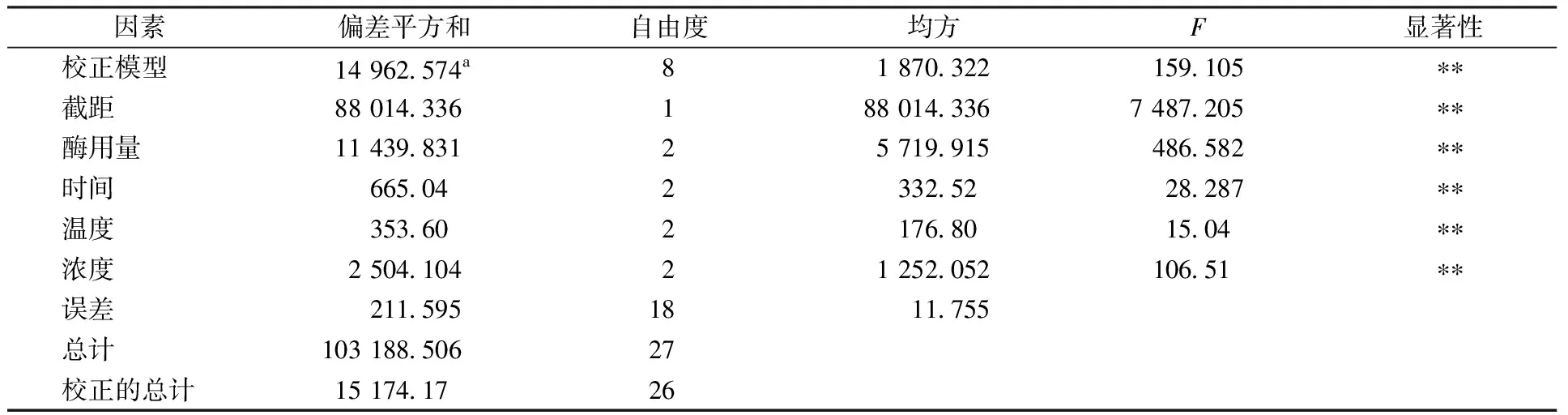
表3 黏度方差分析
2.3 麦芽糊精热力学特性分析
DSC可以表征淀粉分子内晶体的完整程度以及双螺旋结构的损失[29]。如图5所示,糯米粉和糯米淀粉分别在65.95、69.85 ℃左右出现吸热峰,麦芽糊精DSC曲线呈略微下降趋势,没有观察到明显的吸热峰。表明经过糊化,淀粉分子链双螺旋结构被打开,酶与淀粉链作用,进一步水解α-1,4糖苷键,经喷雾干燥后(180 ℃/90 ℃)形成麦芽糊精,有序的内部结晶结构被破坏,转变为无定型结构[30]。
如图6所示,第1阶段(40~150 ℃)与麦芽糖糊精自身的脱水有关,第2阶段样品发生分解,为重量损失的区域,这种质量损失归因于长分子链的热分解[30]。糯米粉的分解速率比麦芽糊精大,随着DE的增加,分解速度变慢。降解温度可以反映麦芽糊精的耐热性能。由图6可以看出,不同麦芽糊精在250 ℃均未发生降解,降解温度范围比糯米粉和糯米淀粉小,最大降解温度也均低于糯米粉和糯米淀粉。在分解过程中,糯米粉减少初始重量的85.33%,麦芽糖糊精减少了其初始重量的80%~83%。DE增加,最大分解温度降低和失重率减小,这与淀粉水解程度增加导致麦芽糊精中含有较多的低聚糖有关。陈颖钦等[31]研究发现低聚糖的最大分解温度降低,葡萄糖分解温度最低。
2.4 傅里叶红外光谱及结晶度分析
DSC热分析时,分子双螺旋的短程有序的损失可以通过FT-IR进行表征。通常以1 047、1 022 cm-1处的吸光度比值衡量淀粉中有序结构含量,比值越大,分子的短程有序程度越高[32-33]。由图7和表4可知,4种麦芽糊精相比糯米粉和糯米淀粉未出现新的红外吸收峰,但IR1 047/1 022随着DE的增加而减小,表明分子短程有序程度增加。
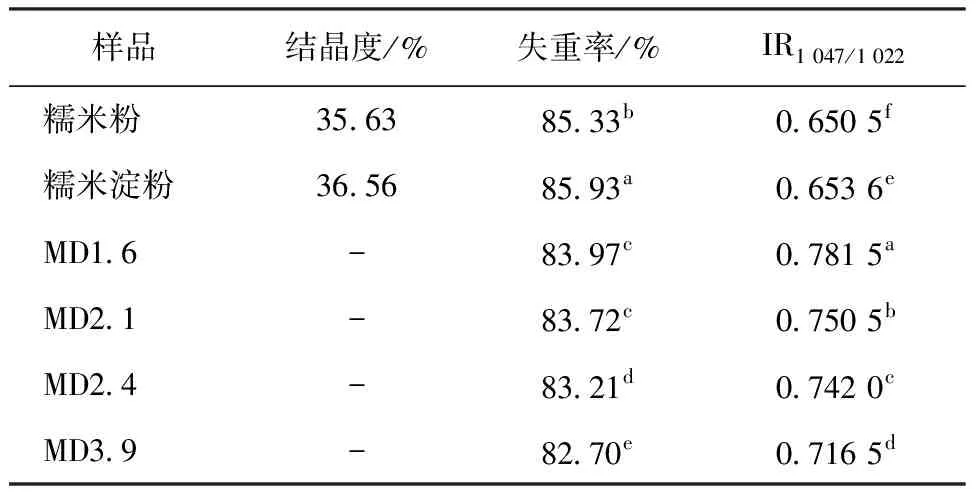
表4 样品失重率、结晶度和IR1 047/1 022 统计分析
由图8和表4可知,糯米粉和糯米淀粉为典型的A型结构,结晶度分别为35.63%、36.56%。麦芽糊精的结晶峰均消失,呈现弥散状,表明结晶结构被破坏,转变为无定型结构。
3 结论
以DE和黏度为指标,通过正交设计优化低DE、高黏度麦芽糊精的制备工艺,得到最优制备工艺参数:酶用量50 μL,底物浓度25%,酶解时间7.5 min,温度95 ℃。验证试验表明,在此条件下制备样品的DE为1.6,黏度为104.96 mPa·s。通过热力学特性分析,麦芽糊精DSC曲线没有明显的吸热峰;红外光谱显示,麦芽糊精的IR1 047/1 022均高于糯米粉和糯米淀粉,随着DE的增加,IR1 047/1 022减小。X-射线衍射图谱表明,糯米粉和糯米淀粉为典型的A型结构,麦芽糊精的结晶峰消失,呈现弥散状,表现为无定型结构。TG曲线表明糯米粉的分解速率比麦芽糊精快,随着DE的增加,麦芽糊精的分解速度变慢,最大降解温度降低。麦芽糊精的重量损失率均低于糯米粉和糯米淀粉,热稳定性增加。同时,麦芽糊精在250 ℃均未发生降解,表明具有较强的耐热性,可以满足多数食品的加工需求。

