烟芽夜蛾囊泡病毒3h株3h-122基因于棉铃虫幼虫体内的转录表达分析
赵 莹, 谭 赟, 黎 妮, 陈 斌, 于 欢, 黄国华
(湖南农业大学植物保护学院, 植物病虫害生物学与防控湖南省重点实验室, 长沙 410128)
囊泡病毒科Ascoviridae病毒是专性感染昆虫的一类大型双链环状DNA病毒,于1983年首次被报道[1]。因其在感毒昆虫的血淋巴中形成包裹着许多病毒粒子的大型囊泡而得名[2-3]。囊泡病毒可通过寄生蜂产卵在鳞翅目昆虫中传播,导致昆虫慢性致死[4]。囊泡病毒的宿主范围相对较广,能感染包括甜菜夜蛾Spodopteraexigua、棉铃虫Helicoverpaarmigera、烟芽夜蛾Heliothisvirescens等在内的多种农业害虫,有着巨大的生防应用潜力[5]。目前,在NCBI数据库中已登录有11株囊泡病毒毒株的全基因组序列,大小都在100~200 kb之间,编码100~200个开放阅读框(open reading frames, ORF)[6]。
烟芽夜蛾囊泡病毒3h(Heliothis virescens ascovirus 3h,HvAV-3h)由本实验室在2012年分离并报道[7],并于2017年完成基因组测序[8]。其基因组全长为190 519 bp,G+C含量为45.5%,预测编码185个开放阅读框,其中包括44个核心基因、4个特有基因、24个bro基因。此前已在粉纹夜蛾囊泡病毒6b株(Trichoplusia ni ascovirus 6b,TnAV-6b)、草地贪夜蛾囊泡病毒1a株(Spodoptera frugiperda ascovirus 1a,SfAV-1a)和烟芽夜蛾囊泡病毒3i株(Heliothis virescens ascovirus 3i,HvAV-3i)中分别鉴定出了9、21个和67个结构蛋白[9-11]。迄今为止,已鉴定的囊泡病毒的结构蛋白主要有衣壳蛋白MCP、DNA结合蛋白P64、3H-21、3H-117[12-15]。
随着蛋白质组学检测系统的发展,对囊泡病毒粒子的蛋白质组成进行更全面的分析,对囊泡病毒结构蛋白的研究至关重要。本实验室前期已鉴定出HvAV-3h病毒粒子携带78个病毒蛋白,为初步鉴定病毒结构蛋白及其功能研究打下良好基础。本试验通过构建原核表达载体获得了HvAV-3h的第122个基因(3h-122)编码的蛋白并制备了多克隆抗体、通过RT-PCR、蛋白免疫印迹检测(Western blotting)及免疫组化分析明确了3H-122蛋白在HvAV-3h感染过程中的转录和表达时相,确定其为HvAV-3h病毒粒子的一个结构蛋白。为进一步深入研究3h-122的功能及对病毒组装复制的具体作用奠定基础。
1 材料与方法
1.1 材料
棉铃虫种群由本实验室长期室内饲养,饲养条件为(27±1)℃,相对湿度70%,光照周期为L∥D=16 h∥8 h[16]。烟芽夜蛾囊泡病毒3 h株(HvAV-3h)于2012年分离并于2017年完成全基因组测序,在湖南农业大学病毒研究所长期保存[7-8]。
1.2 3h-122基因的克隆及序列分析
根据Li等[17]报道的方法,以针刺法将HvAV-3h接种至3龄棉铃虫(蜕皮后12~24 h)血腔内,并于接种后72 h收集试虫;用TRI Reagent 试剂盒(RNA/DNA/Protein Isolation Reagent, Invitrogen, Cincinnati, USA)提取试虫总RNA,随后采用Go ScriptTMReverse Transcription Mix, Oligo (dT)反转录试剂盒(Promega, USA)合成cDNA,贮存于-20℃备用。根据Huang等报道的HvAV-3h基因组序列(GenBank登录号:KU170628.1)及预测的开放阅读框[8],设计3h-122基因的特异性引物3h-122-F(5′-GGATCCATGGATTGCTCACTGGTG-3′,下划线为BamH Ⅰ酶切位点)和3h-122-R(5′-AAGCTTTTACAACGGTTTAATAGAAGAT-3′,下划线为Hind Ⅲ酶切位点),从制备的cDNA中扩增3h-122基因的CDS区。反应产物在含有4S Green Plus Nucleic Acid Stain的1%琼脂糖凝胶上进行分离,并使用V-ELUTE Gel Mini purification Kit(北京庄盟国际生物基因科技有限公司)回收目的片段。
将3h-122与pGEM-T载体(Promega,北京)连接,并转化到大肠杆菌TG1感受态细胞中,获得含重组质粒的菌株。向菌液中加入1 mL S.O.C培养基,于37℃,200 r/min振荡培养1 h后涂布于含100 μg/mL氨苄青霉素、24 μg/mL异丙基-β-D硫代吡喃半乳糖苷(isopropylβ-D-1-thiogalactopyranoside, IPTG)和40 μg/mL X-Gal 的LB固体培养基上,挑取阳性单菌落至3 mL LB液体培养基中,37℃,200 r/min振荡培养10~12 h后收集菌液,采用Fast Plasmid Miniprep Kit(北京庄盟国际生物基因科技有限公司)提取质粒,将筛选获得的阳性克隆送至擎科生物技术有限公司测序。
通过NCBI ORF Finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)把DNA序列翻译成氨基酸序列,使用Expert Protein Analysis System ExPASy工具(http:∥expasy.org/tools/)分析3H-122的物理和化学性质。利用Geneious 4.8.4 (Biomatters Ltd)、DNAMAN(Lynnon corporation)软件进行序列比对、SignalP 5.0(http:∥www.cbs.dtu.dk/services/SignalP/)软件预测信号肽、TMHMM Server 2.0(http:∥www.cbs.dtu.dk/services/TMHMM/)分析跨膜区。
1.3 原核表达载体的构建
对含有3h-122基因的质粒进行双酶切,酶切产物经1%的琼脂糖凝胶分离;并使用V-ELUTE Gel Mini purification Kit回收目的基因。将目的基因与表达载体pET-28a(+)连接,连接产物导入大肠杆菌TG1感受态细胞中,并在含50 μg/mL卡那霉素(Kna+,下同)的固体LB培养基上培养,挑取含有重组质粒的阳性转化体转移至3 mL LB液体培养基(Kna+)中37℃,200 r/min培养过夜。采用Fast Plasmid Miniprep Kit从该菌液中提取质粒,用限制性内切酶BamHⅠ和Hind Ⅲ对构建好的pET-28a-3h-122载体双酶切,酶切产物用1%琼脂糖凝胶电泳分离,检验表达载体是否构建成功。
1.4 3H-122蛋白的表达、纯化及多克隆抗体的制备
将pET-28a-3h-122转化至大肠杆菌BL21(DE3)感受态细胞中,并在含50 μg/mL Kna+(下同)的固体LB培养基上进行抗性筛选,挑取单个菌落至的LB(Kna+)液体培养基中,37℃,200 r/min培养过夜。取该培养物接种于3 mL LB(Kna+)液体培养基中并在37℃,200 r/min培养2~3 h(直到OD600达到0.6~0.8),加入3 μL IPTG,在25℃下160 r/min培养24 h诱导目的基因的表达。将培养物离心,弃上清,用平衡缓冲液(pH 8.0, 300 mmol/L NaCl, 50 mmol/L NaH2PO4, 10 mmol/L咪唑, 10 mmol/L Tris base)重悬菌体,于冰上超声破碎后12 000 r/min离心15 min。分别收集上清和沉淀,沉淀经8 mol/L尿素溶解后通过Ni2+-NTA亲和层析柱纯化蛋白。经SDS-PAGE分离获得纯化的目的蛋白。将纯化后的蛋白送至中国科学院武汉病毒研究所制备多克隆抗体。
1.5 Western blotting检测3H-122蛋白
参考Zhao等[15]的方法纯化病毒粒子,并用高效RIPA裂解液(索莱宝科技,北京)提取纯化病毒粒子的总蛋白,SDS-PAGE分离蛋白,割取含目的蛋白的胶块转印至硝酸纤维素(nitrocellulose, NC)膜上。将NC膜于封闭液TBST(含5%脱脂奶粉的Tris Buffered Saline Tween缓冲液)中室温封闭1 h,分别与1∶3 000的比例稀释的3H-122抗体和以1∶4 000比例稀释的GAPDH(甜菜夜蛾甘油醛-3-磷酸脱氢酶glyceraldehyde-3-phosphate dehydrogenase)抗体(本实验室前期制备)[18]4℃孵育过夜。TBST洗膜3次,每次5 min,将洗涤后的NC膜转移到以1∶5 000比例稀释的二抗溶液(山羊抗兔)中,室温孵育1 h,再次用TBST洗涤3次,每次5 min。NC膜上均匀滴加显色液(ClarityTMWestern ECL Substrate, Luminlo/enhancer solution: Peroxide solution=1∶1, Bio-Rad),避光反应5 min,滤纸吸干后使用化学发光系统成像仪(ChemiDocTMXRS+, Bio-Rad)观察结果。
1.6 3h-122基因转录分析
为了分析3h-122在感染HvAV-3h的棉铃虫幼虫中的转录时相,按照1.2所述方法接种HvAV-3h病毒,以针刺但不接种病毒的试虫为对照(后文称针刺对照)。分别于接种后3、6、12、24、48、72、96、120 h和168 h提取棉铃虫幼虫总RNA并合成cDNA,使用引物3h-122-F/3h-122-R以及本实验室设计的甜菜夜蛾甘油醛-3-磷酸脱氢酶gapdh基因的特异性引物:se-gapdh-F: 5′-ATGTCCAAAATCGGTATCAACG-3′,se-gapdh-R: 5′-TTAATCCTTGGTCTGGATGTACT-3′进行PCR。随后将PCR产物在1%琼脂糖凝胶上分析。
1.7 3H-122蛋白表达分析
接种方法和对照设置同1.6。分别于处理后3、6、12、24、48、72、96、120 h和168 h提取接种HvAV-3h以及针刺对照棉铃虫幼虫蛋白质。使用12%SDS-PAGE分离蛋白质,并使用特异性兔抗血清进行Western blotting分析。GAPDH用作内参蛋白。
1.8 免疫组织化学分析
收集接种HvAV-3h后24、72、120 h的棉铃虫幼虫,以针刺但不接种病毒的幼虫作为对照。加入1 mL 4%多聚甲醛固定后,送往武汉赛维生物科技有限公司完成石蜡切片的制作。制作完成的石蜡切片置于60℃电热恒温烘箱中加热20 min后使用二甲苯洗涤3次,每次10 min;再将切片依次放入无水乙醇洗涤2次、95%乙醇、90%乙醇、80%乙醇、70%乙醇各洗涤1次、蒸馏水洗涤2次,每次5 min。常规脱蜡水化后,切片放入装有0.01 mol/L柠檬酸钠(pH 6.0)的烧杯中,放置于高压锅中隔水加热10 min;自然降至室温后,在切片上滴入0.01 mmol/L,PBS缓冲液(pH 7.4)配制的1% Triton-X 100,室温孵育1 h后用PBS缓冲液(pH 7.4)洗涤3次,每次5 min。在切片上滴入蒸馏水配制的3% H2O2,室温下孵育10 min后用PBS缓冲液洗涤3次,每次5 min。最后将切片放入PBS缓冲液配制的10%牛血清蛋白液,室温下孵育30 min进行封闭。加入用PBS缓冲液以1∶500比例稀释的3H-122蛋白多克隆抗体,4℃孵育12 h。取出放置于室温45 min,复温后用PBS缓冲液洗涤5次,每次5 min。然后滴加用PBS缓冲液以1∶5 000比例稀释的二抗(山羊抗兔),室温下孵育1 h。封片后,在倒置荧光显微镜(Asio Valt A1;ZeSSIS,GER)下观察切片并拍摄。最后的图像用ZEN(ZESSIS,GER)进行分析。
2 结果与分析
2.1 3h-122基因扩增与序列分析
以1.2制备的cDNA为模板,使用3h-122-F/3h-122-R进行PCR扩增,扩增出与预期大小一致的426 bp的特异性条带(图1)。测序结果表明,扩增的条带序列与HvAV-3h基因组中所对应的基因序列同源性为100%,仅在基因的两端各增加6 bp酶切位点序列。
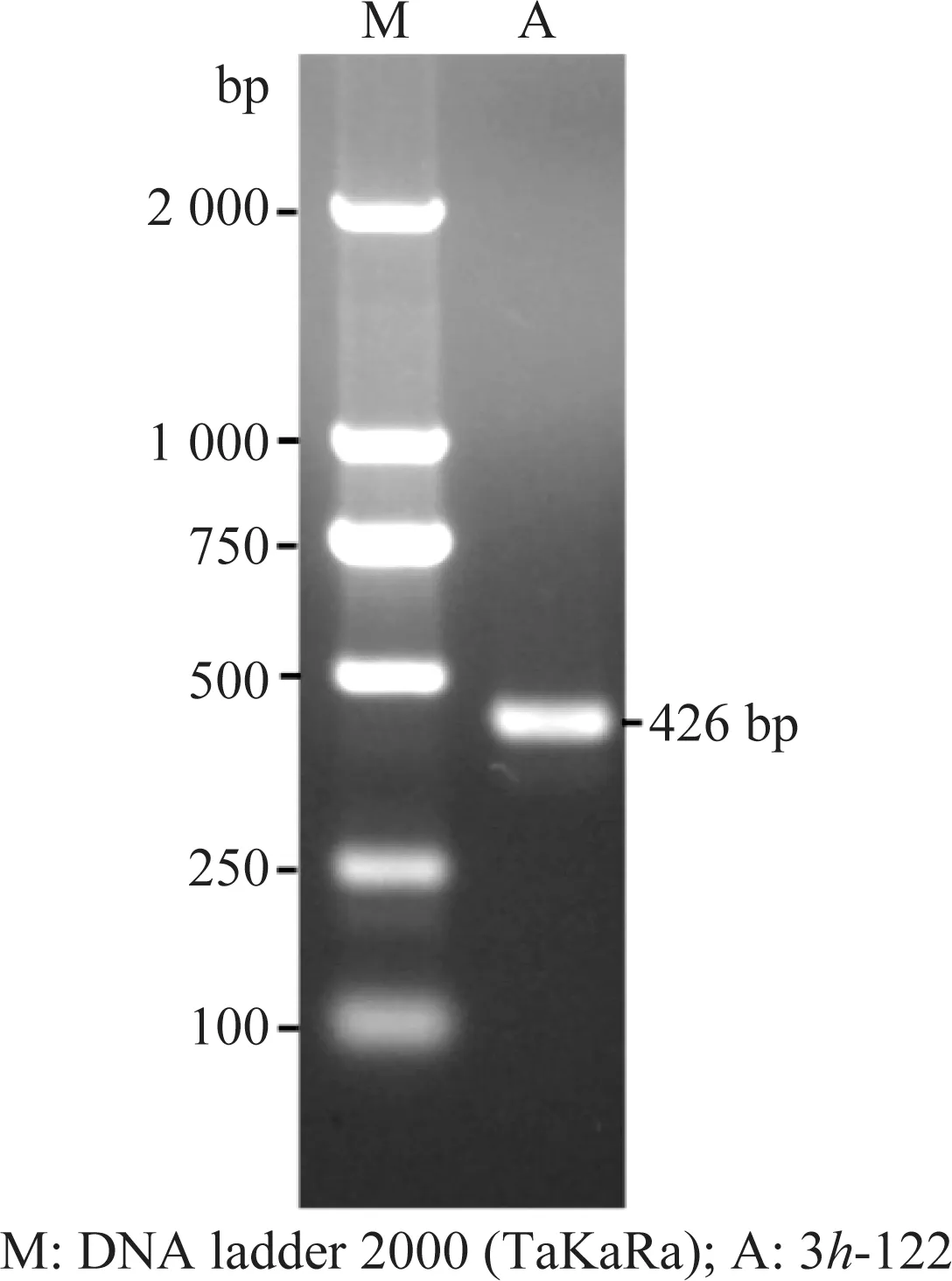
图1 烟芽夜蛾囊泡病毒3h株3h-122基因电泳图Fig.1 Agarose gel electrophoresis of 3h-122 gene of Heliothis virescens ascovirus 3h
3H-122由141个氨基酸残基组成,相对分子量为16.1 kD,理论蛋白等电点pI(protein isoelectric point)为5,无预测的跨膜结构域。序列分析表明(图2):3H-122(登录号:AYD68232.1)与来自HvAV-3e的ORF113(登录号: YP_001110966.1)、HvAV-3g的ORF129(登录号:YP_009702122.1)最为相近,相似性均为99.29%;与HvAV-3i的ORF116(登录号:AXN77299.1)、HvAV-3j的ORF124(登录号:BBB16594.1)、HvAV-3f的ORF120(登录号:YP_009701586.1)具有90%以上的序列相似性。

图2 烟芽夜蛾囊泡病毒3h株3H-122与其同源蛋白的多重序列对比Fig.2 Multiple sequences alignment of 3H-122 of Heliothis virescens ascovirus 3h and its homologues proteins
2.2 3h-122重组表达载体的构建及鉴定
对pET-28a-3h-122以BamHⅠ和Hind Ⅲ进行双酶切检测,除约5 369 bp的载体片段之外,在对应3h-122基因大小的位置可见清晰的条带(图3),表明表达载体构建成功,可用于后续的原核表达。

图3 pET-28a-3h-122双酶切鉴定Fig.3 Confirmation of pET-28a-3h-122 by double-enzyme digestion
2.3 3H-122蛋白的表达及纯化
含有pET-28a-3h-122的大肠杆菌BL21(DE3)经IPTG诱导后,SDS-PAGE电泳检测结果显示,约20 kD处有1条蛋白条带,与预期3H-122蛋白大小相符(图4)。超声破碎后的上清几乎不存在3H-122的可溶性蛋白(泳道2),证明重组蛋白主要以包涵体的形式溶解于8 mol/L尿素中(图4,泳道3)。利用His-tag亲和层析柱纯化融合蛋白,纯化的蛋白如图4黑色箭头(泳道9)所示,用于制备多克隆抗体。

图4 重组3H-122蛋白的SDS-PAGE分析Fig.4 SDS-PAGE analysis of recombinant protein 3H-122
2.4 3H-122蛋白的鉴定
对纯化的HvAV-3h病毒粒子进行了蛋白质免疫印迹分析。通过SDS-PAGE分离接种HvAV-3h后120 h的棉铃虫3龄幼虫的蛋白提取物,并使用3H-122特异性兔抗血清和GAPDH兔抗血清分别进行蛋白质印迹分析(图5)。作为宿主中的内参蛋白,GAPDH与针刺对照和感毒幼虫的提取物有反应,但不与病毒粒子蛋白提取物反应,表明病毒粒子纯化质量较高,无杂蛋白的干扰。而3H-122的特异性抗体对针刺对照幼虫没有反应,与病毒粒子蛋白提取物发生强烈反应,表明3H-122是HvAV-3h病毒粒子的结构蛋白之一。

图5 HvAV-3h纯化病毒粒子的结构蛋白免疫印迹分析Fig.5 Western blotting analysis of the structural protein in HvAV-3h virions
2.5 3h-122基因转录和表达分析
从针刺对照和HvAV-3h感染的棉铃虫3龄幼虫中提取总RNA进行RT-PCR分析,3h-122在针刺对照幼虫中无转录,接种后3 h在感毒幼虫体内检测到转录,直至168 h均可检测到稳定条带(图6a)。用12% SDS-PAGE分离不同时间的针刺对照和3龄棉铃虫幼虫的蛋白提取物,并进行蛋白免疫印迹分析,结果表明3H-122在针刺对照幼虫中无表达,在感毒幼虫体内于接种后24 h可检测到表达,直至接种后168 h 仍可检测到其表达。蛋白质大小16.1 kD,与预测的分子量一致(图6b)。
2.6 3H-122在棉铃虫体内的组织特异性检测
对棉铃虫组织进行3H-122蛋白的免疫组织化学染色,如图7所示,在针刺对照的幼虫脂肪体中未观察到绿色荧光信号,表明没有结构蛋白3H-122的表达;在感染HvAV-3h后24 h,感毒幼虫染色组织中检测到微弱的绿色荧光信号,表明有3H-122蛋白的表达;在感染HvAV-3h后72 h,荧光信号强烈且主要位于脂肪体组织和表皮周围;在感染HvAV-3h后120 h,大片组织中检测到绿色荧光,证明大量3H-122蛋白得到表达。

图6 感染HvAV-3h的棉铃虫幼虫中3h-122的转录分析与3H-122的表达分析Fig.6 Transcription analysis of 3h-122 and expression analysis of 3H-122 in HvAV-3h-infected Helicoverpa armigera larvae
3 结论与讨论
本研究利用大肠杆菌表达系统成功地表达了HvAV-3h毒株3h-122基因编码的结构蛋白(3H-122),并制备了多克隆抗体;通过RT-PCR、Western blotting以及免疫组织化学染色,对3H-122转录和表达时相以及在棉铃虫幼虫体内的组织特异性进行了分析。
结构蛋白是由病毒基因组编码,构成病毒体所必需的成分,在病毒装配、形态发生以及介导病毒感染和诱导宿主产生保护性免疫等方面发挥着重要的作用[19-20]。目前,已证明囊泡病毒结构蛋白的基本组成包括主要衣壳蛋白(major capsid proteins, MCP)、DNA结合蛋白(DNA-binding proteins, P64)、3H-117、3H-21等[12-15]。MCP最初是从斜纹夜蛾囊泡病毒2a株(TnAV-2a)中鉴定和报道的,命名为TnAV-cp,它在其他囊泡病毒中的同源物是用于研究几种相关dsDNA病毒进化的病毒体中的主要结构蛋白[19]。P64是草地贪夜蛾囊泡病毒1a株(SfAV-1a)中一种最丰富的蛋白质,作为组装期间将病毒基因组包装到病毒体中所需的结构蛋白,蛋白P64能加速病毒的复制并参与病毒粒子的装配[20]。3H-117、3H-21在所有测序的囊泡病毒中是保守的,被鉴定为HvAV-3h的结构蛋白[14-15]。
对3h-122基因在HvAV-3h感染的棉铃虫幼虫中的转录和表达时相分析发现,3h-122基因在接种HvAV-3h后3 h开始转录,但蛋白质印迹分析表明3H-122在接种后24 h才检测到表达。这种表达与转录之间存在时差的现象,在丙型肝炎病毒(hepatitis C virus, HCV)中也有报道,其结构蛋白基因在接种后16 h开始转录,而在接种后48 h才检测到表达[21];同时这种差异也存在于HvAV-3h其他结构蛋白的研究中[14-15],这可能是由于早期3H-122蛋白水平低不足以被检测到,或者也可能与囊泡病毒特殊的结构和生物学特征有关。
对3H-122的组织特异性分布的研究结果表明,其在中肠、肌肉、脂肪体组织中均有表达,在脂肪体中的表达水平最高。在接种后72 h时幼虫脂肪体破碎成碎片,已有研究报道,HvAV-3h感染会导致宿主幼虫脂肪体的破坏性病理变化[17],我们的结果也进一步证实了这一点。在杆状病毒中,菜粉蝶颗粒病毒(Pieris rapae granulovirus, PiraGV)感染会导致宿主多器官的急性病理变化,其编码的PiraGV-K颗粒体蛋白也在表皮、脂肪体、气管基质等多个组织中表达[22]。类似地,蓖麻蚕核型多角体病毒(Philosamia cynthia ricini nuclear polyhedrosis virus, PcrNPV)的Gp64是杆状病毒(cell-released virus, CRV)的主要囊膜蛋白,感染后在中肠、血淋巴及脂肪体组织中均有着较高的表达[23]。因此我们推测3H-122主要在脂肪体细胞中完成蛋白的合成,并在病毒侵染中发挥作用。

