广东花生丛枝病植原体的分子鉴定
汤亚飞, 林 祺, 佘小漫, 李正刚, 于 琳, 蓝国兵, 何自福*
(1. 广东省农业科学院植物保护研究所, 广东省植物保护新技术重点实验室, 广州 510640;2. 华南农业大学植物保护学院, 广州 510642)
植原体phytoplasma是一类专性寄生、不能人工培养的植物病原物,隶属于细菌界Bacteria软壁菌门Tenericutes柔膜菌纲Mollicutes无胆甾原体目Acholeplasmatales无胆甾原体科Acholeplasmataceae植原体暂定属Ca.genus Phytoplasma[1-2]。植原体主要通过具有刺吸式口器的昆虫传播,也可通过嫁接或菟丝子传播,寄主范围广泛,可侵染1 000多种植物,常引起丛枝、花变叶、黄化、小叶、衰退、矮化等典型症状,给农林业生产造成较大的损失[3]。中国已报道了100多种植原体相关病害[4],如枣疯病(jujube witches’-broom disease)[5-6]、小麦蓝矮病(wheat blue dwarf disease)[7-8]、马铃薯僵顶病(potato stolbur disease)[9]、樱桃丛枝或花变叶病(cherry witches’-broom or phyllody disease)[10-11]等。国际上,依据16S rRNA 基因核苷酸序列一致性、限制性片段长度多态性(restriction fragment length polymorphism,RFLP)结果对植原体进行分类,目前植原体包括52个暂定种(‘CandidatusPhytoplasma’),34个组(group)和100多个亚组(subgroup)[3]。
花生是我国重要的油料和经济作物之一,是广东省第二大农作物,全省种植面积常年保持在30万~35万hm2,仅次于水稻[12]。花生丛枝植原体(peanut witches’-broom phytoplasma,PnWB)引起花生丛枝病[13],在我国南方花生产区发生较为普遍。花生丛枝病田间主要表现为植株节间缩短,产生大量腋芽,丛生枝条上叶片变小,大多数植株不接荚果,民间俗称“花生公”,严重影响花生的产量。
我国花生丛枝病于1952年首次在广州发现[14]。该病害被发现以来,我国不少学者对其开展了相关研究,20世纪80年代初,通过昆虫介体传病试验证明华南花生丛枝病是由小绿叶蝉EmpoascaflavescensFab.传播的类菌原体(现称植原体)病[15];同年,通过电子显微镜从海南花生丛枝病病样中观察到类菌原体[16]。1994年,对华南花生丛枝病的发病规律及防治方法开展了相关研究[14]。2000年,开展了花生丛枝病病原的血清学研究[17]。随着分子生物学技术的发展,不少学者已对引起海南、云南、台湾等省花生丛枝病的相关植原体的16S rRNA、SecY、rp等多个基因进行克隆和序列分析[13,18-21]。尚未见广东花生丛枝病的植原体分子特征及相关基因序列分析的报道。本研究采用分子生物学方法对广东采集的花生丛枝病进行了病原鉴定,明确了植原体株系分类地位,为进一步开展花生植原体病害防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1样品采集
2020年10月,在广东省湛江市遂溪县花生种植地随机采集了7份花生丛枝病样,病株田间症状表现典型丛枝、小叶(图1)。

图1 广东省花生丛枝病田间症状Fig.1 Symptoms of peanut witches’-broom disease in fields in Guangdong province
1.1.2主要试剂和仪器设备
植物基因组DNA抽提试剂盒(EasyPure Plant Genomic DNA Kit)和大肠杆菌EscherichiacoliT1感受态细胞购自北京全式金生物技术有限公司;PremixTaqTM(ExTaqTMVersion 2.0 plus dye)和载体pMD 19-T购自宝生物工程(大连)有限公司;琼脂糖凝胶回收试剂盒(GeneJET Gel Extraction Kit)购自美国Thermo(赛默飞)公司;氨苄青霉素、X-Gal、蔗糖、琼脂糖和胰蛋白胨购自生工生物工程(上海)股份有限公司;GoldView核酸染料购自湖南艾科瑞生物工程有限公司;其他常规分析纯试剂购自广州市芊荟化玻仪器有限公司。T100TMThermal cycler PCR仪、Universal HoodⅡ凝胶成像系统以及电泳仪均购自美国BIO-RAD公司;植物组织自动研磨仪MM400购自德国Retsch(莱驰)公司。
1.2 试验方法
1.2.1病样总DNA提取
取待测花生病株叶片100 mg置于装有钢珠的2 mL圆底离心管,将其装入植物组织自动研磨仪的适配器,然后浸入液氮中冷却2 min左右,取出后移至主机快速固定即可开始研磨,以频率1 200次/min,时间为90 s,进行振荡破碎,结束后迅速取出粉末,按照植物DNA提取试剂盒(EasyPure Plant Genomic DNA Kit)说明书上的步骤进行总DNA抽提,DNA沉淀溶解于50 μL ddH2O中,于-20℃冰箱保存备用。
1.2.216S rRNA基因的扩增
利用扩增植原体16S rRNA基因的通用引物P1/P7[22-23]、R16mF2/R16mR1[24],对待测病样总DNA进行PCR检测,预期扩增目的片段大小分别为1.8 kb和1.4 kb。反应体系25 μL:待测样品总DNA 1 μL(约20 ng),ExTaqTMPremix 12.5 μL,上、下游引物(10 μmol/L)各 1 μL,灭菌水9.5 μL。反应程序:95℃ 预变性4 min;95℃ 1 min,55℃ 1 min,72℃ 2 min,35个循环;72℃ 延伸10 min。1%琼脂糖凝胶电泳检测PCR产物。
1.2.3SecY基因的扩增
利用扩增植原体SecY基因的通用引物L15F1/MapR1和SecYF2(Ⅱ)/SecYR1(Ⅱ)[19],对待测病样总DNA进行巢式PCR扩增,目的片段大小为1.7 kb。PCR反应体系25 μL:待测样品总DNA 1 μL (约20 ng),ExTaqTMPremix 12.5 μL,引物L15F1/MapR1 (10 μmol/L)各1 μL,灭菌水9.5 μL。反应程序:95℃ 预变性4 min;95℃ 1 min,48℃ 1 min,72℃ 2 min,30个循环;72℃延伸10 min。巢式PCR反应体系25 μL:第一轮PCR产物 1 μL,ExTaqTMPremix 12.5 μL,引物SecYF2(Ⅱ)/SecYR1(Ⅱ) (10 μmol/L)各1 μL,灭菌水9.5 μL。反应程序:95℃ 预变性4 min;95℃ 30 s,55℃ 1 min,72℃ 90 s,35个循环;72℃延伸10 min。1%琼脂糖凝胶电泳检测PCR产物。
1.2.4基因克隆与测序
采用琼脂糖凝胶回收试剂盒(Gene JET Gel Extraction Kit)回收目的条带,将回收的PCR产物连接到pMD-19T载体上。具体操作:pMD-19T 1 μL、2×solution I连接反应缓冲液5 μL、回收DNA目的片段4 μL混匀,在16℃条件下反应过夜。采用热激法将连接产物转化到大肠杆菌T1感受态细胞,在含100 μg/mL Amp、40 μL/mL X-Gal的LB固体培养基上,37℃倒置培养过夜;从每个平板随机挑取3个阳性白色单菌落送至生工生物工程(上海)股份有限公司进行测序。
1.2.5序列分析
利用DNAStar的SeqMan对测序获得的基因序列进行拼接,去掉载体序列,将所得DNA序列在GenBank数据库(http:∥www.ncbi.nlm.nih.gov)中进行BLASTn搜索,确定是否为植原体基因序列;进一步将16S rRNA基因片段序列通过植原体在线分类软件iPhyClassifier(https:∥plantpathology.ba.ars.usda.gov/cgi-bin/resource/iphyclassifier.cgi)计算相似系数和虚拟RFLP(Virtual RFLP)分析,确定其植原体组和亚组[25]。利用在线分析工具MUSCLE(https:∥www.ebi.ac.uk/Tools/msa/muscle/),将所获得的16S rRNA和SecY基因序列与已登录GenBank的相关序列进行一致性分析。采用MEGA 6.06的邻接法(neighbor joining,NJ)[26]构建基于16S rRNA和SecY基因的系统进化树,bootstrap值设置为1 000。
2 结果与分析
2.1 植原体PCR检测结果
利用扩增植原体16S rRNA的通用引物P1/P7、R16mF2/R16mR1对采集的7份花生丛枝病样进行PCR检测,结果两对引物均能从7份病样的总DNA中扩增出与预期目的片段大小一致的条带,阴性对照中未扩增出任何片段(图2a、b)。进一步利用扩增SecY基因的通用引物L15F1/MapR1和SecYF2(Ⅱ)/SecYR1(Ⅱ)对7份花生丛枝病样进行巢式PCR扩增,5份病样总DNA中扩增出与预期目的片段大小一致的特异性条带,阴性对照中未扩增出任何片段(图2c)。这些结果表明,采集于广东省湛江市遂溪县的花生丛枝病样中存在植原体。将该株系命名为广东花生丛枝植原体(PnWB-GDSX-2020)。
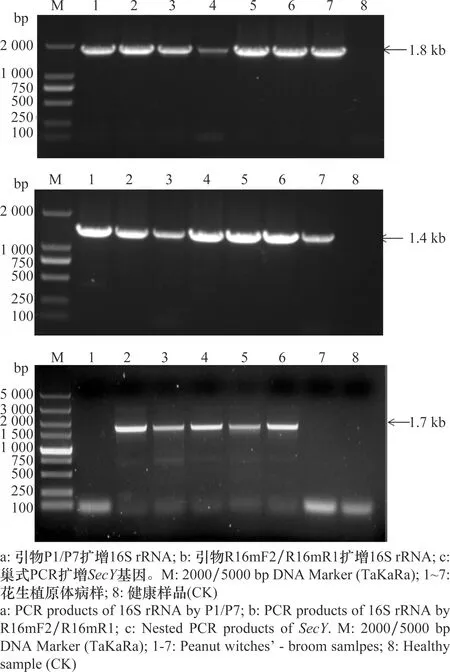
图2 花生丛枝病样中植原体16S rRNA、SecY基因PCR检测结果Fig.2 PCR detection result of 16S rRNA and SecY genes of phytoplasma in peanut witches’-broom samples
2.2 16S rRNA基因序列分析
随机挑取1个病样的PCR产物进行克隆、测序、分析,结果表明,从广东遂溪花生病样中获得的16S rRNA片段大小为1 430 bp (GenBank登录号为MZ427281),BLASTn结果显示,与该片段有较高一致性的序列均为16SrⅡ组 (Peanut WB group)成员的16S rRNA序列。进一步利用在线分析工具MUSCLE(https:∥www.ebi.ac.uk/Tools/msa/muscle/)对广东花生丛枝植原体(PnWB-GDSX-2020)的16S rRNA与GenBank数据库(https:∥www.ncbi.nlm.nih.gov/genbank/)相关序列进行了核苷酸一致性分析(表1),结果显示,PnWB-GDSX-2020与已报道的花生丛枝植原体组(16SrⅡ组)的16S rRNA核苷酸序列一致性在97%以上,与来自中国广东、海南、台湾的16SrⅡ-A、16SrⅡ-D和16SrⅡ-V亚组的11个植原体的一致性为100%,与来自中国海南和云南花生丛枝植原体的一致性为99.93%;而与其他亚组植原体的一致性较低,其中与16SrⅠ和16SrⅣ组植原体的一致性分别为89.47%和90.81%。
2.3 16S rRNA基因序列的系统进化分析
采用MEGA 6.06的邻接法构建了PnWB-GDSX-2020 16S rRNA与GenBank数据库中36个植原体的系统发育树,以柑橘黄龙病菌亚洲种广东株系(CandidatusLiberibacter asiaticus isolate Guangdong-HP)(GenBank登录号: DQ432005)的16S rRNA序列为外组。结果(图3)显示,PnWB-GDSX-2020与16Sr Ⅱ组的植原体株系聚集在一个大分支,与16Sr Ⅱ-A、16Sr Ⅱ-D、16Sr Ⅱ-V和16Sr Ⅱ-X亚组植原体株系形成一个小的分支,亲缘关系最近;而与16Sr Ⅰ和16Sr Ⅳ组的植原体亲缘关系远。

表1 PnWB-GDSX-2020与其他植原体的16S rRNA基因序列一致性1)
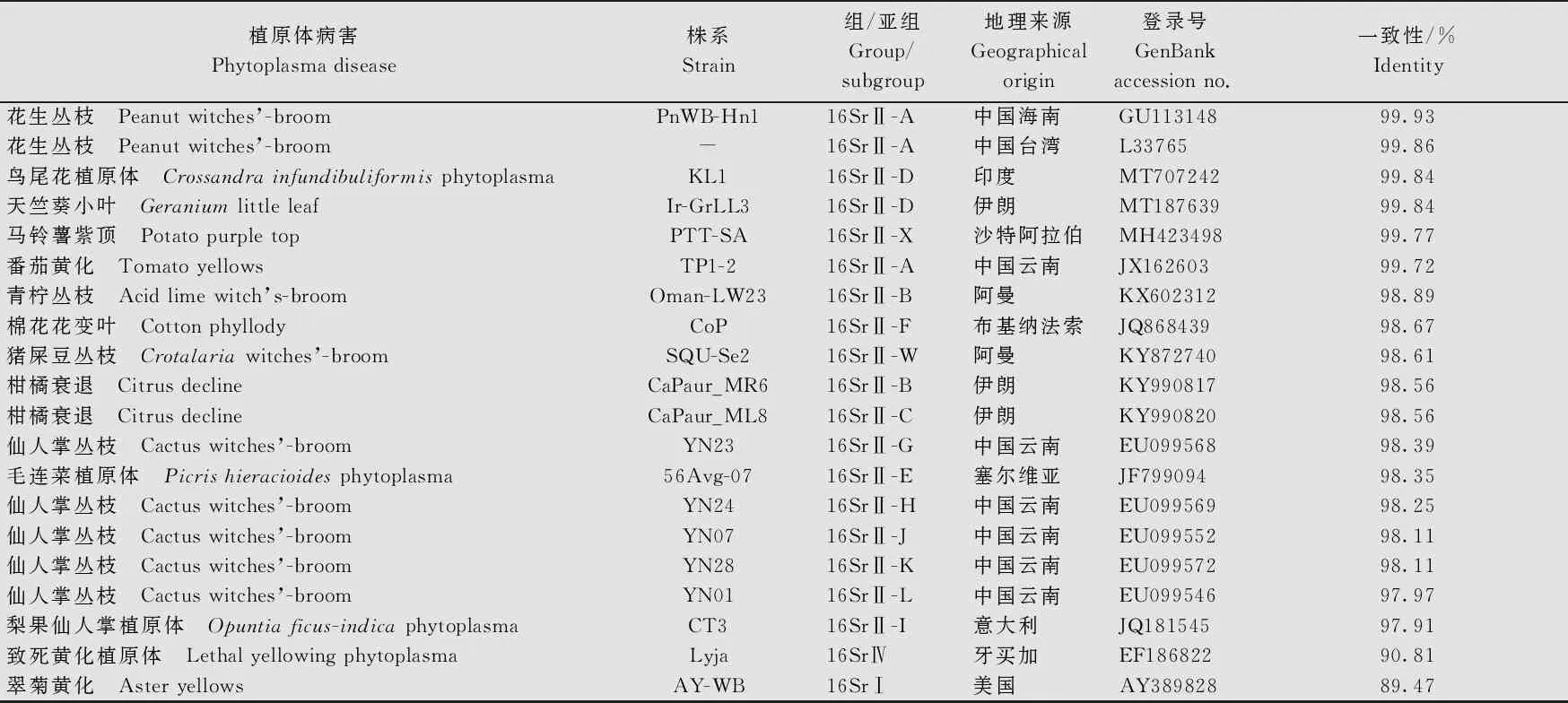
续表1 Table 1(Continued)

图3 PnWB-GDSX-2020与其他36个植原体代表株系基于16S rRNA基因序列的系统进化树Fig.3 Phylogenetic tree constructed based on 16S rRNA gene sequences of PnWB-GDSX-2020 and 36 other phytoplasmas
2.4 16S rRNA基因序列的iPhyClassifier在线分析
将获得的PnWB-GDSX-2020 16S rRNA基因序列利用植原体在线分类软件iPhyClassifier进行分析。结果显示PnWB-GDSX-2020 16S rRNA序列与‘CandidatesPhytoplasma australasiae’ 菌株(GenBank登录号:U15442)的一致性最高,为98.5%,这说明PnWB-GDSX-2020是‘CandidatusPhytoplasma australasiae’的相关菌株;PnWB-GDSX-2020 16S rRNA序列片段的17种限制性内切酶虚拟RFLP 图谱与16SrⅡ-V亚组的参照株系‘Praxelisclematidea’ phyllody phytoplasma (GenBank 登录号:KY568717) 酶切图谱一致(相似系数1.00),表明PnWB-GDSX-2020属于16SrⅡ-V亚组成员。
2.5 SecY基因序列分析
利用扩增SecY基因的通用引物,从广东遂溪花生病样总DNA中PCR扩增获得该基因片段,其大小为1 709 bp (GenBank登录号为MZ437794),其中该片段序列318-1580 nt为完整SecY基因序列,编码420个氨基酸。BLASTn结果显示,与该片段有较高一致性的序列均为16SrⅡ组成员的SecY基因序列。进一步利用在线分析工具MUSCLE对PnWB-GDSX-2020的SecY基因与GenBank数据库(https:∥www.ncbi.nlm.nih.gov/genbank/)相关序列进行核苷酸一致性分析,结果(表2)表明,PnWB-GDSX-2020与已报道的16SrⅡ组的SecY基因核苷酸序列一致性在98%以上,其中与来自中国云南、中国台湾、印度的15个植原体的SecY基因核苷酸一致性为98.83%~99.82%;而与其他亚组植原体的SecY基因核苷酸序列一致性较低,其中与16SrⅠ和16SrⅤ组植原体的一致性分别为64.05%和69.74%。进一步采用MEGA 6.06的邻接法,构建了PnWB-GDSX-2020SecY与GenBank数据库中17个植原体的系统发育树,结果(图4)显示,PnWB-GDSX-2020与16SrⅡ组的植原体株系聚集在一个大分支,亲缘关系最近;与16SrⅠ和16SrⅤ组的植原体亲缘关系远。

表2 PnWB-GDSX-2020与其他植原体的Sec Y基因序列一致性1)

图4 PnWB-GDSX-2020与其他17个植原体代表株系基于SecY 基因序列的系统进化树Fig.4 Phylogenetic tree constructed based on SecY gene sequences of PnWB-GDSX-2020 and 17 other phytoplasmas
3 结论与讨论
本研究通过PCR扩增、克隆、测序获得广东花生丛枝病相关植原体(PnWB-GDSX-2020)的16S rRNA和SecY基因序列,进一步通过对16S rRNA基因序列的iPhyClassifier在线分析、序列一致性和系统进化分析,明确广东花生丛枝病相关植原体为16SrⅡ-V亚组植原体。同时,SecY基因序列分析结果也显示,PnWB-GDSX-2020与花生丛枝植原体组的一致性最高,亲缘关系最近。广东花生丛枝病于20世纪50年代就有发生,至今仅见通过电子显微镜观察、介体和嫁接传病来鉴定其病原的报道,本文从分子水平明确了广东花生丛枝病相关植原体,并确定了其分类地位,这些结果为开展植原体16S rRNA和SecY基因序列变异与进化等研究提供了基础数据。
植原体是一类不能人工培养的植物病原细菌,分类鉴定主要依据16S rRNA、rp、SecY等保守基因序列分析。本文利用扩增16S rRNA基因的两对通用引物从7份花生病样中均扩增出条带,而经过多次试验通过SecY基因的通用引物进行巢式PCR仅能从5份病样中扩增出目的条带,其他2份病样未能扩增出条带。16S rRNA基因是植原体高度保守基因,也是目前植原体分类的主要分子依据,而rp、SecY等其他基因遗传变异较大。本文扩增SecY基因序列采用的引物位于rpl15和map基因之间,扩增的目的片段包含部分rpl15基因、完整SecY基因以及部分map基因,推测2份样品未能扩增出目的条带是由于引物结合位点的植原体基因序列发生变异导致。
植原体病害种类多,寄主范围广,已在农林领域造成严重危害。病原种类鉴定是指导相关病害防控的前提。而用于植原体检测与鉴定的技术主要有组织学观察、生物学方法、血清学检测、分子检测技术。广东省常年高温高湿,植物和介体昆虫都可以周年生长与繁殖,植原体等各类植物病害发生严重。不少学者采用不同鉴定技术对广东相关植原体病害进行鉴定。如20世纪80年代通过组织学观察和生物学方法明确广东地区的花生丛枝病、芝麻花变叶病是由植原体引起的[14,27];1994年,同样采用组织学观察和生物学方法明确水稻橙叶病是一种植原体引致的新病害[28]。随着分子生物学技术的发展,2019年通过分子检测技术明确广东枣疯病植原体属于16SrⅤ-B亚组[29],广东茄子花变叶病植原体属于16SrⅡ-D亚组[30]。本文通过分子生物学技术确定了广东花生丛枝病植原体属于16SrⅡ-V亚组,且与先前报道的茄子花变叶、豆角花变叶相关植原体16S rRNA基因序列(GenBank登录号:MH667642、MW426146)一致性100%,但茄子花变叶植原体病害发生在粤东惠州、豆角花变叶植原体病害发生在粤西湛江,由此初步推测,该植原体病害极有可能通过介体昆虫的传播在全省蔓延,这一研究结果为广东省植原体病害的防控提供了科学依据。

