急支糖浆多糖的成分分析及质量评价
刘 峰,丁浩然,王梦月,李晓波
急支糖浆多糖的成分分析及质量评价
刘 峰,丁浩然#,王梦月,李晓波*
上海交通大学,上海 200240
研究急支糖浆多糖组分的化学成分组成、重均相对分子质量以及单糖组成,并比较不同批次急支糖浆多糖组分,为其质量控制提供依据。采用比色法、高效凝胶色谱法(high performance gel permeation chromatography,HPGPC)和高效阴离子交换色谱法(high performance anion exchange chromatography,HPAEC)测定急支糖浆多糖的基本化学组成、重均相对分子质量及分散系数、单糖组成。15批急支糖浆多糖的中性多糖、糖醛酸和蛋白质的平均质量分数分别为47.60%、33.38%、9.30%;重均相对分子质量及分散系数分别为11 757~26 367和1.89~2.65。15批急支糖浆多糖中均含有岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、木糖、半乳糖醛酸及葡萄糖醛酸,平均质量分数分别为1.94、20.13、115.54、99.25、117.45、13.62、6.03、215.23、9.61 µg/mg,物质的量比结果为1.5∶14.4∶100.0∶71.6∶84.7∶9.8∶5.2∶144.1∶6.4。将急支糖浆与川贝枇杷糖浆、杏苏止咳糖浆、小儿热速清糖浆和小儿肺热咳喘口服液进行比较,结果发现单糖组成物质的量比结合HPAEC指纹图谱可用于急支糖浆多糖的质量控制。15批急支糖浆多糖的化学组成、重均相对分子质量及单糖组成具有较高的一致性,HPAEC指纹图谱具有特异性,可用作急支糖浆多糖的质控指标。
急支糖浆多糖;化学成分组成;重均相对分子质量;单糖组成;质量控制;岩藻糖;鼠李糖;阿拉伯糖;半乳糖;葡萄糖;甘露糖;木糖;半乳糖醛酸;葡萄糖醛酸
急支糖浆为临床常用中成药,由四季青、鱼腥草、金荞麦、紫菀、前胡、麻黄、枳壳、甘草8味中药制成,具清热宣肺、理气化痰的功效,用于外感风热所致的咳嗽以及急/慢性支气管炎的急性发作[1]。目前,《中国药典》2020年版急支糖浆项下仅以柚皮苷的含量为质量控制指标,不能全面地反映急支糖浆整体质量[1]。为了提升急支糖浆的质量标准,保证临床用药安全、有效,前期本课题组在全面分析急支糖浆小分子成分的基础上,建立并完善了急支糖浆的质量评价体系[2],建立了“一板多药味”高效薄层色谱法[3]、“一测多评”含量测定法[4]等高效检测方法。
除小分子成分外,多糖也是中药中一类具有重要生物活性的分子,包括抗氧化、抗炎、抗菌、免疫调节等药理活性[5-6],也是中药的重要功效成分之一,然而有关急支糖浆中大分子多糖成分的相关研究未见报道。现有对多糖的研究报道中,基于其结构的复杂性,对其质量控制的研究相对较少。《中国药典》2020年版主要是检测多糖含糖量,有苯酚-硫酸法和蒽酮-硫酸法2种经典定量方法[1],其中苯 酚-硫酸法不受蛋白质干扰,应用更普遍。进一步表征中药中多糖成分,包括相对分子质量、单糖组成,是对其进行有效质量控制的关键。高效凝胶色谱法(high performance gel permeation chromatography,HPGPC)是检测多糖相对分子质量的常用方法[7]。多糖的单糖组成分析主要方法有GC法[8]、HPLC 法[9]、高效阴离子交换色谱法(high performance anion exchange chromatography,HPAEC)[10]等,其中HPAEC可在碱性流动相条件下用阴离子交换柱将糖分离,再用脉冲安培检测器直接检测,相比于HPLC和GC柱前衍生化方法,操作简便,检测限低,且准确度和精密度均较高。
为了分析急支糖浆的多糖组分并对其进行质量控制,本研究从15批急支糖浆中制备纯化水溶性多糖,采用比色法分析基本化学组成,HPGPC法分析其重均相对分子质量,HPAEC法分析单糖组成,并建立HPAEC指纹图谱,进一步与川贝枇杷糖浆、杏苏止咳糖浆、小儿热速清糖浆和小儿肺热咳喘口服液进行比较,对单糖组成和HPAEC指纹图谱的特征性进行验证,为急支糖浆多糖成分的质量控制提供依据,为实现中药复方制剂的多糖类成分的分析提供借鉴。
1 仪器与材料
Waters Acquity Arc型液相色谱系统,配W2414示差折光检测器,美国Waters公司;ICS-5000+型高效阴离子交换色谱仪,配脉冲安培检测器,美国Thermo Fisher公司;Centrifuge 5417R型离心机,德国Eppendorf公司;BS-124S型电子分析天平,赛多利斯科学仪器(北京)有限公司;PWN85ZH型电子分析天平,奥豪斯仪器(常州)有限公司;SB-5200DTD型超声波清洗仪,宁波新芝生物科技有限公司;UV1901型紫外可见分光光度计,上海棱光技术有限公司。
对照品-鼠李糖(批号32800,质量分数99%)、-阿拉伯糖(批号L1409050,质量分数98%)、-半乳糖(批号C518024,质量分数99%)、-葡萄糖(批号H1631033,质量分数99.5%)、-甘露糖(批号A1523056,质量分数99%)、α-乳糖(批号L102285,质量分数99.5%)、-果糖(批号F108332,质量分数99.5%)均购自上海阿拉丁生化科技股份有限公司;对照品-木糖(批号DHUNI-QQ,质量分数98%)购自上海梯希爱化成工业发展有限公司;对照品-半乳糖醛酸(批号P1201886,质量分数97%)购自阿达玛斯试剂有限公司;对照品-葡萄糖醛酸(批号10194134,质量分数98%)购自赛默飞世尔科技(中国)有限公司;对照品-岩藻糖(批号X16N8Y48166,质量分数98%)、盐酸氨基葡萄糖(批号MFCD00135831,质量分数99%),SP132594-3500再生纤维素透析袋均购自上海源叶生物科技有限公司;Waters葡聚糖系列对照品,相对分子质量分别为1030(批号dxt010218wa)、4410(批号dxt020218wa)、8500(批号dxt030218wa)、15 400(批号dxt040218wa)、30 000(批号dxt050218wa)、50 400(批号dxt060218wa)、87 000(批号dxt070218wa)、225 000(批号dxt100218wa),由上海交通大学分析测试中心提供;三氟乙酸、乙酸钠、醋酸铵、甲酸、氢氧化钠、硝酸钠,HPLC级,购自上海安谱实验科技股份有限公司;乙腈(LC-MS级)德国Merck公司;Braford蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;超纯水使用Millipore Milli-Q超滤系统制备;盐酸、甲醇、三氯甲烷、氯化钠、四硼酸钠、硫酸、丙酮、乙醚、乙醇、正丁醇、间羟基联苯、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)等试剂均为分析纯,均购自上海国药集团化学试剂有限公司。
15批急支糖浆,批号分别为19040073、19040074、19040075、19040077、19040079、19040081、19040086、19040088、19040089、19040090、19040097、19040098、19040101、19040114、19040116,分别编号S1~S15,太极集团重庆涪陵制药厂有限公司;川贝枇杷糖浆购自昭通市骅成制药有限公司,批号为201120,编号S16;小儿热速清糖浆购自河南金鸿堂制药有限公司,批号为20201103,编号S17;杏苏止咳糖浆购自湖北诺得胜制药有限公司,批号为210303,编号S18;小儿肺热咳喘口服液购自黑龙江葵花药业股份有限公司,批号为202101104,编号S19。
2 方法与结果
2.1 急支糖浆多糖的制备
将100 mL装急支糖浆振摇混匀,精密量取急支糖浆10 mL,缓慢加入5倍量无水乙醇,4 ℃静置12 h,1500 r/min离心5 min,滤过得沉淀。将沉淀于60 ℃水浴蒸干,于20 mL水复溶,加入5 mL Sevage试剂[三氯甲烷-正丁醇(4∶1)],剧烈震荡混匀,3000 r/min离心10 min,滤过得上清液。将上清液于60 ℃水浴蒸干,减压干燥后得粗多糖。将粗多糖复溶于20 mL超纯水,加入0.232 g氯化钠,震荡混匀,再加入5 mL质量浓度为20 mg/mL的CTAB水溶液,4 ℃静置12 h,3000 r/min离心10 min,滤过得上清液。向上清液缓慢加入5倍量无水乙醇,4 ℃静置12 h,1500 r/min离心5 min,滤过得沉淀,加20 mL超纯水复溶,置于相对分子质量3500的再生纤维素膜中,流水透析48 h,冻干,即得急支糖浆多糖,计算其得率,结果见表1。
表1 15批急支糖浆多糖的制备得率及中性多糖、糖醛酸和蛋白质含量
Table 1 Yield and proportion of neutral polysaccharide, uronic acid and protein of 15 batches Jizhi Syrup polysaccharides
编号批号制备得率/%中性多糖/%糖醛酸/%蛋白质/%总和/%编号批号制备得率/%中性多糖/%糖醛酸/%蛋白质/%总和/% S1190400730.7872.1120.565.7798.44S9190400890.8444.1037.5311.3592.98 S2190400740.7549.5833.608.6191.79S10190400900.6543.0836.7212.7092.50 S3190400750.5842.3229.9610.3482.62S11190400970.7547.3834.4111.5593.34 S4190400770.6741.2437.9513.6392.82S12190400980.8845.2337.857.5590.63 S5190400790.6238.1333.6111.1982.93S13190401010.6650.6935.668.3994.74 S6190400810.5943.3632.756.7682.87S14190401140.6850.9929.346.0186.34 S7190400860.6745.4335.228.8689.51S15190401160.6752.5634.556.3193.42 S8190400880.6747.7530.9810.4289.15 平均值0.7047.6033.389.3090.27
2.2 急支糖浆多糖的基本化学组成测定
2.2.1 中性多糖 采用苯酚-硫酸法[11]测定急支糖浆多糖的中性多糖含量。精密称取-葡萄糖标准品5.00 mg,用蒸馏水定容于50 mL量瓶,得质量浓度100.0 µg/mL的葡萄糖母液。分别精密量取0、0.2、0.4、0.6、0.8、1.0 mL的-葡萄糖母液于20 mL具塞试管中,补加蒸馏水至1.0 mL,配成系列质量浓度为20、40、60、80、100 µg/mL的-葡萄糖对照溶液;按照文献报道的方法[11],依次加入5%苯酚溶液1 mL和浓硫酸5 mL,待反应完成后,使用紫外分光光度仪于490 nm下检测吸光度()值。以对照品质量浓度为横坐标(),以值为纵坐标(),得-葡萄糖的线性回归方程为=0.035 3+0.014 7,r=0.998 1,线性范围为2.86~14.29 µg/mg。
2.2.2 糖醛酸 采用间羟基联苯法[12]测定急支糖浆多糖的糖醛酸含量。精密称取-半乳糖醛酸标准品10.00 mg,用蒸馏水定容于10 mL量瓶,得质量浓度1.0 mg/mL的-半乳糖醛酸母液,精密量取0、0.2、0.4、0.6、0.8、1.0 mL-半乳糖醛酸母液于10 mL量瓶中,加蒸馏水定容,配成系列质量浓度为20、40、60、80、100 µg/mL的-半乳糖醛酸对照溶液。按照文献报道的方法[12],依次吸取-半乳糖醛酸对照溶液0.5 mL、四硼酸钠硫酸溶液3 mL和间羟基联苯溶液50 µL于20 mL具塞试管,待反应完成后,使用紫外分光光度仪于520 nm下检测值。以对照品质量浓度为横坐标(),以值为纵坐标(),得-半乳糖醛酸的线性回归方程为=0.030 8+0.016 1,r=0.998 6,线性范围为2.82~14.08 µg/mg。
2.2.3 蛋白质 依照Bardford法[13]原理采用试剂盒测定急支糖浆多糖的蛋白质含量。以5.0 mg/mL BSA蛋白溶液为母液,加水依次稀释成1000、750、500、250、125、62.5 µg/mL的BSA蛋白对照品溶液。按照文献报道的方法[13],依次吸取50 µL BSA蛋白对照品溶液、50 µL水和2.5 mL考马斯亮蓝G250溶液于20 mL具塞试管,待反应完成后,使用紫外分光光度仪于595 nm下检测值。以对照品质量浓度为横坐标(),值为纵坐标(),得BSA蛋白的线性回归方程为=0.014 4-0.002 6,=0.998 5,线性范围为1.20~19.23 µg/mg。
2.2.4 样品测定 同时检测15批急支糖浆多糖样品的值,平行测定2次。采用标准曲线法,分别对15批急支糖浆多糖的中性多糖、糖醛酸和蛋白质进行含量计算。结果(表1)显示,15批急支糖浆多糖的中性多糖的平均质量分数为47.60%、糖醛酸的平均质量分数为33.38%,蛋白质的平均质量分数为9.30%。上述中性多糖、糖醛酸和蛋白质的平均质量分数之和为90.27%,可以确认15批急支糖浆多糖的基本化学组成中已知成分含量较高。
2.3 急支糖浆多糖的重均相对分子质量测定
采用HPGPC法[10,14]测定急支糖浆多糖的重均相对分子质量及分散系数(重均相对分子质量/数均相对分子质量)。
2.3.1 HPGPC色谱条件 使用Acquity Arc液相色谱系统;Waters Ultrahydrogel Linear色谱柱(300 mm×7.8 mm,10 μm);柱温30 ℃;流动相为0.1 mol/L NaNO3;体积流量为0.3 mL/min;进样量20 µL;洗脱时间50 min。以Waters葡聚糖系列对照品(相对分子质量1030~225 000)作对照,计算所测样品的相对分子质量信息。
2.3.2 供试品溶液的制备 精确称取3.00 mg急支糖浆多糖样品,加超纯水配制成质量浓度为3.00~3.50 mg/mL的急支糖浆多糖供试品溶液,按“2.3.1”项色谱条件进样分析,平行测定15批急支糖浆多糖供试品溶液。
2.3.3 15批急支糖浆多糖的重均相对分子质量 15批急支糖浆多糖的HPGPC图谱如图1所示,色谱峰A的保留时间在24.0~34.0 min,色谱峰B的保留时间在34.0~35.0 min,色谱峰C的保留时间在35.0~38.0 min,参照对照品数据依次计算重均相对分子质量和分散系数,结果如表2。色谱峰A、B、C的重均相对分子质量均值分别为19 675、1453、443,说明保留时间越小,则重均相对分子质量越大,其中色谱峰B、C的重均相对分子质量为寡糖量级,色谱峰A的重均相对分子质量在多糖量级,是急支糖浆多糖的主要色谱峰(简称主峰)。基于主峰重均相对分子质量均值为19 675(RSD为28.43%),占比均值在82.72%,以六碳糖相对分子质量180计算,急支糖浆多糖糖链的含糖个数在120个以上;主峰分散系数均值为2.39,相对分子质量跨度大,说明急支糖浆多糖为非均一多糖。使用SPSS 25.0软件对15批急支糖浆多糖进行相似度分析,结果(表2)显示,与对照图谱相比,S2、S4、S7~S15的相似度大于0.90,S1的相似度为0.88,S3、S5的相似度在0.78~0.80,表明不同批次间的相似度差异可能是原药材的来源不同造成的。
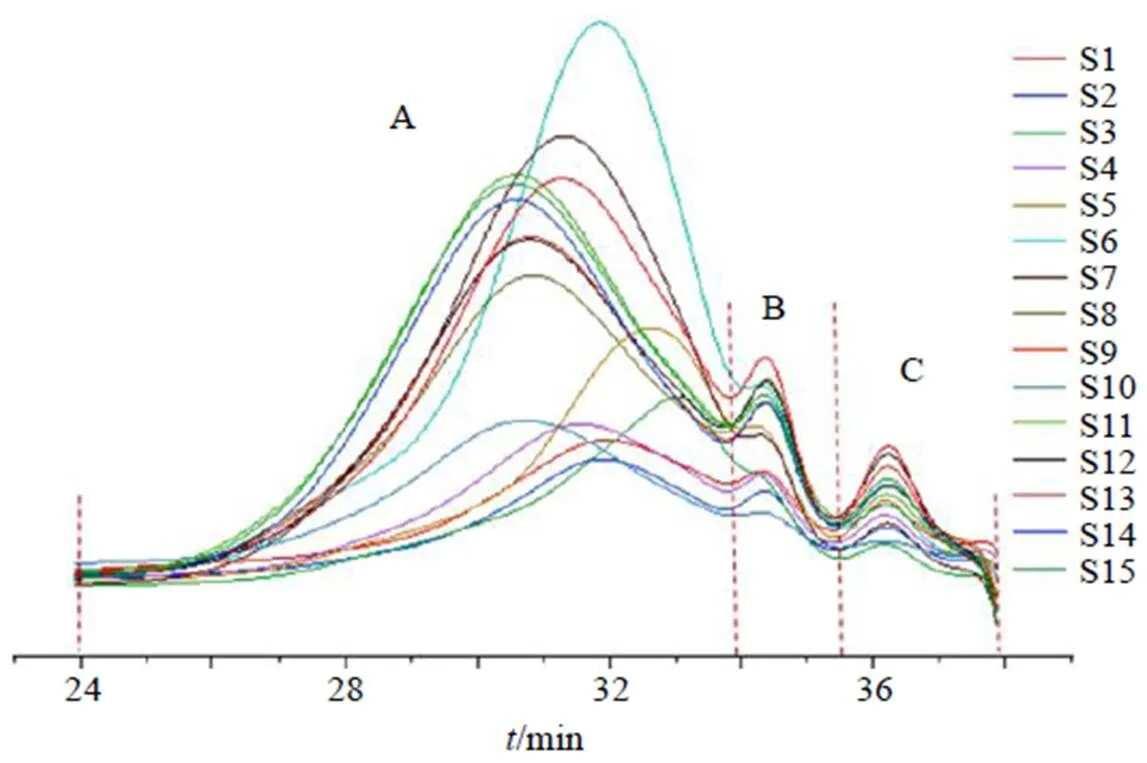
图1 15批急支糖浆多糖的HPGPC图谱
2.4 急支糖浆多糖的单糖组成分析
采用HPAEC法[9],测定急支糖浆多糖酸水解后的单糖组成。
2.4.1 HPAEC色谱条件 使用ICS-5000+高效阴离子交换色谱仪,Thermo CarboPac PA100色谱柱(250 mm×9 mm,);淋洗液:50 mmol/L氢氧化钠溶液(A)-1 mol/L乙酸钠溶液(B)-200 mmol/L氢氧化钠溶液(C)-水(D),淋洗梯度洗脱条件:0~10 min,10% A,90% D;10~10.1 min,0~8% C,90%~92% D;10.1~15 min,8%~10% C,92%~90% D;15~35 min,10%~32% C,90%~68% D;35~37 min,32%~100% C;37~40 min,100% C;40~60 min,15% B,40% C,45% D;60~65 min,100% C。检测波长250 nm;柱温30 ℃;体积流量0.5 mL/min;进样量5 µL。脉冲安培检测器采用糖标准四电位波形。
表2 15批急支糖浆多糖的重均相对分子质量、主峰分散系数、峰面积占比及相似度
Table 2 Results of weight-average molecular weights, main peak polydispersity index, peak area ratio and similarities of 15 batches of Jizhi Syrup polysaccharides
编号重均相对分子质量主峰分散系数主峰峰面积占比/%相似度编号重均相对分子质量主峰分散系数主峰峰面积占比/%相似度 A峰B峰C峰A峰B峰C峰 S112 08815044531.8974.570.875 6S1024 91514574572.5590.310.964 1 S212 78915094511.9376.320.903 3S1126 24714664462.6585.220.957 0 S313 15614184482.4981.200.783 8S1223 05315104452.4579.670.983 3 S415 53214964532.1280.300.963 5S1320 50314774442.5181.760.996 3 S511 75713464192.2180.260.792 3S1425 34315094432.4683.670.954 2 S615 73912674172.3690.500.941 8S1526 36714834462.6382.780.956 3 S719 89113524442.5291.860.988 3平均值19 67514534432.3982.72− S824 19415104402.5480.460.985 5RSD/%28.45.12.510.06.0− S923 55214924442.4781.870.982 2
2.4.2 急支糖浆多糖的单糖供试品溶液制备 精确称取急支糖浆多糖3 mg,置于20 mL具塞试管中,加入1 mL 2 mol/L三氟乙酸溶液,置于100 ℃烘箱中水解6 h,50 ℃氮气吹干水解液。残渣加少量甲醇复溶,吹干,重复3次。将急支糖浆多糖的酸水解残渣复溶于2 mL超纯水得急支糖浆多糖酸水解溶液,精密吸取0.5 mL急支糖浆多糖酸水解溶液,加10%乙醇定容于5 mL量瓶中,震荡摇匀,10 000 r/min离心10 min,取上清液,即得急支糖浆多糖的单糖供试品溶液。
2.4.3 单糖混合对照品溶液 精密称取2.00 mg单糖,加水配制成质量浓度分别为1.066、1.048、1.030、1.112、1.050、0.992、2.598、1.136、1.054 mg/mL的-鼠李糖、-阿拉伯糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-半乳糖醛酸、-葡萄糖醛酸、-岩藻糖对照品溶液,精密吸取-鼠李糖、-甘露糖对照品溶液80 µL,-阿拉伯糖、-半乳糖、-葡萄糖、-半乳糖醛酸对照品溶液400 µL,-木糖、-葡萄糖醛酸、-岩藻糖对照品溶液40 µL于10 mL量瓶中,加水定容至刻度线,即得单糖混合对照品溶液。
2.4.4 线性关系、定量限、检测限考察 取“2.4.3”项下单糖混合对照品溶液适量,加10%乙醇分别稀释2、5、10、20、50倍,配制成系列质量浓度的单糖混合对照品溶液。将系列质量浓度的混合对照品溶液按照“2.4.1”项下色谱条件进样测定,记录峰面积。以对照品质量浓度为横坐标(),以峰面积为纵坐标()进行线性回归,得回归方程。以峰高信号在基线噪音高的10倍确定定量限,以峰高信号在基线噪音高的3倍确定检测限。-岩藻糖的回归方程为=1.201+0.178,2=0.998,线性范围为0.08~4.22 µg/mL,定量限和检测限分别为0.022、0.011 µg/mL;-鼠李糖的回归方程为=0.465+0.104,2=0.999,线性范围为0.17~8.53 µg/mL,定量限和检测限分别为0.011、0.005 µg/mL;-阿拉伯糖的回归方程为=1.041+2.281,2=0.997,线性范围为0.84~41.92 µg/mL,定量限和检测限分别为0.052、0.026 µg/mL;-半乳糖的回归方程为=1.101+3.020,2=0.995,线性范围为0.82~41.20 µg/mL,定量限和检测限分别为0.103、0.052 µg/mL;-葡萄糖的回归方程为=1.455+3.075,2=0.997,线性范围为0.89~44.48 µg/mL,定量限和检测限分别为0.111、0.056 µg/mL;-甘露糖的回归方程为=0.737+0.195,2=0.998,线性范围为0.17~8.40 µg/mL,定量限和检测限分别为0.084、0.021 µg/mL;-木糖的回归方程为=1.902-0.019,2=1.000,线性范围为0.08~3.97 µg/mL,定量限和检测限分别为0.020、0.010 µg/mL;-半乳糖醛酸的回归方程为=0.117+0.774,2=0.997,线性范围为2.02~103.92 µg/mL,定量限和检测限分别为0.260、0.130 µg/mL;-葡萄糖醛酸的回归方程为=0.134+0.013,2=1.000,线性范围为0.09~4.54 µg/mL,定量限和检测限分别为0.091、0.023 µg/mL。结果表明,9种单糖在各自检测质量浓度范围内线性关系良好。
2.4.5 精密度试验 取急支糖浆多糖样品(批号190400790),按“2.4.2”项下样品处理方法制备急支糖浆多糖供试品溶液,按“2.4.1”项下色谱条件进样,连续进样6次,记录峰面积。结果显示,-岩藻糖、-鼠李糖、-阿拉伯糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-半乳糖醛酸、-葡萄糖醛酸峰面积的RSD分别为1.2%、1.5%、2.3%、2.4%、2.2%、1.8%、3.1%、1.0%、1.8%,表明该仪器的精密度良好。
2.4.6 重复性试验 取急支糖浆多糖样品(批号190400790),平行制备6份急支糖浆多糖的单糖供试品溶液,按照“2.4.1”项下色谱条件分别进样,记录峰面积。结果显示,-岩藻糖、-鼠李糖、-阿拉伯糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-半乳糖醛酸、-葡萄糖醛酸峰面积的RSD分别为1.3%、2.2%、1.8%、1.6%、1.6%、2.5%、1.6%、1.8%、2.3%,表明样品制备工艺稳定,试验重复性良好。
2.4.7 稳定性试验 取急支糖浆多糖的单糖供试品溶液(批号190400790),分别于室温放置下0、3、6、9、12、18、24 h时按照“2.4.1”项下色谱条件进样测定,记录峰面积。结果显示,-岩藻糖、-鼠李糖、-阿拉伯糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-半乳糖醛酸、-葡萄糖醛酸峰面积的RSD分别为4.5%、4.8%、3.1%、3.1%、2.1%、2.9%、2.3%、4.3%、3.7%,表明单糖供试品溶液在室温下放置24 h内稳定性良好。
2.4.8 加样回收率试验 基于实测1 mg急支糖浆多糖(批号19040088)酸水解产物中含-鼠李糖、-阿拉伯糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-半乳糖醛酸、-葡萄糖醛酸、-岩藻糖单糖的质量为22.38、125.21、103.90、123.58、16.05、7.08、247.97、10.56、2.40 μg。向3 mg急支糖浆多糖中加入约等量的9种单糖,参照“2.4.2”项下平行制备6份急支糖浆多糖的单糖供试品溶液,按照“2.4.1”项下色谱条件进样测定,记录峰面积并计算加样回收率。结果显示,-岩藻糖、-鼠李糖、-阿拉伯糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-半乳糖醛酸、-葡萄糖醛酸的平均回收率分别为101.5%、99.5%、99.4%、100.3%、98.5%、100.7%、99.0%、99.9%、99.1%,RSD分别为1.5%、3.0%、0.6%、1.4%、0.9%、4.0%、4.7%、4.0%、4.0%,表明该方法准确可靠。
2.4.9 急支糖浆多糖的单糖组成的HPAEC指纹图谱的建立及相似度分析 平行制备15批次急支糖浆多糖及其单糖供试品溶液,按照“2.4.1”项下色谱条件下对急支糖浆多糖的单糖供试品溶液进行检测,并测得其单糖组成的HPAEC图谱,结果如图2所示。使用SPSS 25.0对多批次相似度分析(表3),结果显示,与对照图谱比较15批单糖组成相似度在0.943 0~0.977 9,一致性良好。采用对照品对色谱图中14个色谱峰中的12个峰进行指认,见图3-A。结果表明,在该条件下,可检测到急支糖浆多糖中的9种单糖成分-岩藻糖、-鼠李糖、-阿拉伯糖、盐酸氨基葡萄糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-果糖、2种糖醛酸成分-半乳糖醛酸、-葡萄糖醛酸及1种二糖成分α-乳糖。基于含量低或分离度低等原因,本研究仅对除盐酸氨基葡萄糖、-果糖、α-乳糖外的7个单糖及2个糖醛酸成分定量。单糖混合对照品图谱见图3-B。
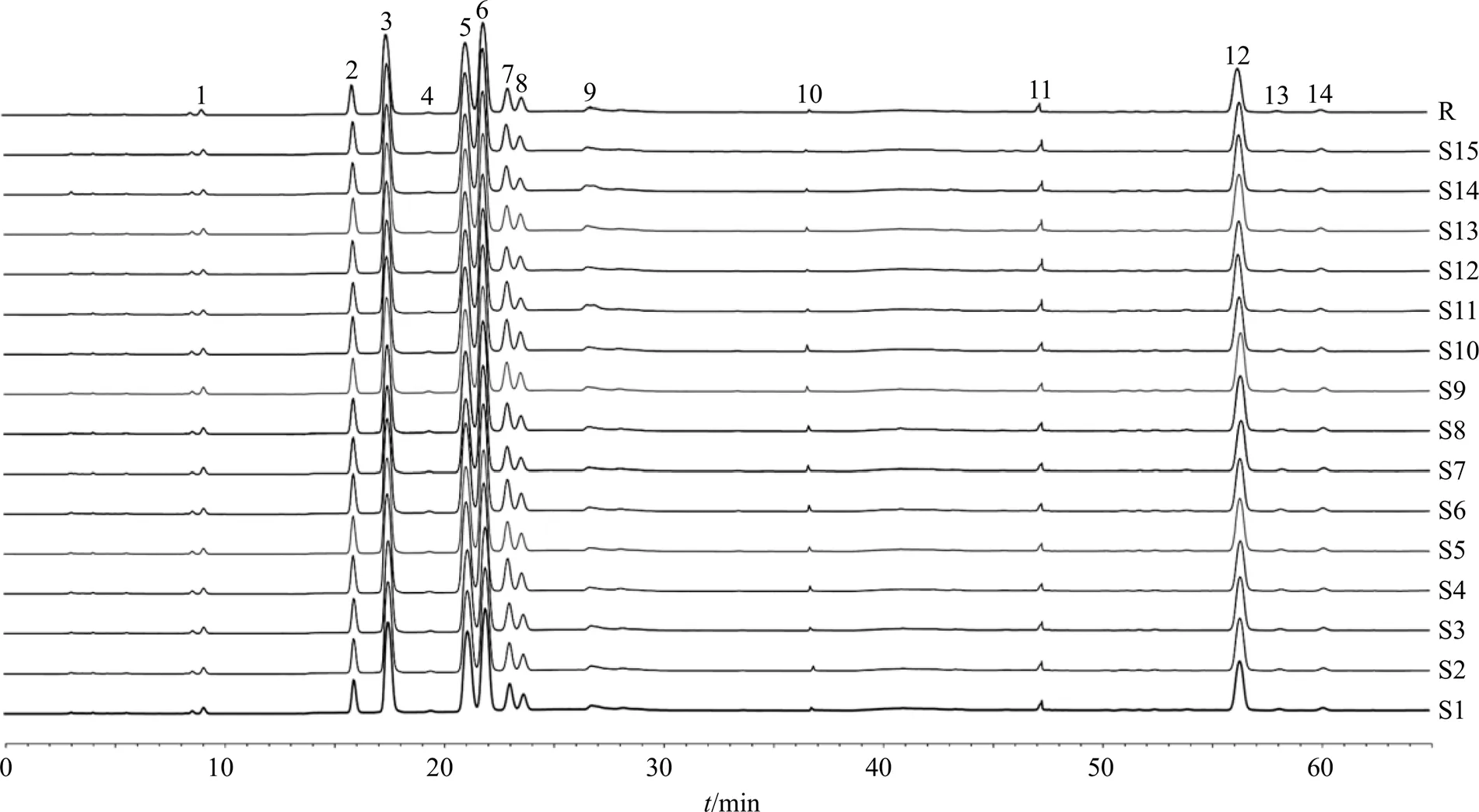
图2 15批急支糖浆多糖的单糖组成的HPAEC图谱
表3 HPAEC下15批急支糖浆多糖中各单糖含量及组成物质的量比(n = 2)
Table 3 Contents and molar ratio of monosaccharides in 15 batches of Jizhi Syrup polysaccharides monosaccharides by HPAEC (n = 2)
编号质量分数/(μg∙mg−1)相似度 L-岩藻糖L-鼠李糖D-阿拉伯糖D-半乳糖D-葡萄糖D-甘露糖D-木糖D-半乳糖醛酸D-葡萄糖醛酸总量 S11.6321.78114.73100.71107.0817.436.02207.1918.81595.370.977 9 S21.6922.26110.1798.24102.8016.486.44217.769.02584.870.967 0 S31.9626.61111.32114.26120.4318.796.57245.9711.38657.280.965 6 S42.0825.54116.87110.0388.8811.824.99236.748.58605.520.961 8 S52.4326.72117.36106.64120.1318.535.96278.3811.59687.740.961 4 S62.0521.5389.8771.26118.8412.394.73254.1110.11584.890.963 3 S71.6218.1182.3678.86112.9212.414.64237.8811.79560.590.960 5 S82.4022.38125.21103.90123.5816.057.08247.9710.56659.130.954 4 S92.1019.69133.14109.93135.7913.047.46217.908.39647.440.961 1 S101.8819.14136.64109.29132.0714.027.65201.058.90630.660.950 0 S112.0215.47129.73102.57128.2713.275.17168.416.32571.240.943 3 S121.5214.41114.1792.06107.099.045.47159.567.81511.120.943 0 S132.1618.02121.57104.73113.7710.127.03226.867.33611.580.946 3 S141.8114.83111.9791.63121.6310.265.14169.926.34533.540.945 2 S151.8015.41117.9894.67128.4610.706.13158.697.19541.010.944 5 平均值1.9420.13115.5499.25117.4513.626.03215.239.61598.80− 物质的量/(mmol∙g−1)0.0120.1120.7700.5510.6520.0760.0401.1090.0503.369− 物质的量比1.514.4100.071.684.79.85.2144.16.4−−
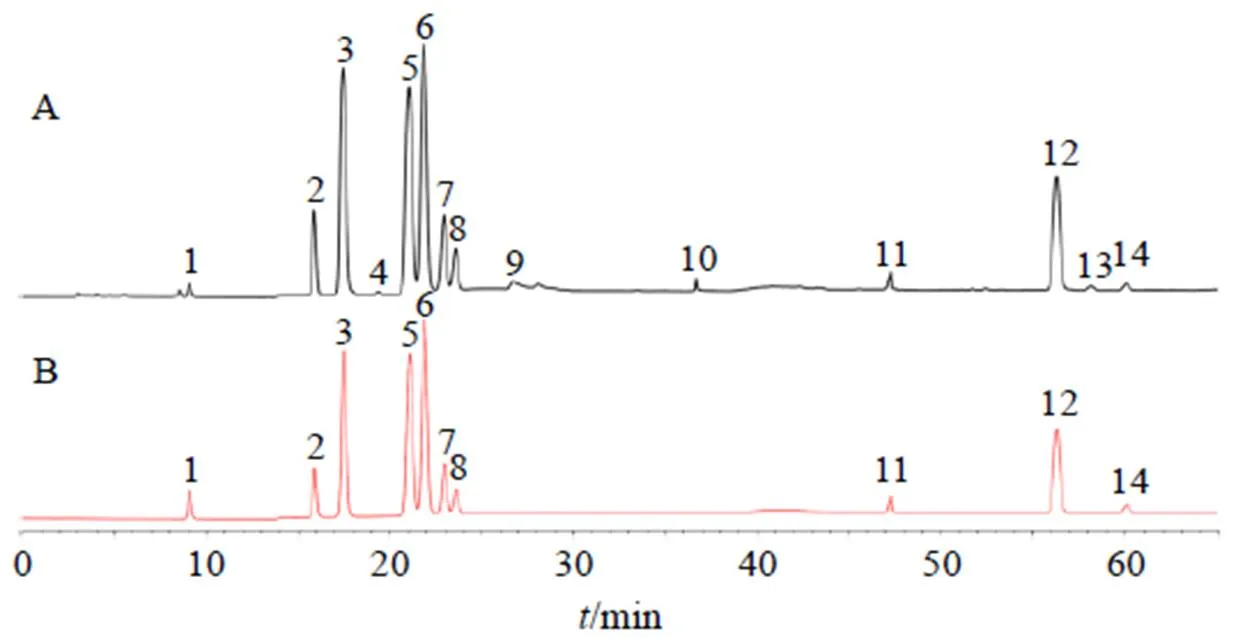
1-L-岩藻糖 2-L-鼠李糖 3-D-阿拉伯糖 4-盐酸氨基葡萄糖 5-D-半乳糖 6-D-葡萄糖 7-D-甘露糖 8-D-木糖 9-D-果糖 10-α-乳糖 12-D-半乳糖醛酸 14-D-葡萄糖醛酸
2.4.10 15批急支糖浆多糖的单糖组成的定量分析 15批急支糖浆多糖的单糖供试样品中-岩藻糖、-鼠李糖、-阿拉伯糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-半乳糖醛酸、-葡萄糖醛酸的平均质量分数分别为1.94、20.13、115.54、99.25、117.45、13.62、6.03、215.23、9.61 µg/mg,以-阿拉伯糖的物质的量为100.0,急支糖浆多糖的单糖组成物质的量比-岩藻糖、-鼠李糖、-阿拉伯糖、-半乳糖、-葡萄糖、-甘露糖、-木糖、-半乳糖醛酸、-葡萄糖醛酸为1.5∶14.4∶100.0∶71.6∶84.7∶9.8∶5.2∶144.1∶6.4。急支糖浆多糖的单糖总质量分数的平均值为598.80 µg/mg,占急支糖浆多糖总质量的59.90%,在基本化学组成测定中,中性多糖和糖醛酸之和占80.98%,单糖回收率在74.00%,15批次单糖组成测定的具体结果见表3。
单糖回收率=可测得单糖类成分总质量/多糖质量
2.4.11 急支糖浆多糖与其他4种中药复方制剂多糖的单糖组成比较 为验证本方法测定的急支糖浆多糖的HPAEC指纹图谱的特异性,引入2个与急支糖浆相似配伍的中药复方制剂和2个与急支糖浆配伍相异的中药复方制剂(表4),同样测得各中药复方制剂多糖的单糖组成HPAEC图如图4所示。川贝枇杷糖浆、杏苏止咳糖浆、小儿热速清糖浆、小儿肺热咳喘口服液多糖均含有9种单糖/糖醛酸,但单糖组成比例有差异(表5)。使用SPSS 25.0,将这4种中药复方制剂多糖的HPAEC指纹图谱与急支糖浆多糖进行相似度分析,结果为0.904 6~0.957 7,其中杏苏止咳糖浆(相似配伍)、川贝枇杷糖浆(相异配伍)与急支糖浆多糖的单糖组成相似度分别为0.944 9和0.957 7,整体相似度较高,这源于组成多糖的单糖类型是有限的。
表4 急支糖浆与其他4种中药复方制剂的药材组成
Table 4 Herbs of Jizhi Syrup and other four Chinese patent medicine preparations
中药复方制剂配伍处方药材 急支糖浆−四季青、鱼腥草、金荞麦、紫菀、枳壳、前胡、麻黄、甘草 川贝枇杷糖浆相异川贝母流浸膏、桔梗、枇杷叶、薄荷脑 小儿热速清糖浆相异柴胡、黄芩、板蓝根、葛根、金银花、水牛角、连翘、大黄 小儿肺热咳喘口服液相似麻黄、苦杏仁、石膏、甘草、金银花、连翘、知母、黄芩、板蓝根、麦冬、鱼腥草 杏苏止咳糖浆相似紫苏叶、前胡、苦杏仁、陈皮、桔梗、甘草
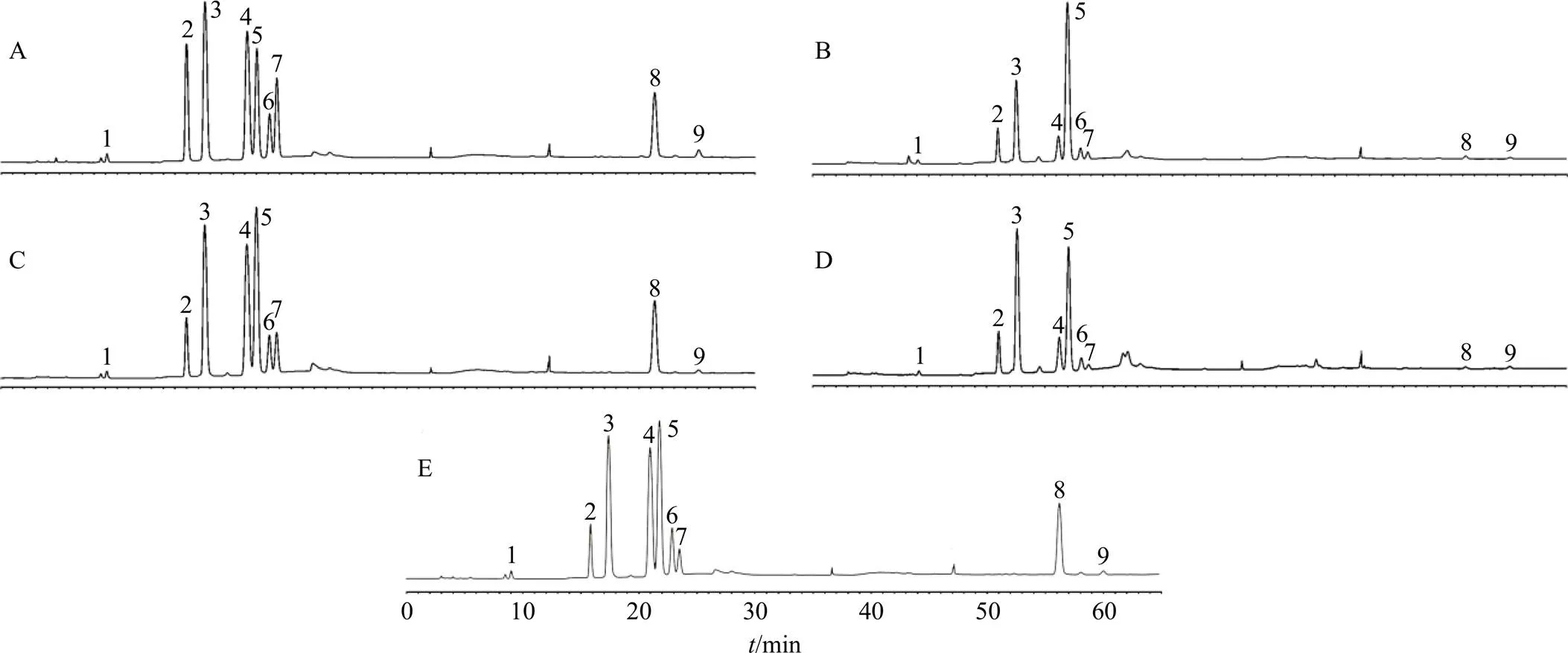
1-L-岩藻糖 2-L-鼠李糖 3-D-阿拉伯糖 4-D-半乳糖 5-D-葡萄糖 6-D-甘露糖 7-D-木糖 8-D-半乳糖醛酸 9-D-葡萄糖醛酸
为进一步考察主要成分对15批急支糖浆多糖样品与其他4种中药复方制剂多糖(S16~S19)的差异性,将9个单糖的含量测定结果进行归一化处理后导入SIMCA 14.1软件进行主成分分析(principal component analysis,PCA),得分见图5-A。结果发现15批次急支糖浆多糖样品被明显归为1组,其他4中复方制剂多糖呈明显离散状态。主成分荷载散点图(图5-B)显示,以横纵坐标绝对值大于0.3为标准,-岩藻糖、-半乳糖和-鼠李糖是区分急支糖浆多糖与其他4批中药复方制剂多糖的主要贡献成分。将9个单糖的含量测定结果进行归一化处理后导入SIMCA-P 14.1软件进行正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA),得分图见图5-C。通过提取OPLS-DA模型中9个变量的重要值(variable importance plot,VIP),以VIP>1为标准,筛选出了4个成分,结果见图5-D,按VIP值大小排序分别为-岩藻糖、-葡萄糖、-半乳糖和-鼠李糖。通过以上分析发现,-岩藻糖、-葡萄糖、-半乳糖和-鼠李糖的含量可用于急支糖浆多糖的质量控制分析。
表5 5种中药复方制剂多糖的单糖组成物质的量比
Table 5 Comparison of molar ratio of monosaccharide compositions of five kinds of Chinese patent medicine preparations’ polysaccharides
中药复方制剂物质的量比相似度 L-岩藻糖L-鼠李糖D-阿拉伯糖D-半乳糖D-葡萄糖D-甘露糖D-木糖D-半乳糖醛酸D-葡萄糖醛酸 急支糖浆1.5414.36100.0071.5884.719.835.22144.056.431.000 0 川贝枇杷糖浆1.3281.45100.0054.3032.5515.0814.34192.2718.770.957 7 小儿肺热咳喘口服液2.2438.11100.00−244.348.504.59−7.880.944 9 杏苏止咳糖浆1.2924.31100.0071.5974.3312.167.64212.6013.690.904 6 小儿热速清糖浆0.5519.69100.001.7555.183.841.35−4.720.906 7
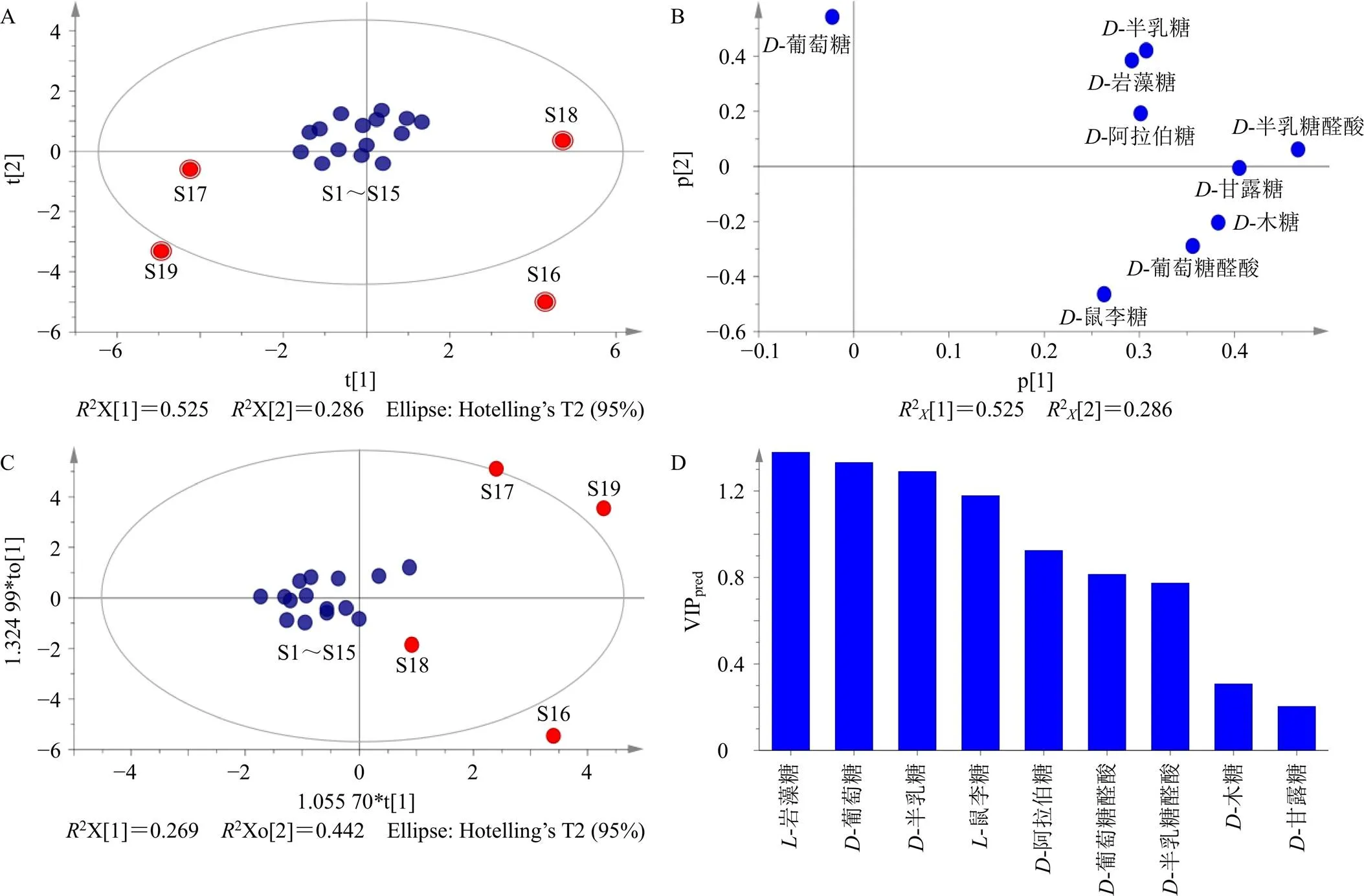
A-PCA得分图 B-PCA荷载散点图 C-OPLS-DA得分图 D-VIP值图
综上所述,本研究认为结合单糖组成物质的量比的HPAEC指纹图谱可以作为多糖的质量控制指标之一。
4 讨论
4.1 急支糖浆多糖的制备工艺
参考文献方法[15]并针对急支糖浆组成药味的特点,对其多糖制备工艺进行了优化。在实验探索过程中,对初步制得的急支糖浆粗多糖进行观察与分析,结果发现急支糖浆粗多糖的颜色较深,其中性多糖、糖醛酸、蛋白质测得的15批平均质量分数分别为37.25%、31.07%、10.24%,总糖质量分数仅为68.32%,相对较低。因此,本研究考察AB-8大孔树脂柱法[16]、有机试剂(乙醇、丙酮、乙醚)洗涤沉淀法[15]、活性炭吸附法和CTAB法[17]等除杂方法。通过比较发现,CTAB法可有效除去急支糖浆粗多糖的杂质,且对粗多糖的损耗较低,可提高急支糖浆多糖的总糖含量,平均质量分数达到80.98%。因此,最终在制备工艺中增加除杂步骤,以完善急支糖浆的多糖制备方法。
4.2 中药多糖相对分子质量与单糖组成可能存在相关性
本研究测得15批急支糖浆多糖的平均相对分子质量是19 675;同时在测定4种中药复方制剂多糖的单糖组成的基础上,以HPGPC法测定了多糖的相对分子质量,川贝枇杷糖浆、杏苏止咳糖浆、小儿肺热咳喘口服液、小儿热速清糖浆多糖的重均相对分子质量分别为38 538、20 182、2431、1898。可以发现,与急支糖浆多糖的单糖组成相似度较高的川贝枇杷糖浆、杏苏止咳糖浆在多糖重均相对分子质量上更为接近;而与急支糖浆多糖的单糖组成相似度较低的小儿肺热咳喘口服液、小儿热速清糖浆在多糖的重均相对分子质量上差异较大。由此可以推测,对于成分复杂的中药复方制剂多糖,相对分子质量的量级与单糖组成存在一定相关性。
综上所述,本研究针对急支糖浆多糖的制备方法,尤其是对多糖的化学组成、重均相对分子质量和单糖组成指纹图谱进行了分析,并验证了HPAEC单糖组成谱的特征性,表明建立的中成药多糖的单糖组成分析方法可用于质量评价,为中药复方制剂的糖类成分的分析以及质量控制提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 1372-1373.
[2] Ding H R, Liu F, Wang M Y,. Study on Chinese patent medicine based on major component analysis and quality control evaluation: A case study of Jizhi Syrup [J]., 2022, 209: 114531.
[3] 丁浩然, 刘峰, 陈艳, 等. 急支糖浆一板多药味HPTLC鉴别和HPLC含量测定方法的研究 [J]. 中国药房, 2022, 33(5): 555-562.
[4] 丁浩然, 刘峰, 王梦月, 等. 基于一测多评法的急支糖浆质量评价方法的建立及验证 [J]. 中国中药杂志, 2022, 47(10): 2668-2675.
[5] Zhang C, Gao F, Gan S,. Chemical characterization and gastroprotective effect of an isolated polysaccharide fraction fromagainst ethanol-induced acute gastric ulcer [J]., 2019, 131: 110539.
[6] 杨玉红, 郝慧敏. 药用植物多糖的生物学功能及应用研究进展 [J]. 生物学教学, 2013, 38(1): 6-8.
[7] 李蔷薇, 李强, 郑筠, 等. HPGPC法测定羧基麦芽糖铁重均分子质量和分子质量分布 [J]. 中国药房, 2016, 27(22): 3066-3068.
[8] 秦春青, 阮家耀, 王瑞宇, 等. 枇杷叶多糖分离纯化及其单糖组成研究 [J]. 中草药, 2018, 49(14): 3240-3244.
[9] 詹慧慧, 姚方程, 易斌, 等. 基于糖类成分探究黄精炆制前后差异[J]. 中草药, 2022, 53(9): 2687-2696.
[10] 才凤. 高效离子色谱法同时测定婴幼儿配方奶粉中单糖及功能性低聚糖的研究 [J]. 食品与药品, 2021, 23(2): 124-127.
[11] 于淼, 王冰, 付叶珊, 等. 响应面法优化刺五加根废弃物多糖提取工艺的研究 [J]. 中草药, 2019, 50(7): 1610-1613.
[12] 刘蕾, 刘富岗, 冯素香. 瓜子金酸性多糖的含量测定方法研究 [J]. 亚太传统医药, 2019, 15(12): 31-33.
[13] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]., 1976, 72: 248-254.
[14] Wang J M, Ge B L, Li Z H,. Structural analysis and immunoregulation activity comparison of five polysaccharides from[J]., 2016, 140: 6-12.
[15] 王瑞君. 白术和四君子汤复方活性多糖的筛选、结构表征及体外胃肠代谢研究 [D]. 上海: 上海交通大学, 2017.
[16] 宫江宁, 云成悦, 杨义菊. AB-8大孔吸附树脂纯化龙胆多糖的工艺优化 [J]. 贵州师范大学学报: 自然科学版, 2018, 36(2): 39-43.
[17] 胡浩. 酸角果肉多糖的优化提取与结构表征 [D]. 上海: 上海交通大学, 2019.
Composition analysis and quality evaluation of polysaccharides from Jizhi Syrup
LIU Feng, DING Hao-ran, WANG Meng-yue, LI Xiao-bo
Shanghai Jiaotong University, Shanghai 200240, China
To study the chemical composition, weight-average molecular weight and monosaccharide composition of Jizhi Syrup (急支糖浆) polysaccharides, and compare the polysaccharides components of different batches, so as to provide a basis for its quality control.Colorimetric method, high performance gel permeation chromatography (HPGPC) and high performance anion exchange chromatography (HPAEC) were used to determine the chemical composition, the weight-average molecular weight and polydispersity index, and the monosaccharide composition of polysaccharides in Jizhi Syrup, respectively.The average contents of neutral polysaccharide, uronic acid and protein in 15 batches of Jizhi Syrup polysaccharides were 47.60%, 33.38%, 9.30%, respectively. The weight-average molecular weight and polydispersity index of 15 batches polysaccharides from Jizhi Syrup ranged from 11 757—26 367 and 1.89—2.65, respectively. The results of monosaccharide composition showed that fucose, rhamnose, arabinose, galactose, glucose, mannose, xylose, galacturonic acid and glucuronic acid were all contained in 15 batches polysaccharides from Jizhi Syrup, and average mass concentrations of them were 1.94, 20.13, 115.54, 99.25, 117.45, 13.62, 6.03, 215.23, 9.61 µg/mg, and the molar ratio of them was 1.5∶14.4∶100.0∶71.6∶84.7∶9.8∶5.2∶144.1∶6.4. Comparing Jizhi Syrup with Chuanbeipipa Syrup (川贝枇杷糖浆), Xingsu Zhike Syrup (杏苏止咳糖浆), Xiaoer Feire Kechuan Oral Liquid (小儿肺热咳喘口服液) and Xiaoer Resuqing Syrup (小儿热速清糖浆), it was found that the HPAEC fingerprint combined with the molar ratio of monosaccharide composition could be used for the quality control of polysaccharides from Jizhi Syrup.The chemical composition, weight-average molecular weight and monosaccharide composition of 15 batches polysaccharides have high consistency, and the HPAEC fingerprints are specific, which can be used as the quality control index of the polysaccharides from Jizhi Syrup.
Jizhi Syrup polysaccharides; chemical composition; weight-average molecular weight; monosaccharide composition; quality control; fucose; rhamnose; arabinose; galactose; glucose; mannose; xylose; galacturonic acid; glucuronic acid
R283.6
A
0253 - 2670(2022)19 - 5991 - 10
10.7501/j.issn.0253-2670.2022.19.006
2022-04-01
国家重点研发计划项目(2018YFC1707300)
刘 峰,博士研究生,研究方向为中药药效物质及质量标准研究。E-mail: liufeng163lf@163.com
李晓波,教授,博士生导师,研究方向为中药药效物质及质量标准研究。Tel: (021)34204806 E-mail: xbli@sjtu.edu.cn
#共同第一作者:丁浩然,硕士研究生,研究方向为中药药效物质及质量标准研究。E-mail: dinghaoran99@163.com
[责任编辑 郑礼胜]

