脓毒症休克患者外周血HMGB1及PCT水平与疾病严重程度及预后的关系*
郑晓晶 胡周全 虎琼华 崔巍 张鸣
(成都市第二人民医院 1. ICU;2. 急诊科,四川 成都 610000)
脓毒症是由感染引起宿主反应失调所致的多器官功能障碍综合征[1]。严重脓毒症患者可发生脓毒症休克,严重危害患者生命健康[2]。近年随着多器官功能支持技术的进步,脓毒症休克死亡率较早期有所下降,但部分地区仍高达50%。有效的病情评估和预后恢复预测对于患者治疗方案的确立及预后的改善具有重要作用[3]。急性生理与慢性健康状况(Acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分是目前针对脓毒症休克患者应用最为广泛的评分系统,但其获得完整参数时限较长,评分类目计算复杂,部分特异性指标如尿酸值增加、血小板降低等无法在评分表中体现,严重制约其使用效果[4]。因此寻找有效反映脓毒症休克患者病情及预后的生物学指标成为近年来研究的热点。过度的炎症反应是脓毒症所致宿主反应失调的表现之一。通过查阅文献[5-6]发现,迁移率蛋白-1(High mobility group box-l,HMGB1)、降钙素原(Procalcitonin,PCT)与过度炎症反应存在关联。HMGB1在多种炎性疾病和损伤性疾病晚期发挥促炎作用[7]。临床研究[8]发现,外周血HMGB1在脓毒症可作为炎症级联反应的启动者,在脓毒症后期的疾病进展中扮演重要角色。PCT是血浆中约13 kD的蛋白质,发生细菌、真菌及脓毒症所致的全身炎症时,其外周血浓度显著升高[9]。近年来有研究[10]指出PCT与危重症患者疾病进展及器官衰竭程度存在密切联系。但是外周血HMGB1、PCT水平脓毒症患者预后的预测作用存在一定的争议。本研究探讨HMGB1及PCT对脓毒症休克患者疾病严重程度及预后的指导意义,现将结果报告如下。
1 资料与方法
1.1 一般资料 选取2017年3月~2021年3月本院重症监护室收治的脓毒症休克患者72例作为研究对象,其中男40例,女32例;年龄18~75岁,平均(63.40±8.00)岁,入院APACHEⅡ评分20~38分,平均(29.98±4.36)分;住院时间1~36 d,平均(19.24±7.15) d。本研究经医院伦理委员会批准,且患者均签署知情同意书。
1.2 仪器与设备 选用德国BMG生产的SPECTROstar Omega全自动酶标仪;美国Thermo公司生产的低温高速离心机;酶联免疫吸附试验检测试剂盒购自赛默飞公司。免疫荧光分析仪型号为巴迪泰艾美益A5000。
1.3 脓毒症休克诊断标准 ①符合中国脓毒症/脓毒性休克急诊治疗指南诊断标准[11]。②经充分液体复苏后仍需使用药物维持平均动脉压达到65 mmHg及以上。③Lac>2 mmol/L。
1.4 纳入及排除标准 纳入标准:①确诊为脓毒症休克且存活时间>24 h。②APACHEⅡ评分>20分。③18岁<年龄<75岁。④患者家属知情且自愿参与本研究。⑤获得医院伦理委员会审批同意。排除标准:①其他原因导致的休克患者。②妊娠及哺乳期女性。③患有恶性肿瘤、血液或免疫系统疾病。④液体复苏后血压改善的脓毒性休克患者或病毒性脓毒症患者。⑤新冠肺炎患者及严重的肝肾功能损伤患者。
1.5 方法
1.5.1 标本采集 收集患者确诊休克后24 h内常规检查资料,包括体温(T)、脉搏(P)、呼吸(R)、平均动脉压(MAP)、Alb、WBC、PLT、高敏C-反应蛋白(High-sensitivity C-reactive protein,h-CRP)、BUN、血肌酐Scr。诊断后24 h内采集外周血4 mL,置于含有EDTA的抗凝管中,室温下静置1 h后3000 r/min离心20 min,血清及血浆转移到干净的EP管中,标记并放置于-20℃冰箱备用。使用酶联免疫吸附试验检测样本HMGB1、PCT含量。
1.5.2 分组情况 依据脓毒症休克患者28 d存活情况,分为死亡组(32例)与生存组(40例),分析影响预后的相关因素。
1.6 统计学分析 采用SPSS23.0统计学软件进行数据分析,计数资料用率表示,采用2检验,计量资料采用均数±标准差表示,采用独立样本t检验,相关性分析采用Pearson相关系数,预后危险因素分析采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 脓毒症休克患者外周血HMGB1、PCT水平与疾病严重程度的相关性分析 脓毒症休克患者外周血HMGB1为(135.76±19.31)μg·L-1,与APACHEⅡ评分呈线性正相关(r=0.275,P=0.019)(见图1); 脓毒症休克患者外周血PCT为(47.51±19.44)ng·L-1,与APACHEⅡ评分呈线性正相关(r=0.469,P<0.05),见图2。
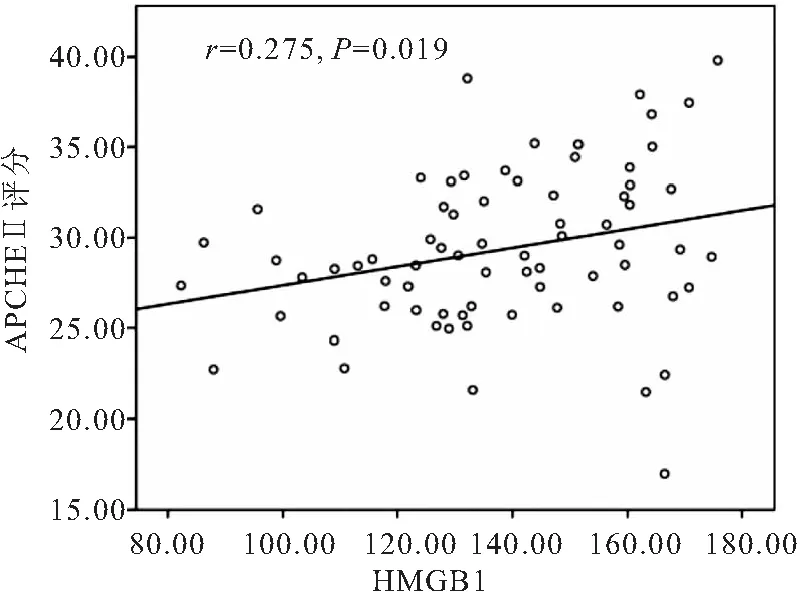
图1 HMGB1与APACHEⅡ评分的相关性分析
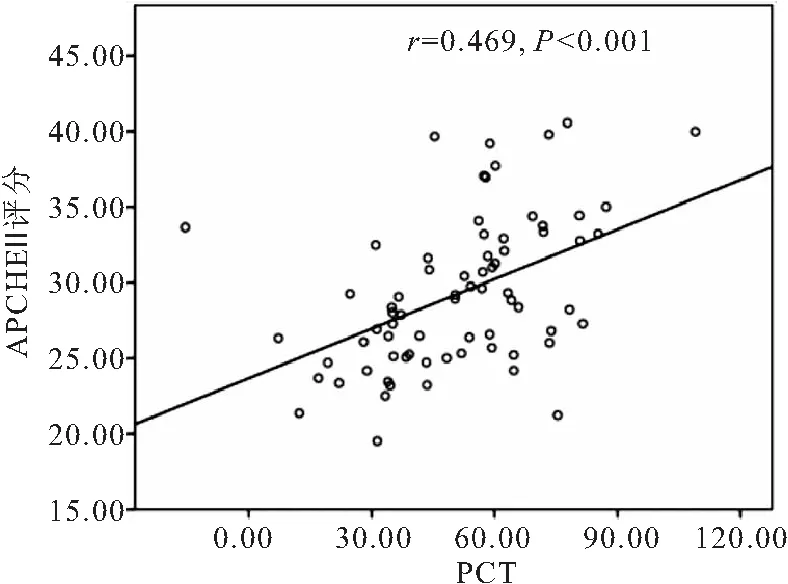
图2 PCT与APACHEⅡ评分的相关性分析
2.2 影响脓毒症休克患者预后的单因素分析 生存组和死亡组性别、住院时间、肺部感染比例、机械通气情况、入院体温、脉搏、呼吸频率及PLT比较差异无统计学意义(P>0.05);死亡组患者年龄、APACHEⅡ评分、脏器功能衰竭>2个比例、MAP、WBC、h-CRP、BUN、Scr、HMGB1、PCT高于生存组(P<0.05)。见表1。
表1 影响脓毒症休克患者预后的单因素分析
2.3 影响脓毒症休克患者预后的多因素回归分析 以患者入组后28 d内是否病死赋值(死亡=1,生存=0),纳入年龄、APACHEⅡ评分、脏器功能衰竭>2个比例、MAP、Alb、WBC、h-CRP、BUN、Scr、HMGB1、PCT指标进行Logistic回归分析,结果显示,年龄、APACHEⅡ评分、Alb、HMGB1、PCT是脓毒症休克患者预后不良的危险因素(P<0.05),见表2。
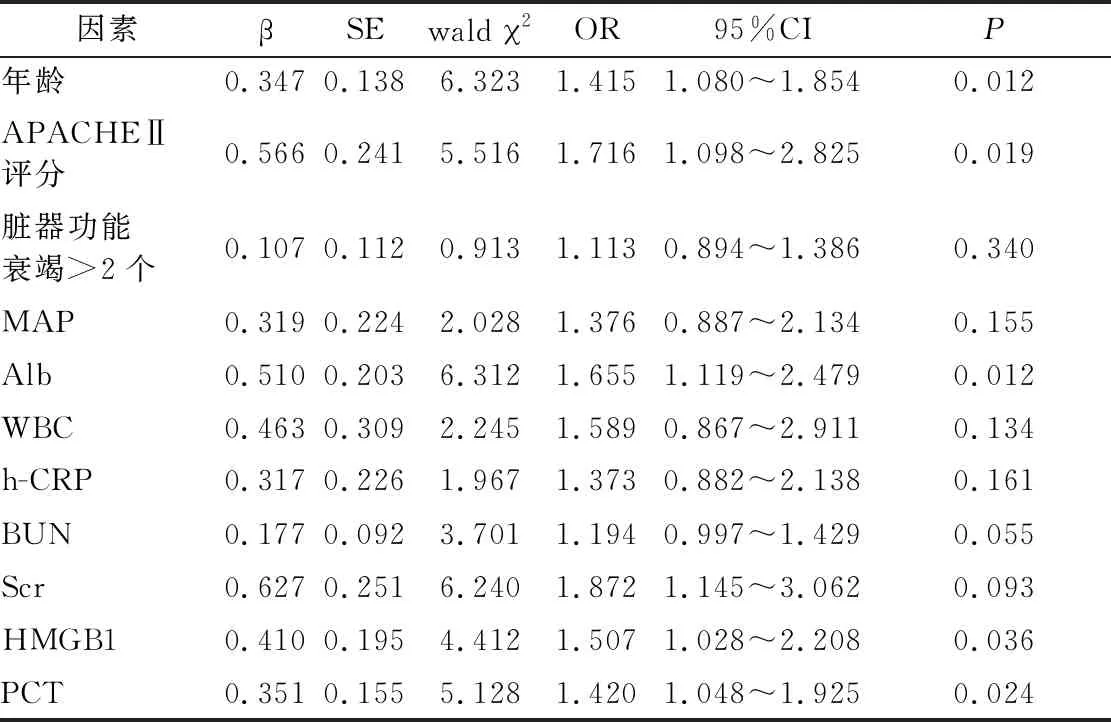
表2 影响脓毒症休克患者预后相关因素的Logistic回归分析
2.4 脓毒症休克患者外周血HMGB1、PCT水平与年龄、Alb的相关性分析 脓毒症休克患者外周血HMGB与年龄无明显相关(r=0.045,P>0.05),与Alb呈负相关(r=-0.398,P<0.05)。PCT水平与年龄无明显相关(r=0.116,P>0.05),与Alb呈负相关(r=-0.274,P<0.05)。见图3。
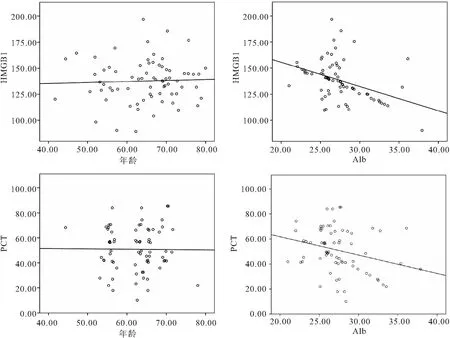
图3 外周血HMGB1、PCT水平与年龄、Alb的相关性分析
3 讨论
流行病学调查研究显示,2017年全球约有4890万人罹患脓毒症,其中1100万例死亡,全球脓毒症发病率仍保持每年1.5%的增长速度,对人类的健康造成严重威胁[12]。脓毒症患者经足量液体复苏仍处于低血压状态时则可发生休克,预后不良率较高。有研究[13]指出,脓毒症休克患者感染微生物可在体内大量增殖并释放毒素类物质,引发“瀑布式样”炎症级联反应,转录、释放大量的细胞因子及炎性介质。过量抗炎介质的生成导致机体处于“炎症麻痹状态”,形成代偿性的抗炎症反应综合征,推动病情进展。寻找可反映脓毒症患者病情严重程度及预后的生物学指标对用药及治疗方案的确立有重要意义。
HMGB1广泛存在于哺乳动物的淋巴、脑、肾脏等组织中,分泌到胞外后可诱导炎症反应[14]。内毒素、 TNF-α、IL-1等多种炎性因子均可上调HMGB1的表达水平,同时HMGB1也可刺激单核巨噬细胞分泌TNF-α、IL-1、IL-8等因子,恶性循环,加剧病情发展[15]。
本研究结果,说明HMGB1与脓毒症休克患者病情恶化密切相关。PCT是由甲状腺细胞产生的糖蛋白。生理状态下,外周血PCT浓度低于0.1 μg·L-1,当机体遭受病菌侵袭时,血浆PCT含量显著增加[16]。有研究[17]指出,脓毒症发生初期即可检测到血浆PCT水平上升,其含量在一定时间内不受激素水平的影响,保持相对稳定,具有良好的敏感性和特异性。本研究发现,随着APACHEⅡ评分的增加,脓毒症休克患者外周血PCT水平呈增加趋势,二者呈显著正相关,推测随着脓毒症休克患者疾病进一步恶化,PCT保持一定的合成速度,但机体清除速率降低,外周血PCT水平增加,PCT水平增加与脓毒症休克患者病情进展具有相关性。考虑外周血HMGB1、PCT与APACHEⅡ评分的相关性,二者可作为脓毒症患者危险分层的潜在指标,同时可在临床诊疗中与APACHEⅡ评分联合使用,作为脓毒症患者疾病严重程度预估的工具。
本研究结果显示,年龄、APACHEⅡ评分是脓毒症休克的独立危险因素。老年人常常伴随心脑血管疾病、糖尿病等基础疾病,其免疫系统对于脓毒症所致的全身炎症应急能力低下,这也是脓毒症病情恶化的重要原因。APACHEⅡ评分是脓毒症、急性肾衰等危重症疾病使用的评价系统,其评分系统中包含的年龄、血压、血氧饱和度、白细胞、电解质及慢性疾病等因素均可对脓毒症预后产生影响。本研究显示脓毒症休克患者入住时APACHEⅡ评分与病死率具有相关性。Alb对循环血容量、渗透压的维持具有重要作用。脓毒症休克患者因病情恶化,毛细血管渗透性增加,Alb可穿过血管壁进入组织间隙,肝脏合成能力的降低和胃肠道吸收功能的减弱进一步加重血浆Alb缺乏[18]。对于脓毒症休克患者,临床出现难以纠正的低蛋白血症,预后往往较差。
多项研究表明,HMGB1水平与脓毒症患者肺损伤、心肌损伤、肾脏损伤存在相关性[19-21]。杨静[22]的研究指出,外周血HMGB1水平与脓毒症患者肠道屏障相关指标密切相关。因此,推测可能在脓毒症后期患者并发休克时多个脏器功能存在不同程度的损伤,组织损伤造成HMGB1释放增加,外周血HMGB1水平上升,患者预后不良风险较大。Pearson相关系数分析结果显示,外周血HMGB1水平与APACHEⅡ评分呈正相关,与Alb呈负相关,提示外周血HMGB1水平对脓毒症休克的预后的预测作用可能与APACHEⅡ评分、Alb的变化有关。分析原因可能如下:脓毒症休克患者随着疾病进展,APACHEⅡ评分随之升高,机体免疫系统对抗感染和组织修复过程中消耗大量Alb,血清Alb水平降低;Alb水平的降低和病情的恶化进一步加重炎症反应和组织损伤,外周血HMGB1水平增加。刘晓[23]通过108例严重脓毒症及脓毒症休克患者的对比分析研究发现,PCT是影响脓毒症休克患者死亡率的独立危险因素。尹燕燕[24]采用受试者工作特征曲线分析脓毒症休克患者外周血PCT水平对预后的预测效能,结果显示,曲线下面积为0.961,灵敏度为90.40%,特异度为91.62%,48 h PCT变化水平是预测脓毒症休克患者死亡的有效监测指标。本研究结果显示,PCT是是脓毒症休克患者预后不良的独立危险因素,与既往研究结果一致。进一步分析发现脓毒症休克患者外周血PCT与APACHEⅡ评分、Alb存在明显相关,推测PCT对脓毒症休克预后的预测作用可能与APACHEⅡ评分、Alb水平有关。本研究也存在一定的局限性,如研究结果仅适用于细菌性脓毒症患者。既往的研究指出,脓毒症患者确诊后24 h内外周血HMGB1呈波动状态,样本采集时间点的不同可导致HMGB1水平差异。本研究中72例脓毒症患者外周血采集时间随机,因此可能对结果造成一定影响。
4 结论
脓毒症休克患者随着疾病进展外周血HMGB1、PCT水平增加,HMGB1、PCT水平与疾病严重程度密切相关。高龄、低APACHEⅡ评分、低蛋白血症、高水平HMGB1及PCT是脓毒症休克患者病死的独立危险因素。

