UHRF1在小鼠早期妊娠子宫中的表达与激素调节
金 鑫,王 静,孙 宇,李世杰,马兴红
(东北农业大学 生命科学学院 黑龙江省动物细胞与遗传工程重点实验室,黑龙江 哈尔滨 150030)
研究发现胚泡在进入子宫内膜腔之后几乎立即就与子宫内膜发生对话[1],发育中的胚胎黏附在子宫内膜的表面,胚胎分泌一系列能与腔上皮和腺上皮上受体特异性结合的配体,胚胎与母体的子宫内膜表面发生细胞之间的相互作用,并且持续进行着复杂的级联反应[2]。蜕膜化的进行需要转录、形态、细胞等许多因子和信号通路之间的相互作用。包括激素受体、其他核受体和一些调节因子[3]。雌激素和孕酮(P4)是胚胎着床与发育和正常妊娠所必需的重要调节因子[4],并且以时间和空间方式协同调控各类子宫细胞的增殖与分化,以确保子宫处于植入的“窗口期”[5]。这些激素通过与特异性的激素受体结合来发挥作用,一旦受体与相应激素结合,即可与应答基因启动子区特定的顺式作用序列相结合,从而调控这些基因[6]。
有研究表明小鼠胚胎在12.5 d死亡发生在泛素样PHD和含环指结构域的蛋白1(UHRF1)基因敲除型鼠上[7],与正常胚胎相比较该基因敲除的小鼠胚胎发育缓慢,出现各种生理性缺陷[8],检测发现,凋亡事件明显增多于骨节、神经管腹侧以及头部中胚层等部位。科学家在寻找细胞周期蛋白的时候发现UHRF1在S期高表达[8]。下调该基因能够导致细胞增殖变慢并处于G1期[9],容易进入S期的细胞该基因往往高表达,大多数细胞处于S和G2/期[10]。与生长缓慢的组织相比较,增殖快的组织该基因表达多[11]。关于UHRF1在癌症等方面的作用研究较为广泛,但其参与哺乳动物早期妊娠过程的研究鲜有报道。本试验以小鼠为材料,探究UHRF1在小鼠早期妊娠模型、人工诱导蜕膜化模型、类固醇激素处理模型及体外诱导HESC蜕膜化模型中mRNA和蛋白的表达情况及其规律,为深入了解UHRF1及其上、下游信号通路和其在生殖工程中的作用提供线索。
1 材料与方法
1.1 实验动物试验所用到的ICR小鼠,均已达性成熟,购自辽宁长生生物技术股份有限公司。动物于人为调控的条件下进行饲养,室温为22℃左右,光照的时间控制在12 h光照和12 h黑暗,自由摄食及饮水并每周更换1次垫料。
1.2 主要试剂及配制UHRF1抗体购自爱必信(上海)生物科技有限公司;GAPDH抗体购自CST公司;HRP标记山羊抗兔IgG购自Abclonal公司。杂交液:用1 mL移液器调至500 μL加入去离子甲酰胺500 μL,DEPC处理的20×SSC 250 μL,4%BSA 5 μL,DEPC水240 μL,0.1 g硫酸葡聚糖,待其溶解后加入tRNA(50 g/L)5 μL,保存于-80℃中待用[12-14]。
1.3 早期妊娠模型每晚16:00左右将健康且已达性成熟的雌性小鼠与成年可育的雄性小鼠按照1∶1的比例置于同一个笼子中,使其交配,于第2日早9:00之前检查是否存在阴道栓并且对其做阴道涂片。若于阴道内发现精子的存在则将该天记为此鼠妊娠第1天。按照天数(妊娠第1~8天)于早上9:00之前完成取材。
1.4 类固醇激素处理模型选择健康且已性成熟的雌性小鼠,双侧卵巢切除,休养并恢复3周以上,随机分配成4组,每组分别注射雌二醇(E2)、(100 μg/0.1 L)、P4(1 g/0.1 L)、E2+P4、芝麻油,注射 24 h 之后进行取材,每组至少取3只以保证试验的准确性。
1.5 人工诱导蜕膜化模型制备健康且性成熟的3只结扎鼠,取已恢复的雄鼠1份再取3份自然发情的雌鼠于当日下午4点合笼,次日清晨检栓,发现阴道栓时则为假孕第1天。取假孕第4天时的小鼠为试验材料,芝麻油注入一侧子宫角另一侧不注,在假孕第8天取材。
1.6 体外诱导人子宫内膜基质细胞(HESC)蜕膜化模型提前配制好诱导所需要的激素浓储液,当HESC细胞密度约80%时,换液接种,6孔板内,待细胞密度与生长状态适宜时开始诱导。诱导培养体系以1 000 mL细胞培养液为例,分别加入DMEM/F12 15.56 g、Sadium Bicarbonate 1.2 g、CS-FBS 20 mL、Penicillin-Streptomycin 5 mg、cAMP 0.5 mmol/L、MPA 1 μmol/L、E210 nmol/L。
1.7 原位杂交用设计好的探针引物序列(表1),以cDNA为模板进行扩增后,将产物与T载体连接转化挑取单菌落测序后,将测序正确的质粒大量提取,用T7/SP6与目的基因上、下游引物扩增目的片段,用Roche公司探针标记试剂盒进行探针标记,55℃杂交过夜后用碱性磷酸酶标记的地高辛抗体4℃避光过夜孵育。滴加含有左旋咪唑的NBT/BCIP显色液,4℃过夜显色并实时观察,甲基绿复染拍照。

表1 引物序列
1.8 免疫组织化学将石蜡组织切成7 μm薄厚,37℃过夜烘片1 h,二甲苯脱蜡,而后用乙醇溶液进行梯度脱水,用3%的过氧化氢封闭掉内源性的过氧化物酶以保证阳性信号的准确性,血清封闭以后加入所需的一抗(UHRF1抗体,爱必信生物科技有限公司)放入4℃冰箱过夜,用缓冲液浸泡过后加入二抗并进行避光孵育,显色以后使用苏木精染色液染色,乙醇梯度复水及二甲苯透明,封片、晾干封片剂以后进行照相。
1.9 蛋白质免疫印迹测定浓度按照所需各个蛋白样品的体积点样进行电泳,待样品距离胶底部较近时,立即停止电泳,转膜60 min,配置5%脱脂牛奶用于封闭,把恒温培养箱调节温度至37℃条件下孵育1 h,加一抗4℃过夜;PBST洗膜,封闭液稀释二抗,覆于膜上,37℃振荡1 h;PBST洗膜,使用增强型ECL发光液,于扫描仪器中曝光,拍摄蛋白条带,Image J软件扫描条带,计算灰度值。
1.10 荧光定量PCR使用Real-time PCR试剂盒,以cDNA作为反应模板,用Amplied Biosystems®7500 Real-time PCR System(Amplied Biosystems)仪器。

2 结果
2.1 小鼠早期妊娠模型中UHRF1 mRNA的表达通过原位杂交的结果可得到,UHRF1 mRNA在第1~4天的子宫中并没有非常明显的表达。伴随着胚胎进行着床,蜕膜化的发生UHRF1 开始表达。在妊娠第5天的腺上皮上可以看到UHRF1的表达;并且在之后的几天里,该基因表达较为明显且主要集中在蜕膜区域,原位杂交与Real-time PCR显示的UHRF1 mRNA的表达情况基本一致(图1)。

D1~D8.小鼠妊娠早期1~8 d子宫;**** P<0.000 1。下同
2.2 小鼠早期妊娠模型中UHRF1蛋白的表达免疫组化结果表明,UHRF1蛋白在妊娠第1~4天的子宫中并无明显表达。从第5天开始可以看到UHRF1蛋白在上皮微弱的表达,随着蜕膜组织的逐渐形成,在第6~8天可以明显地观测到其表达,且表达量随着妊娠的进行逐渐升高,其主要在蜕膜组织中表达。通过Western blot结果表明,在妊娠的第1~4天,有少量的UHRF1蛋白表达。从妊娠的第5天开始,随着蜕膜化的发生UHRF1蛋白表达量逐渐升高,并且表达量变化比较显著(图2)。

D1~D8.小鼠妊娠早期1~8 d子宫
2.3 小鼠类固醇激素处理模型子宫中 UHRF1 mRNA的表达Real-time PCR结果表明,UHRF1 mRNA在雌激素处理组中表达量增高,但在对照组中和各类激素处理组中并无明显表达。原位杂交的结果可以很明显观测到,雌激素组中UHRF1 mRNA在腔上皮有所表达,这与Real-time PCR提示的结果基本一致(图3)。
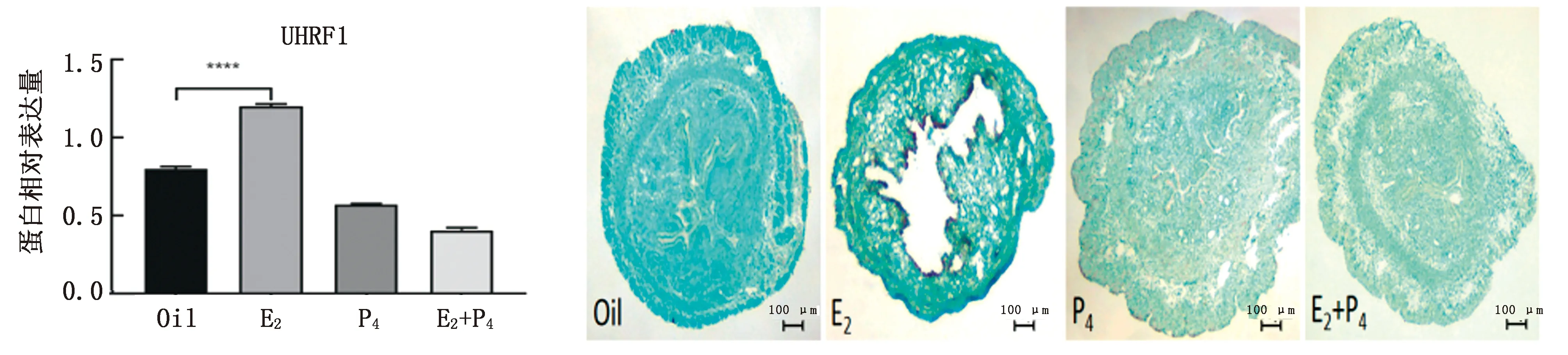
图3 小鼠类固醇激素处理子宫中UHRF1 mRNA的表达情况
2.4 小鼠类固醇激素处理模型子宫中UHRF1蛋白的表达通过原位杂交和Real-time PCR可知,雌激素可能调控该基因的表达。而UHRF1 蛋白的表达同样通过激素处理模型进行研究,免疫组化的结果表明,UHRF1 蛋白在经雌激素处理的子宫中有明显表达增加的趋势。Western blot的结果可以观察到,β-雌二醇处理组中UHRF1蛋白表达量增高,其他处理组中没有观察到UHRF1蛋白显著性表达(图4)。

图4 小鼠类固醇激素处理子宫中UHRF1蛋白的表达情况
2.5 小鼠人工诱导蜕膜化模型子宫中UHRF1 mRNA的表达情况结果表明,UHRF1 mRNA在蜕膜组中的表达量相对较高,且与对照组相比较,差异极显著(图5)。

图5 小鼠人工诱导蜕膜化模型子宫中UHRF1 mRNA的表达情况
2.6 小鼠人工诱导蜕膜化模型子宫中UHRF1蛋白的表达情况免疫组化结果得知,UHRF1 蛋白在蜕膜组织中广泛表达,而在对照组中没有明显表达。Western blot结果表明,UHRF1 蛋白在发生蜕膜化试验组子宫中的表达非常显著,而在未发生蜕膜化的对照组中无明显表达,与免疫组化的结果完全一致,与UHRF1 mRNA在人工诱蜕膜化模型中表达情况类似(图6)。
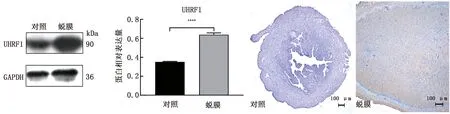
注:对照.非蜕膜测验
2.7 体外诱导HESC蜕膜化中UHRF1 mRNA的表达用本实验室已经验证过诱导成功的HESC蜕膜化细胞mRNA反转录为cDNA,检测发现UHRF1 mRNA在妊娠1,2,3,4,6 d蜕膜组织表达量相对较高,且随着诱导时间的增加有逐渐升高的趋势(图7)。

图7 体外诱导HESC蜕膜化中UHRF1 mRNA的表达情况
3 讨论
UHRF1参与众多体内生理过程,例如对淋巴细胞发育的调节、DNA甲基化的维持、对于细胞生长的调控、基因组稳定性的维持、以及肿瘤的恶性进展密切相关等[15]。有研究表明小鼠中敲除该基因后能够导致小鼠胚胎的死亡[7]。
胚胎着床后子宫基质细胞发生着一系列的增殖与分化,UHRF1可以与甲基化状态的Rb启动子结合,从而抑制其表达,这促进了细胞向细胞周期中的S期转化,结合本试验原位杂交和免疫组化中UHRF1表达的位置以及定量PCR和Western blot结果可知,在胚胎发生着床以后,UHRF1的mRNA和蛋白逐渐在蜕膜细胞当中高表达,说明胚胎着床后UHRF1蛋白的高表达在一定程度上促进了子宫基质细胞细胞周期的转换,进而影响细胞的生理状态。
本试验结果显示,在早期妊娠的第5天,胚胎发生着床,UHRF1 mRNA表达量开始上升,其首出现在早期妊娠第5天的子宫腺上皮当中,而后其表达量随着着床时间的增加而增加,以上所述说明UHRF1确实与胚胎着床过程密切相关。
胚胎成功着床,既要有进入接受状态的子宫,又要有获得着床能力的胚胎,这两个看似独立而又紧密联系的事件需要多个信号通路同步进行,并在协调过程中涉及激素调控,其中雌激素和P4是胚胎着床发育和正常妊娠所必需的重要调节因子[16]。绝大多数参与调控生殖过程的基因都受到卵巢雌激素和P4的影响,例如Lif,Ihh等。在成年小鼠中,腔上皮和腺上皮的增殖受到雌激素的调节,雌激素与P4共同作用刺激基质细胞的增殖,雌激素主要通过核受体发挥作用[17-18]。在本试验的激素处理模型中,人为给卵巢切除小鼠注射雌激素后UHRF1的mRNA和蛋白的表达都有所上调,P4处理组和雌激素加P4共同处理组以及只注射芝麻油的对照组中并没有发现UHRF1表达明显性上调,而雌激素处理组中UHRF1的这种上调可能和上皮细胞在雌激素刺激下进行增殖有关联。
胚胎发生着床之后,子宫内膜基质细胞经增殖与分化转变为蜕膜细胞,为早期妊娠发生及胎盘的形成提供了大量的营养物质,并且提供免疫环境,使胚胎免受免疫反应。蜕膜化现象的出现对于后期的妊娠以及维持这其中涉及到许多生物学事件,包括生长的子宫基质细胞、再分化的基质成纤维细胞、以及重新建立细胞外基质等至关重要,在此过程中涉及很多细胞因子的参与,例如bmp2[19]、cAMP[20]等。蜕膜化是子宫基质细胞形态功能发生变化的一个过程,子宫蜕膜化对于母体妊娠的建立和维持是很重要的。本试验结果显示,UHRF1的mRNA与蛋白在早期妊娠第6天以后的蜕膜细胞里高表达,在人工诱导蜕膜化模型中UHRF1的mRNA和蛋白表达量也相对较高,在人工诱导HESC细胞当中也出现类似现象,而在早期妊娠前几天并没有发现明显表达,这可能说明UHRF1参与子宫基质细胞向蜕膜细胞的转变,推测其与蜕膜化转变具有相关性。综上所述,UHRF1参与胚胎着床的调控,UHRF1表达受类固醇激素的调控,UHRF1与蜕膜化过程密切相关。

