引起牛乳腺炎的凝固酶阴性葡萄球菌研究进展
李政志,陈秋慧,杨晶涵,刘晓雅,严 蕊,陈颖钰,2,陈 曦,2,郭爱珍,2,胡长敏*
(1.华中农业大学 动物医学院,湖北 武汉 430070;2.农业微生物学国家重点实验室,湖北 武汉 430070)
牛乳腺炎是导致奶牛产业损失最为严重的疾病之一,凝固酶阴性葡萄球菌(coagulase-negativeStaphylococci,CoNS)为最常见导致牛患乳腺炎的病原菌[1]。该菌于1880年首次鉴定,因不产生凝固酶而得名。其最初命名为白色葡萄球菌[2],后被划分为非金黄色葡萄球菌(non-aureusstaphylococci,NAS)[3]。CoNS能引起奶牛持续性乳腺内细菌感染(intramammary bacterial infection,IMI),表现为体细胞计数增加和奶产量下降[4]。最初CoNS被认为是无害的乳房定植菌[5],然而在过去的20年中,CoNS 已成为全世界致奶牛乳腺炎的最常见病原,其中产色葡萄球菌(Staphylococcuschromogenes)、表皮葡萄球菌(Staphylococcusepidermidis)、松鼠葡萄球菌(Staphylococcussciuri)等为优势菌株。据报道,美国、欧洲等国家CoNS的分离率为27%~55%[4];SONG等[6]对我国15个大型奶牛场的牛乳汁样本进行病原学调查,其中27.93%的乳腺炎乳汁样品中分离出CoNS,高于金黄色葡萄球菌11.1%的分离率,成为分离比率最高的病原。
伴随着养殖业集约化以及抗生素为大量使用,具有β-内酰胺、氨基糖苷和四环素抗性的CoNS已成为导致奶牛乳腺炎的重要原因[7]。除此以外,CoNS还可以产生生物被膜(biofilm,BF)、肠毒素及溶血素等毒力因子,造成牛乳腺内持续感染[8]。为更好地预防及控制牛 CoNS性乳腺炎,现从导致牛乳腺炎源CoNS的病原学、致病机理、耐药机制、检测方法及治疗与预防相关技术进行综述,供同行参考。
1 牛乳腺炎源 CoNS的病原学
CoNS作为一种条件致病菌,主要定植于奶牛皮肤及黏膜表面,或存在于草料仓、垫草等处,致病力不强。当牛由于各种不利因素导致免疫力下降时,或者牛乳腺受到损伤及异物侵入等,CoNS进入牛乳腺组织生长繁殖,诱发临床或隐性乳腺炎。
研究显示,在牛场垫料等相关生活环境中,CoNS主要为木糖葡萄球菌、松鼠葡萄球菌和腐生葡萄球菌;而在牛乳头皮肤上最常见的CoNS为溶血葡萄球菌;牛奶中最常见的CoNS为表皮葡萄球菌、溶血葡萄球菌及产色葡萄球菌;除此以外,产色葡萄球菌还可在奶牛乳头管、阴道等部位定植。DEVLIEGHER等[9]研究发现,20%的小母牛至少有1个乳头顶端存在产色葡萄球菌,其乳腺炎发病率随年龄的增长而增加。
除奶牛不同部位CoNS菌株存在差异外,从不同国家和地区分离出的牛乳腺炎源CoNS也存在差异,KIM等[10]从2013—2017年在韩国收集3 692份牛奶样品分离得到311株CoNS,其中最主要的CoNS为产色葡萄球菌、模拟葡萄球菌及表皮葡萄球菌。据报道,近10年来我国从牛乳腺炎中分离出来的CoNS比例不断上升,其中分离率最高的为产色葡萄球菌,其次为松鼠葡萄球菌和表皮葡萄球菌[11]。综合已有文献报道,现阶段全球主要流行的CoNS为产色葡萄球菌、溶血葡萄球菌、表皮葡萄球菌、模拟葡萄球菌及松鼠葡萄球菌等。
2 CoNS感染奶牛乳腺的机理
2.1 CoNS入侵乳腺组织与BF形成CoNS的乳腺感染扩散过程可划分为3个阶段,其对乳腺组织细胞的黏附是乳腺感染的第1阶段[12](图1A)。CoNS进入乳腺组织后首先自由移动,随后附着在乳腺细胞表面分裂,繁殖并形成需要细胞间黏附的多层细胞簇[13],CoNS也可产生胞外多糖等物质促进聚集。部分CoNS产生黏连蛋白结合蛋白和纤连蛋白结合蛋白,促进病原与宿主细胞外基质结合,增加细菌对宿主细胞的黏附[14]。CoNS增殖、多个细菌组成聚集结构及形成BF为乳腺感染的第2阶段(图1B),CoNS可通过表面多糖连接[15],如表皮葡萄球菌可产生细胞间多糖黏附素,促进细菌聚集。在上述过程中许多CoNS产生糖萼(一种黏液层),将其封闭在自生基质中并附着于细菌表面[16]。糖萼也称为BF,能够保护细菌抵抗宿主的免疫清除。CoNS扩散为感染的第3阶段(图1C),扩散的CoNS可以入侵血管或再黏附乳腺组织导致感染蔓延。LEWIS等[17]发现使用抗生素治疗牛CoNS乳腺炎时,部分细菌在BF的保护下发生残留,造成牛乳腺的反复感染。
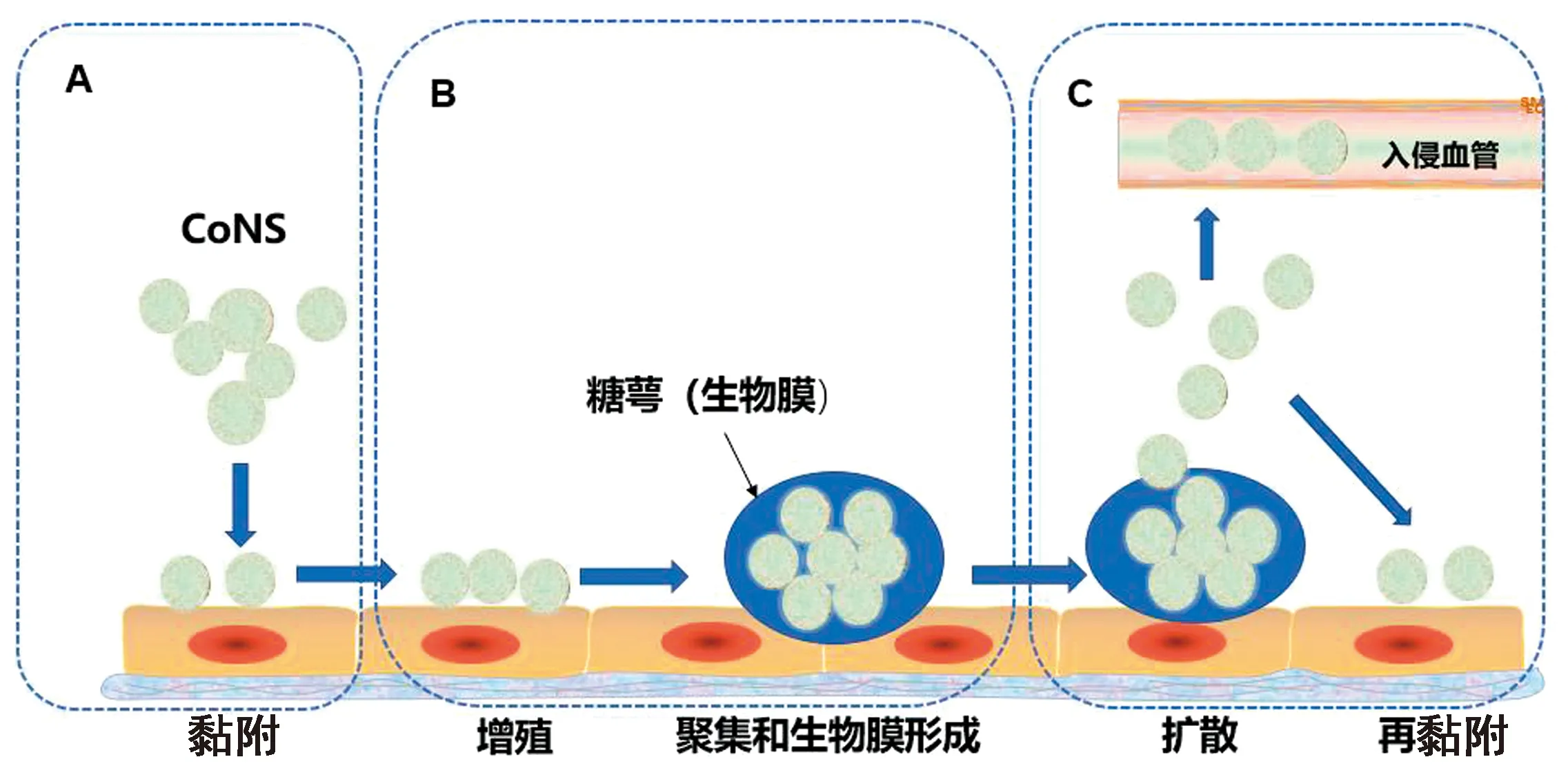
A. 第1阶段CoNS黏附乳腺上皮细胞;B.第2阶段CoNS聚集增殖并形成生物膜;C.第3阶段CoNS扩散及再黏附
2.2 CoNS的毒力因子CoNS的主要毒力因子包括BF、肠毒素及溶血素等,不同CoNS的毒力因子存在差异[18]。BF是CoNS最重要的毒力因子,具有提高CoNS产生耐药性与抵抗多种不利因素的能力,并使其在宿主内自由增殖。肠毒素等热源性毒素可形成超抗原,与主要组织相容性复合体 Ⅱ类分子结合,诱导细胞增殖和高水平细胞因子表达。CoNS能产生α、β和δ溶血素,溶解细胞膜,使细胞内容物外泄。NASAJ等[19]通过分析CoNS的表型与基因型,发现耐药CoNS BF形成与溶血素相关。与金黄色葡萄球菌相似,CoNS的毒力基因也位于可移动的遗传元件上,这使得他们能够获得更多的外源基因,提高CoNS适应能力[20-21]。ARGEMX等[22]通过鉴定几种携带抗性基因并与金黄色葡萄球菌同源的质粒,推测表皮葡萄球菌的一些可遗传元件可能来自金黄色葡萄球菌,且存在毒力因子的转移。
3 CoNS的耐药表型与机制
3.1 CoNS的耐药表型与金黄色葡萄球菌相比,CoNS更易获得耐药性[23]。由于内酰胺类和大环内酯类抗生素被广泛用于治疗CoNS感染,研究显示全球范围内CoNS对β-内酰胺类抗生素,特别是青霉素和氨苄青霉素的耐药性正在增加[24-25]。耐甲氧西林的 CoNS(methicillin resistant coagulase negativeStaphylococcus,MRCNS)从20世纪90年代出现,已迅速成为牛乳腺炎在内的动物感染性疾病治疗的挑战[26],在南美洲国家中耐药率高达70%~80%[27]。
调查显示从患乳腺炎奶牛的乳汁中分离的CoNS其耐药性不断增加。欧洲耐青霉素CoNS的分离比例(29.1%)高于金黄色葡萄球菌的分离比例(25.1%),其中表皮葡萄球菌、松鼠葡萄球菌的mecA基因介导的甲氧西林耐药率达43.9%[28]。在牛源性CoNS中,37.3%的分离株具有多重耐药;而与人类密切相关的CoNS中,89.5%的分离株具有多重耐药性[29]。除此以外,不同CoNS的耐药率也表现出种属差异,牛奶中表皮葡萄球菌的耐药率高于其他种属CoNS[10]。
3.2 CoNS的耐药机制研究显示CoNS耐药机制与CoNS形成BF的能力,及其BF形成基因,如icaA、icaB、icaC、icaD、atlE和bhp相关[19]。根据CoNS基因组的特性,人源CoNS的抗生素抗性基因(antibiotic resistance gene,ARG)可作为ARG库,促使ARG水平转移到其他葡萄球菌中;牛乳腺炎源CoNS的ARG同样也可能转移到人葡萄球菌中。松鼠葡萄球菌是唯一拥有甲氧西林抗性基因mecC的CoNS,DHAOUADI等[30]首次从奶牛粪便样本中分离出携带mecC基因的松鼠葡萄球菌,而另外一些来自人的样本分离出的松鼠葡萄球菌也携带mecC基因,提示松鼠葡萄球菌mecC存在从牛向人类转移的风险。
4 CoNS的检测与鉴定
由于 CoNS缺乏特别的生理生化特征,没有明确的分类依据,对CoNS的鉴定主要通过表型和基因型鉴定进行。CoNS的分离培养影响因素多,耗时长,因此对CoNS的鉴定大都基于其基因型特征,如16S DNA或Tuf基因测序等。研究表明,CoNS的表型与基因型鉴定并不完全一致[31]。DOSSANTOS等[32]对牛乳腺炎源产色葡萄球菌进行鉴定,发现1株能凝结血浆的产色葡萄球菌,这种特殊的表型可能导致该CoNS被错误的识别为金黄色葡萄球菌。因此将CoNS的表型与基因型结合起来进行鉴定,对于发现CoNS新特征及其进化具有重要意义。此外基质辅助激光解析电离飞行时间质谱也可用来对CoNS进行鉴定,研究显示其在CoNS的鉴定方面与常规基因型鉴定准确性相当,且易于操作[33]。
5 奶牛 CoNS乳腺炎的治疗
对于牛 CoNS乳腺炎的治疗方法,首选仍是使用抗生素。大部分CoNS对于青霉素类药物具有耐药性,对四环素、克林霉素、恩诺沙星等非β-内酰胺类药物也存在不同程度的耐药[34],而CoNS对利奈唑胺、达托霉素、莫西沙星等新一代抗生素具有较高的敏感性[35]。在对奶牛CoNS乳腺炎开展治疗时,首先需选择合适的抗菌药物,并采用足够的剂量,以及确保临床症状消失后仍继续使用一段时间药物。在奶牛CoNS乳腺炎的治疗过程中,应避免对群体使用抗生素,减少细菌耐药性及动物性产品药物残留。除传统抗生素以外,一些天然产物,如紫檀芪、白藜芦醇等已被证实具有抗菌效果[36],用于预防和治疗奶牛CoNS乳腺炎。除此以外,一些新疗法,如植物精油疗法[37]、噬菌体疗法[38]、纳米颗粒疗法[39]等为奶牛CoNS乳腺炎治疗提供了更多方案。
6 奶牛 CoNS乳腺炎的预防
预防奶牛 CoNS乳腺炎的关键环节为阻断CoNS传播与入侵。根据奶牛养殖及生产特征,挤奶是奶牛乳腺组织最容易受到病原体入侵的环节,因此在挤奶过程中应避免机械损伤,并积极做好挤奶前后奶牛乳房及挤奶机的消毒,对预防牛CoNS乳腺炎至关重要。
防止奶牛乳头区域污染,在挤奶前后使用消毒剂对奶牛乳头区域浸渍消毒,可有效减少奶牛CoNS乳腺炎的发生。消毒时需使用适宜浓度的消毒剂,避免微生物对消毒剂耐药,或与其他类型消毒剂产生共同及交叉耐药[40]。此外,严格饲养管理,减少饲养人员与牛群的不合理流动,可有效避免耐药CoNS的传播。其他预防措施如合理设置牛群规模、采用优质饲料、强化饲养环境的消杀及保持饲养环境的干燥等。
7 展望
CoNS不仅是牛乳腺炎的主要病原,近年来也成为人类医疗系统中院内感染的重要病原[23]。因此控制CoNS的感染不仅是兽医学问题,更是与人类生命健康及食品安全息息相关的重要问题。目前,国内外关于CoNS感染导致牛乳腺炎的致病机理及高效防控措施相关研究较少,CoNS耐药机制及其流行病学变迁亦值得深入探究。除此以外,CoNS致病性变化与人源超级耐药CoNS是否存在关联尚无答案。基于CoNS BF的结构、功能特点及致病机制开发特异性药物以及疫苗,亦具有较大前景。

