成组生物毒性测试在污染场地土壤生态毒性评价中的应用*
高金玲 汪 贞 古 文 范德玲 梁梦园 刘济宁 张 志
(1.黑龙江大学现代农业与生态环境学院,黑龙江 哈尔滨 150080;2.生态环境部南京环境科学研究所,江苏 南京 210042)
《土壤污染防治行动计划》明确提出,对于土壤污染要“分类别、分用途、分阶段治理”。现阶段,我国污染土壤的分类以保护人体健康与保障农产品质量安全为出发点,通过化学分析手段测定污染物赋存量,与筛选值进行比较来确定分类。尽管我国已建立了土壤污染检测的化学分析方法体系,但是化学分析难以对土壤中的所有污染物进行全面测定,现有土壤环境质量标准中有限的污染物限量标准难以满足风险评估需求。此外,化学分析不能客观反映多污染物组分的协同作用,具有很大的局限性。未来有必要基于生态风险建立筛选值,为污染土壤的安全利用增加一道防线。
土壤生态毒性测试是通过外源污染物对受试生物(植物、动物、微生物)在分子、细胞、器官、个体、种群及群落等不同生命层次上的胁迫效应来评估土壤的污染程度的方法[1]。该方法可以比较全面地反映土壤污染的程度和影响,对化学分析方法能起到很好的补充作用。《土壤质量 土壤和土壤材料生态毒理特性的生物测试方法选择与评估指南》(ISO 17616:2019)建立了系统的土壤生态毒性诊断技术,采用污染土壤样品测定蚯蚓等9种陆生生物和土壤微生物的急慢性毒性,以评估污染物对土壤栖息地功能的影响;采用污染土壤浸提液测定发光菌等6种水生生物的毒性,以评估污染物对土壤滞留功能的影响;基于毒性终点的毒性效应分别制订了毒性判别标准,并规定至少一项试验结果为阳性时,表明土壤有毒[2]6。总体看来,ISO 17616:2019实现了土壤毒性有无的定性判断。判断污染场地土壤生物毒性程度,确定基于生态风险的筛选值,建立毒性高低与筛选值之间的对应关系,可以为更精细的场地修复与利用提供依据。因此,需要基于生态毒性测试建立毒性分级系统。目前针对土壤毒性分级系统的研究相对缺乏,少量研究报道了成组毒性测试综合指数(TBI)法[3]1943。此外,毒性单位分级评价法[4]是一种广泛应用于水[5-6]和沉积物[7-8]毒性评价的方法,算法与原理简单,但应用于土壤毒性评价鲜有报道。
应用ISO 17616:2019方法时,需开展13项毒性测试,测试成本高、周期长,为了提高试验经济性,有必要探讨使用更有限的生物组合开展测试[9]。本研究基于ISO 17616:2019,筛选了4种代表性受试生物,对《土壤污染防治行动计划》中涉及的3个行业的7个污染场地土壤开展了成组生物毒性测试,参考毒性单位分级评价法建立了毒性分类标准,对成组生物毒性测试的结果进行了定量评估,并与TBI法的结果进行比较,以期为成组生物毒性测试在污染场地土壤生态毒性评价方面的推广应用提供参考。
1 材料与方法
1.1 仪器与试剂
主要仪器:人工气候箱(RXZ-600)、水质参数分析仪(美国哈希,HQ 40d)、总有机碳(TOC)分析仪(德国耶拿,Multi N/C 3100)、分光光度计(日本SHIMADZU,UV-2450)、天平(美国METTLER TOLEDO,MS105DU)、酶标仪(美国MD Electronics,spectraMax iD3)。
主要试验材料:人工土壤(配置方法参考文献[10])、Elendt M7培养基(固体,配置方法参考文献[11])、ASTM培养基(液体,配置方法参考文献[12])、活性炭(分析纯,200目)、氯化钠(分析纯)、氯化钙(分析纯)。
1.2 土壤样品来源与理化指标的测定
2020年8—11月,采集了江苏昆山(JSKS)、山西孝义(SXXY)、山西阳泉(SXYQ)、广东韶关(GDSG)、广东广州(GDGZ)、山西太原(SXTY1、SXTY2)共6个城市的7个污染场地土壤样品,样品编号、来源以及涉及的行业信息见表1。土壤含水率测定参考《土壤 干物质和水分的测定 重量法》(HJ 613—2011);pH测定参考《土壤 pH值的测定 电位法》(HJ 962—2018);电导率测定参考《土壤 电导率的测定 电极法》(HJ 802—2016);TOC测定参考《土壤 有机碳的测定 燃烧氧化-非分散红外法》(HJ 695—2014);阳离子交换量测定参考《土壤 阳离子交换量的测定 三氯化六氨合钴浸提-分光光度法》(HJ 889—2017)。
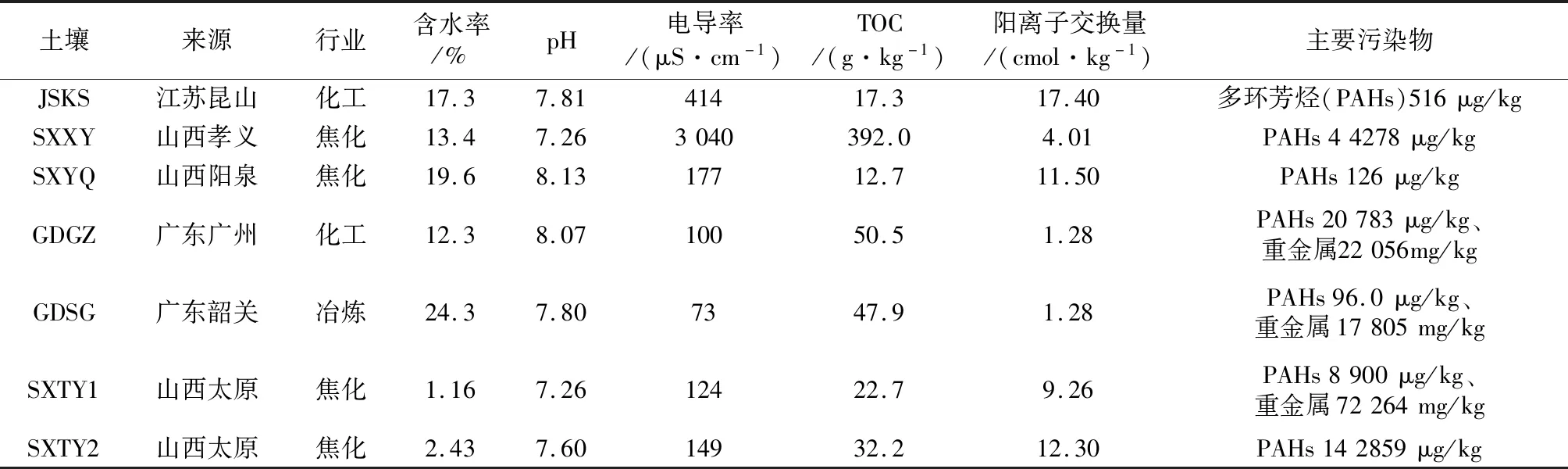
表1 污染场地土壤样品来源与理化指标Table 1 Source and physicochemical indicators of contaminated sites soil samples
1.3 供试生物及饲养
发光菌为费氏弧菌(Vibriofischeri)冻干粉,购买自北京金达清创环境科技有限公司。
大型溞(Daphniamagna)由实验室驯养,在Elendt M7培养基,温度(20±1) ℃,光照强度1 000~1 500 lx,光暗比16 h∶8 h,以小球藻(ChlorellavulgarisBeij.)浓缩液喂食条件下培养。
白符跳(Folsomiacandida)由实验室驯养,在底部铺有0.5 cm厚石膏/活性炭混合基质的培养皿中培养,培养温度为(20±1) ℃,光照强度400~800 lx,光暗比为12 h∶12 h,以市售酵母粉喂食。试验采用同步化的白符跳(9~12 d)作为受试生物。
玉米种子购自江苏省农业科学院。
1.4 土壤浸提液的制备方法
称取过2 mm尼龙筛的污染场地土壤样品,加入0.001 mol/L CaCl2溶液,土水比为1 g∶10 mL,振荡提取24 h。提取后的溶液过0.45 μm有机滤膜得到土壤浸提液,置于4 ℃保存。
1.5 成组生物毒性试验
发光菌急性毒性试验:每瓶费氏弧菌冻干粉加入3 mL菌体复苏液,混匀制成菌悬液。土壤浸提液用30.0 g/L的NaCl溶液稀释成不同浓度,各取1 mL分别加入0.1 mL渗透压调节液,摇匀,加入到96孔酶标板,每孔200 μL,每个样品设置3个平行。向已加入空白对照样品和试验样品的酶标板中添加复苏好的菌悬液,每孔10 μL,室温下放置,15 min后用酶标仪测定混合液的发光强度。空白对照组为30.0 g/L 的NaCl溶液。
大型溞急性活动抑制试验:添加ASTM培养基将土壤浸提液稀释成不同浓度试验溶液,每种试验溶液加入5只溞龄<24 h的幼溞,每个浓度设4个平行,观察并记录24、48 h大型溞的活动情况。试验期间不喂食。空白对照组为ASTM培养基。
大型溞繁殖毒性试验:在大型溞急性活动抑制试验的基础上开展大型溞繁殖毒性试验。添加ASTM培养基将土壤浸提液稀释成不同浓度试验溶液,每个试验溶液加入1只溞龄<24 h的幼溞,每个浓度设10个平行,观察21 d内繁殖的幼溞数量。试验期间,每3天更换试验溶液,每天以小球藻浓缩液喂食,繁殖的幼溞及时计数并移出试验容器。空白对照组为ASTM培养基。
白符跳急性毒性试验:将污染场地土壤样品与人工土壤混合成不同质量分数,称取30 g放入培养皿中,加水至饱和持水量的50%,老化48 h,同时设置人工土壤作为空白对照组。每个培养皿引入10只9~12 d的白符跳。7 d后观察,记录死亡数并计算死亡率。空白对照组和试验组各设置4个平行。急性毒性试验期间不喂食。
白符跳繁殖毒性试验:在白符跳急性毒性试验基础上设置5个质量分数的混合土壤,第21天记录成虫的存活数,并将成虫移走等待卵孵化。第28天记录幼虫数量。试验期间,每周以酵母粉喂食。空白对照组为人工土壤。
玉米种子发芽与根伸长试验:将污染场地土壤样品与人工土壤混合成5个不同质量分数,每个质量分数设置3个平行,称取100 g放入结晶皿中,加入去离子水使含水率为70%±5%,每个结晶皿均匀放入10颗玉米种子。20 ℃黑暗条件下培养,当空白对照组(人工土壤)的根长≥20 mm时,结束试验,测量每颗种子的根长。
1.6 数据统计与分析
半数抑制浓度(IC50)、半数致死浓度(LC50)以及半数效应浓度(EC50)的计算采用修正版斯皮尔曼-卡伯法,无可观察效应浓度(NOEC)的计算参照文献[13]。剂量—效应曲线采用Origin 8.1中的Logistic函数拟合。
1.7 毒性单位分级评价法
参考文献[4]将IC50、LC50、EC50、NOEC转化为毒性单位。
如受试生物的效应分数未达到50%,毒性单位按照下式计算:
TU=RE×10 000/50
(1)
式中:TU为毒性单位;RE为100%污染场地土壤或其浸提液对受试生物的抑制率或致死率,%。
每项试验单独计算TU,所有试验的TU平均值作为最终TU。根据最终TU将土壤毒性划分为5个等级(见表2)。
1.8 TBI法
参考文献[3]和[14],计算TBI和判别系数(C)。
基于TBI的毒性标准见表3。

表2 基于毒性单位的土壤毒性分级标准Table 2 Toxicity classification for soils based on TU

表3 基于TBI的土壤毒性分级标准Table 3 Toxicity classification for soils based on TBI
2 结果与讨论
2.1 成组生物毒性测试结果
2.1.1 发光菌急性毒性试验
7个污染场地土壤的浸提液发光菌急性毒性试验结果如图1所示。质量分数10%(即稀释为原土壤浸提液的10%,其余类推)、20%、40%、80%、100%的GDSG土壤浸提液均具有发光抑制效应,发光抑制率为11.9%~63.5%。SXXY、SXYQ、JSKS、GDGZ、SXTY1以及SXTY2低浓度组都表现出生物毒性兴奋效应,高浓度组(质量分数超过80%)才表现出明显的发光抑制效应,其中质量分数100%组的发光抑制率均超过90%。
2.1.2 大型溞急性活动抑制与繁殖毒性试验
SXXY、SXYQ、JSKS、GDGZ及SXTY1所有试验组均未显示出活动抑制效应。GDSG、SXTY2土壤浸提液大型溞急性活动抑制试验结果如图2(a)所示。GDSG土壤浸提液对大型溞的活动抑制率存在明显的剂量—效应关系;SXTY2土壤浸提液低浓度组未显示出活动抑制效应,质量分数100%组的活动抑制率约为60%。
GDGZ、SXTY1所有浓度组的繁殖抑制效应并不突出,繁殖抑制率分别为4.29%~11.5%和4.17%~9.72%;GDSG、SXXY、JSKS、SXYQ以及SXTY2土壤浸提液对大型溞的繁殖抑制率存在明显的剂量—效应关系(见图2(b))。由于GDSG土壤浸提液质量分数10%组对大型溞有急性致死效应,繁殖试验的最高质量分数为8%,其繁殖抑制率为42.2%。SXXY、JSKS、SXYQ以及SXTY2土壤浸提液质量分数100%组的抑制率分别为58.3%、47.3%、46.9%和20.6%。
2.1.3 白符跳急性毒性与繁殖毒性试验
白符跳急性毒性如图3(a)所示,GDSG、SXTY2以及GDGZ对白符跳的存活抑制率与浓度存在明显的剂量—效应关系,质量分数100%组的存活抑制率分别为56.7%、66.7%以及36.7%。SXXY、SXYQ、JSKS和SXTY1表现出较低的毒性效应,质量分数100%组的存活抑制率分别为6.7%、3.3%、3.3%和10.0%。
白符跳繁殖毒性测试结果如图3(b)所示,SXTY2、SXTY1、GDSG、GDGZ以及SXXY对白符跳的繁殖抑制率与浓度存在明显的剂量—效应关系,质量分数100%组的繁殖抑制率分别为81.0%、60.2%、60.7%、61.7%以及26.3%。SXYQ以及JSKS未表现出明显的毒性效应,质量分数100%组的繁殖抑制率分别为0.9%和2.0%。
2.1.4 玉米种子发芽与根伸长抑制试验
7种污染场地土壤均未对玉米种子发芽产生抑制效应,但对根伸长产生了不同程度的抑制效应,结果如图4所示。玉米种子的根生长抑制率与SXTY1土壤存在明显的剂量—效应关系,质量分数100%组的根长抑制率为52.9%。SXXY、SXYQ、GDGZ、GDSG质量分数100%组的根长抑制率分别为22.9%、12.9%、26.4%、18.5%,与空白对照组有显著性差异(P<0.05)。JSKS和SXTY2未表现出明显的毒性效应,质量分数100%组的根长抑制率分别为5.40%和9.67%。
不存在对所有污染物都敏感的生物毒性测试方法,单一测试难以准确评价污染土壤对生态系统的危害,生物组合测试具有更高的敏感性和生态相关性,能更全面地解释毒性效应和毒性机制[15]。高灵敏度的单一测试是成组生物毒性测试方法的关键[16]5-6,[17]。本研究基于ISO 17616:2019,又兼顾了土壤浸提液和土壤,并参照美国环境保护署提出的废水综合生物毒性测试至少需3种生物进行测试[18]的要求,选择发光菌、大型溞、白符跳以及玉米种子开展综合毒性测试。有研究表明,发光菌(以费氏弧菌为例)对于大多数环境污染物的响应有足够的灵敏性[16]7。大型溞广泛应用于水质监测和水生生物毒理研究,对水环境中多种有毒化学物质敏感性强[19]。与蚯蚓相比,跳虫对土壤污染物更加敏感[20-21]。玉米是世界三大粮食作物之一,具有重要的经济价值以及地区生态学价值。因此,本研究选择的4个受试生物为对污染物响应敏感的生物或者具有重要的生态学价值的生物。多营养级的成组生物毒性测试能有效评估样品的毒性[16]9,本研究选择的4种生物包含分解者、水生生态系统消费者、陆生生态系统消费者、陆生生态系统生产者。需要说明的是,不同场地土壤浸提液的营养元素存在差异,这种差异会对藻类的生长与生理指标产生影响,干扰藻类生长抑制试验的结果[2]7,因此,未选择藻类开展生物组合测试。
从本研究的7个污染场地土壤测试结果来看,不同物种的急慢性毒性效应有差异,证实了对代表不同营养水平的生物体进行成组生物毒性测试的必要性[14]16。其中发光菌的敏感性最高,对7个污染场地土壤浸提液均有响应。大型溞对两个污染场地土壤浸提液有急性毒性响应,对5个污染场地土壤浸提液有繁殖毒性响应。白符跳对3个污染场地土壤有急性毒性响应,对5个污染场地土壤有繁殖毒性响应。因此,基于大型溞和白符跳的试验结果,繁殖毒性敏感性高于急性毒性,符合繁殖终点一般比存活更敏感[22-23]的结论。玉米种子的敏感性较差。
2.2 基于ISO 17616:2019毒性标准的毒性评价
汇总2.1节的质量分数100%组的生物毒性数据,结果见表4。ISO 17616:2019列出了发光菌、溞类急性毒性,白符跳繁殖毒性以及植物种子生长抑制参考标准,抑制率限值分别为20%、20%、50%和30%;此外,还根据网纹溞(Ceriodaphniadubia)繁殖毒性抑制率限值为30%,赤子爱胜蚓(Eiseniafetida)等初级消费者急性毒性抑制率限值为20%,分别作为大型溞繁殖毒性和白符跳急性毒性参考标准。按照1项试验结果毒性超标即判断为有毒的原则,7个污染场地土壤毒性综合判断均有毒。
2.3 基于毒性单位分级评价法的毒性评价
根据2.1节的生物毒性数据,采用1.7节所述的方法计算各污染场地土壤或其浸提液的效应浓度,结果见表5。
根据1.7节所述的毒性单位分级评价法,计算各样品以不同受试生物开展的毒性试验的毒性单位,并评估毒性,结果见表6。结果表明,7个污染场地土壤的滞留功能,GDSG为高毒,SXTY1和GDGZ为低毒,其余均为中毒;7个污染场地土壤的栖息地功能,GDGZ、GDSG、SXTY1、SXTY2为中毒,SXXY为低毒,JSKS和SXYQ为无毒。
2.4 基于TBI法的毒性评价
根据2.1节的生物毒性数据,采用1.8节所述的方法计算各污染场地的TBI并评价毒性,结果见表7。
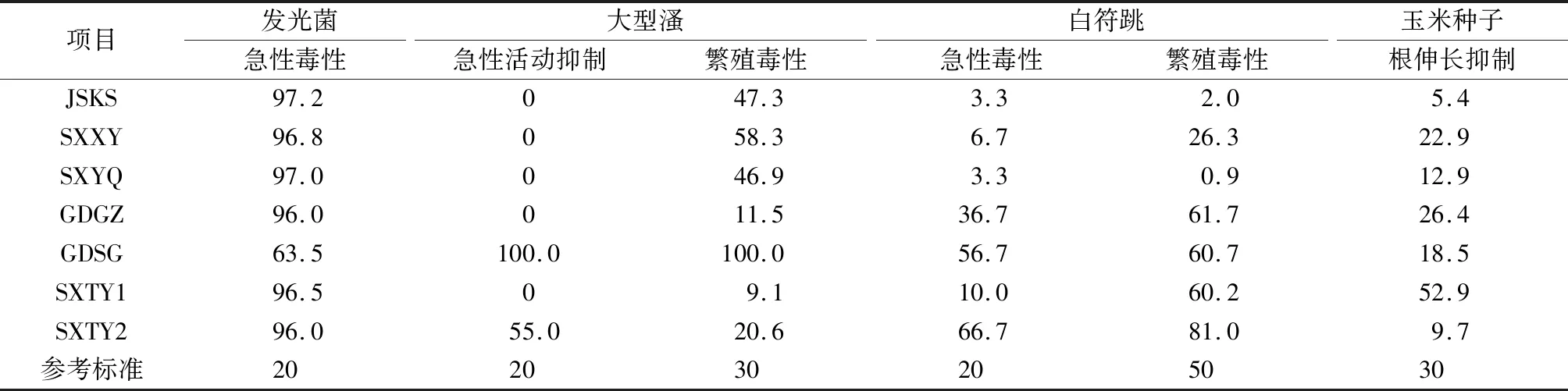
表4 污染场地土壤或浸提液质量分数100%组的抑制率Table 4 Inhibition rate of 100% treatment groups of contaminated sites soils or leachates %
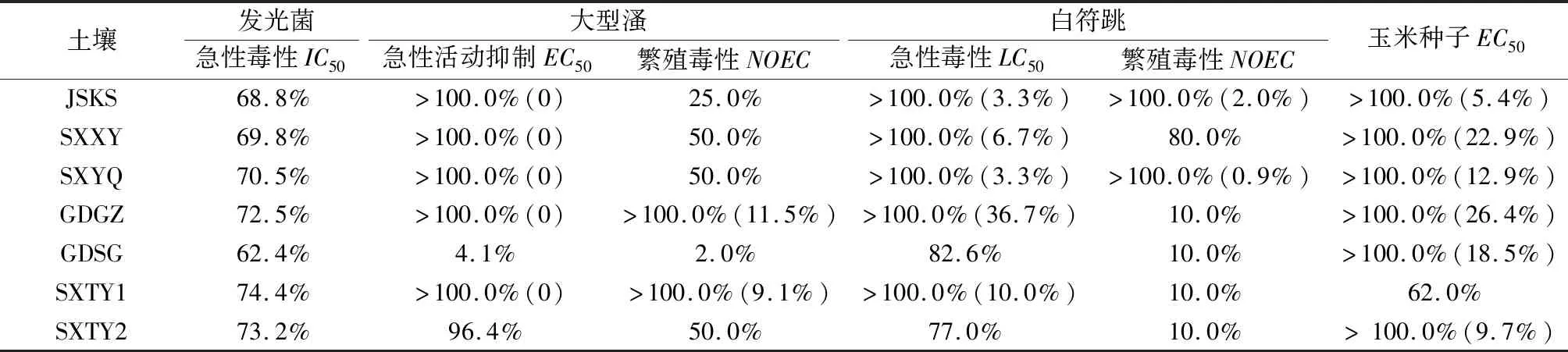
表5 污染场地土壤或浸提液的效应浓度1)Table 5 Effect concentration by contaminated sites soils or leachates
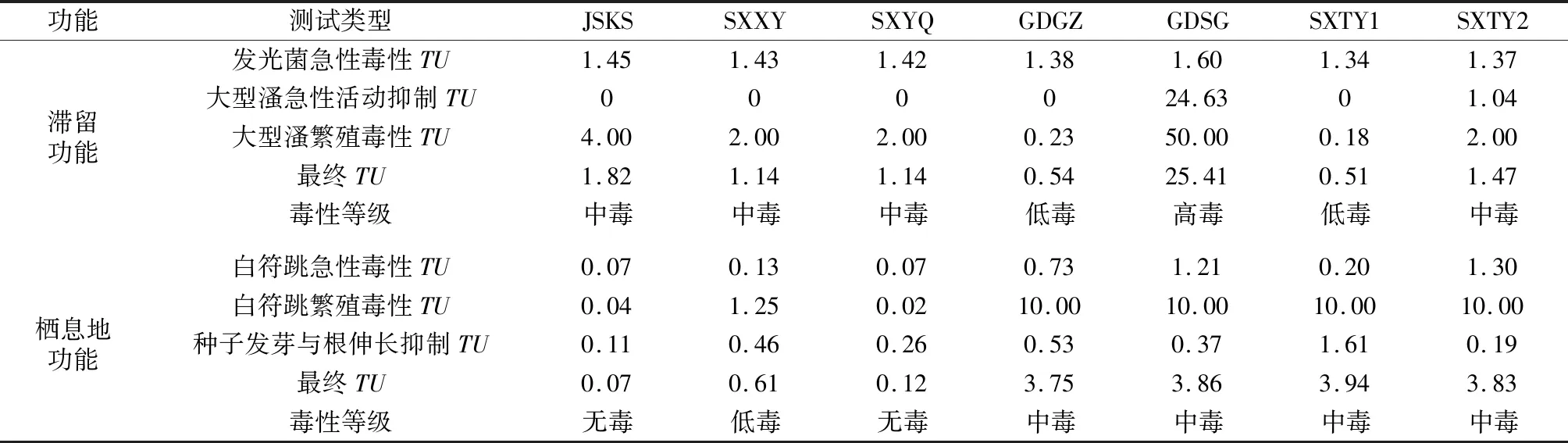
表6 污染场地土壤或浸提液的毒性单位与生态毒性评估Table 6 Toxic unit and ecotoxicity assessment for contaminated sites soils or leachates
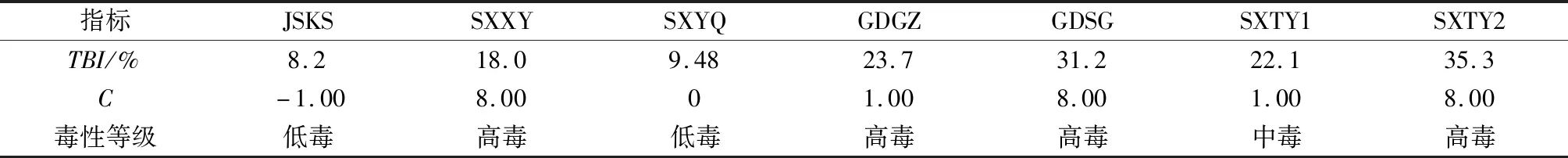
表7 污染场地土壤TBI与生态毒性评估Table 7 TBI and ecotoxicity assessment for contaminated sites soils

表8 ISO 17616:2019毒性标准、毒性单位分级评价法与TBI法的比较Table 8 Comparison of toxicity standard from ISO 17616:2019,toxicity unit classification system method and TBI method
表7结果表明,JSKS、SXYQ为低毒,SXTY1为中毒,SXXY、GDGZ、GDSG、SXTY2为高毒。
通过毒性标准将成组毒性测试所得的多个毒性数据整合成易于理解的单一值,有助于土壤环境管理进行有关的决策[14]2。总体看来,本研究采用的3种方法都实现了成组生物毒性测试结果的整合。毒性单位分级评价法、TBI法的评价结果均指示7个污染场地土壤有毒,与ISO 17616:2019毒性标准的评估结果一致,但毒性单位分级评价法与TBI法判定的毒性程度存在差异。
表8对3种方法的算法难易程度、结果区分度、客观性以及结果可比性进行了分析。基于ISO 17616:2019毒性标准的毒性评价方法简单,只需要100%污染场地土壤或其浸提液的抑制率或死亡率,与标准限值比较即可得出结果。但由于发光菌的敏感性较强,基于ISO 17616:2019毒性标准的毒性评价结果全部为有毒。因此,该方法的结果易受敏感物种的影响,且不能进一步区分不同土壤的毒性高低,结果区分度低。基于毒性单位分级评价法的毒性评价算法简单,实现了滞留功能和栖息地功能的分别评价,有助于聚焦土壤受损功能。土壤健康状况主要用于评估土壤作为一个重要的生命系统发挥作用的能力[3]1937,聚焦土壤受损功能有助于后续的修复与利用。另外,该方法有统一的算法和毒性标准,可以实现不同研究结果、不同场地之间的比较。基于TBI法的毒性评估实现了土壤毒性的整体评价,但计算相对复杂,且该方法需要基质系数和严重度系数,需要使用者主观定值,尤其是严重度系数,需要根据测试项目指定。不同项目的成组生物测试由于严重度系数的差异,TBI法结果可能难以比较。
综上所述,毒性单位分级评价法能够聚焦土壤的受损功能,且算法与毒性标准可以统一,更具有推广应用价值。
3 结 论
(1) 采用发光菌、大型溞、白符跳以及玉米种子4种受试生物构建了成组生物毒性测试系统,对3个行业的7个污染场地土壤开展了成组生物毒性测试。4种生物的急慢性毒性效应有差异,发光菌的敏感性最高,大型溞和白符跳的繁殖毒性敏感性高于急性毒性,玉米种子的敏感性较差。
(2) 采用ISO 17616:2019毒性标准、毒性单位分级评价法与TBI法评估了7个污染场地土壤的毒性。毒性单位分级评价法、TBI法的整体结果为污染场地土壤均有毒,与ISO 17616:2019毒性标准的评估结果一致,但毒性单位分级评价法与TBI法判定的毒性程度存在差异。
(3) 与ISO 17616:2019毒性标准、TBI法相比,毒性单位分级评价法算法简单,能够聚焦土壤受损功能,算法与毒性标准可以统一,更具有推广应用价值。

