药物转运体的翻译后处置及相关关键位点研究进展
洪 梅,王旭阳
(华南农业大学 生命科学学院, 广东 广州 510642)
药物在体内的吸收、分布、代谢 (生物转化) 和排泄 (Adsorption, distribution, metabolism, excretion,ADME) 过程,除了与传统的I相和II相代谢酶相关外,也取决于被看作是0相和III相的药物转运过程[1]。近年来,药物代谢动力学、药物效应动力学以及生物化学和分子生物学技术迅速发展,转运体(蛋白)对各类药物,尤其是口服药物的影响越来越受到人们的重视。药物转运体是决定细胞内药物积累的关键因素,其活性往往与药物的治疗效果、毒性及药物-药物相互作用 (Drug-drug interaction) 直接相关。在新药设计和对个体间不同药物反应的分析预测中,药物转运体往往也被认为是一个新的靶标[2]。转运体在药物ADME过程中具有重要作用,其转运功能必然受到多个层次的调控。转运体的调控主要分为长时 (Long-term) 和短时 (Short-term) 调控。长时调控主要为转运体表达量的调控,通过改变基因表达水平实现,由于涉及到基因的转录、翻译过程,往往需要几个小时甚至更长的时间;短时调控则主要指翻译后调控过程,由于是对已有的蛋白质进行修饰,所以只需要较短的时间,几分钟到一两个小时就能实现。在对药物、食物的摄取过程中,人体往往通过短时调控以实现对这些变化的快速应对[3]。
近年来冷冻电镜等物理技术快速发展,已有一些膜蛋白的高分辨晶体结构获得了解析,但膜蛋白表面结构的两亲性、在组织中的低浓度以及它们固有的构象灵活性使得难以获得稳定的转运体晶体[4],因此相对于可溶性蛋白,膜蛋白三维结构的解析仍进展较为缓慢。且蛋白序列中所具有的影响其空间构象折叠、在不同细胞器中的处理修饰及调控蛋白质整体结构的特殊基序,往往无法通过晶体结构进行深入的分析,因此目前仍有大量研究利用传统的生化手段揭示这类膜蛋白的关键结构。转运体的关键结构包括翻译后处置的识别基序、翻译后修饰位点、用于组装和蛋白质-蛋白质相互作用的结构域以及跨膜结构域等。这些重要位点的变化可能会改变转运体的稳定性、与底物的相互作用以及跨膜转运的能力。
本文总结了目前与药物转运体的翻译后加工和修饰相关的研究成果,其中对在这些调控过程中发挥关键作用的转运体基序和位点进行了重点阐述,为系统深入地解析转运体药物转运的分子机制、阐明遗传多态性造成的个体药物响应差异提供一定的参考。
1 药物转运体及基本结构特征
根据转运结构和分子机制的不同,人体中的药物转运体分为外排转运体和摄取转运体,前者主要为ATP结合盒 (ATP-binding cassette,ABC) 超家族成员,后者则属于溶质载体 (Solute carrier, SLC) 超家族。
1.1 ABC超家族
ABC转运体是一类ATP驱动泵, 广泛分布于细菌到人类的各种生物体中,在人体肝脏、小肠和肾等器官的质膜中分布丰富,能将天然毒物和代谢废物排出体外。ABC转运体的底物包括内源性的脂质、胆汁酸以及异源性的物质如毒素和多种药物[5]。典型的 ABC 转运体序列中包含3个基序:Walker A、Walker B序列以及ABC特征序列 (即C基序,“LSGGQ”)[6]。1个完整的ABC转运体由2个核苷酸结合域 (Nucleotide binding domain,NBD) 和2个跨膜域 (Transmembrane domain,T M D) 组成。每个T M D包含6个跨膜螺旋(Transmembrane helix, TM),主要参与底物识别、结合和转运;而NBD则负责ATP的结合和水解,从而促进底物的运输[7]。不同ABC 蛋白间的整体序列相似性低,尤其是在TMD中,这与跨膜螺旋参与转运体对不同物质转运的概念相符合;另一方面,NBD在结构上则比较保守[8]。药物通过TMD的转运和在NBD上发生的ATP水解必须协同工作才能实现底物的外排,因此域间通信对于转运体正常功能的发挥至关重要[9]。
外排药物转运体主要包括ABCB亚家族的ABCB1,也称为P-糖蛋白 (P-glycoprotein, P-gp);ABCC亚家族的ABCC1,也称为多药耐药相关蛋白1(Multidrug resistance protein 1,MRP1);ABCG亚家族的ABCG2, 也称为乳腺癌耐药蛋白(Breast cancer resistance protein,BCRP)。它们在多种器官组织中都有表达,如P-gp在血脑屏障(Blood-brain barrier) 中表达,是阻止药物穿越血脑屏障的重要因素。此外,许多肿瘤细胞在药物压力下会过表达这些外排转运体,是造成抗肿瘤药物多药耐药的关键原因[5]。
1.1.1 P-糖蛋白 (P-gp/ABCB1) P-糖蛋白最显著的特征之一是它可以结合并转运数百种结构和功能多样的底物[10],其底物主要是具有不同相对分子质量的疏水性和两亲性化合物,含有不同的化学基团 (如芳香环、甲氧基、酰胺键等),以及具有不同拓扑结构 (如有机分子、线性和环状肽、共轭结构等)的化合物。近年的晶体结构解析获得了小鼠Pgp的精细结构,该结构显示该蛋白具有2个向膜内叶开放的入口,由一侧的TM3和4以及另一侧的TM9和10所构成[11-12]。P-gp 的显著特征之一是药物的结合口袋中没有携带正电荷或负电荷的氨基酸残基。因此,底物和蛋白质残基之间的相互作用主要是氢键、范德华力和疏水相互作用[10]。在所有P-gp的跨膜螺旋中都具有影响其功能的关键氨基酸残基,其中大部分是疏水或极性的[13]。
1.1.2 多药耐药相关蛋白1 (MRP1/ABCC1) MRP1被认为是造成多药耐药 (Multidrug resistance,MDR) 的第2个主要外排转运蛋白[7]。 除了抗癌药物阿霉素、长春新碱和甲氨蝶呤,MRP1还转运多种谷胱甘肽、葡糖苷酸和硫酸盐共轭有机阴离子,如白三烯 C4 (Leukotriene C4, LTC4)、17-β-(D-葡糖苷酸) (Estradiol-17-β-glucuronide, E217βG) 和硫酸雌酮 (Estrone sulfate)等。除了2个NBD和2个TMD组成的典型核心结构外,MRP1还包含由5个跨膜螺旋所组成的TMD0区域,该区域前面是1个位于胞外的氨基末端,其羧基端则通过1个L0 接头序列与TMD1连接[7],因此MRP1具有17个跨膜螺旋。
定点突变后进行的转运能力检测揭示,MRP1的所有跨膜螺旋中均含有行使正常功能所必需的氨基酸残基,特别是在TM4、6、7、8、10、11、14、16和17中[13]。与P-gp不同的是,许多影响MRP1底物结合、底物特异性和选择性的关键残基是携带电荷的氨基酸。因为MRP1主要是1个阴离子泵,因此携带正电荷的氨基酸如精氨酸、组氨酸和赖氨酸都可能在底物结合和转运中起重要作用[7]。
1.1.3 乳腺癌耐药蛋白(BCRP/ABCG2) BCRP是先天性和获得性多药耐药的一个重要分子,对于调节药物生物利用度、造血和实体恶性肿瘤的预后预测以及癌症干细胞的保护均有作用[14]。BCRP分子中只有1个NBD和1个含有6个跨膜螺旋的TMD,因此被认为是1个半转运蛋白,往往需要形成二聚体或更高阶的寡聚体才能发挥转运功能[14]。与P-gp和MRP1类似,BCRP的所有6个跨膜螺旋中都含有影响其正常功能的关键氨基酸残基。ABCG2基因编码区中已发现多个自然变异的单核苷酸多态性 (Single nucleotide polymorphism, SNP),如跨膜螺旋中的关键氨基酸残基发生了突变,就有可能造成BCRP功能的改变,造成生理和药理学后果[13]。
1.2 SLC超家族
溶质载体 (Solute carrier, SLC) 超家族是人类细胞膜上最重要的膜转运体家族之一,它参与了细胞间的物质运输、能量传递、营养代谢、信号传导等重要生理活动。SLC超家族包括52个亚家族,共有400多名成员。研究表明,人类基因突变所致的SLC蛋白表达异常或功能缺陷与糖尿病、高血压、抑郁症等多种重大疾病密切相关[15]。SLC 超家族成员广泛存在于原核和真核生物中,其成员的功能多样,转运底物包括糖类、氨基酸、无机盐离子、维生素、神经递质、多肽及多肽类药物等众多离子和小分子物质[13]。
摄取型药物转运体主要包括有机阴离子转运多肽(SLCO) (也称为Organic anion transporting polypeptide, OATP)亚家族中的OATP1A2、1B1、1B3以及2B1,SLC22 (也称为Organic anion transporter/Organic cation transporter, OAT/OCT) 亚家族中的OAT1、3、4以及OCT1和2,SLC15 (也称为Peptide transporter, PepT) 亚家族中的PepT1和2等。此外,近年来的研究发现,SLC47(Multidrug and toxin extrusion, MATE) 家族的成员在药物转运过程中也发挥着重要作用,但SLC47家族成员主要发挥外排功能。
1.2.1 SLCO (OATP) 以Na+和ATP非依赖性的方式跨膜转运各类结构多样的内源和外源物质,其底物包括胆酸盐、类固醇以及类固醇结合物、甲状腺激素等内源性物质,微囊藻毒素等毒素和异源性物质,其中的家族成员OATP1A2、1B1、1B3和2B1对多种重要的临床药物如他汀类降脂药物、治疗高血压病和充血性心衰的血管紧张素转换酶抑制剂、强心苷类药物、抗肿瘤药物、抗生素药物等具有转运能力,因此被认为是重要的药物摄取转运体[16]。OATP功能的缺失,会造成人体药物排除或解毒障碍,从而造成药物诱导的肝或肾衰竭。OATP家族成员在多种上皮屏障中表达,包括肠上皮细胞、肝细胞、肾小管细胞和血脑屏障[17]。计算机亲水分析模型预测OATP家族成员 (含有643~722个氨基酸) 具有非常相似的跨膜结构域构造,OATP都含有12个跨膜螺旋和1个带有大量保守半胱氨酸残基的大胞外环5。有1个OATP的家族特征序列 D-X-RW-(I,V)-GAWWX-G-(F,L)-L位于胞外环3和TM6的边界处[18]。
对OATP家族成员OATP1B3和2B1的同源建模指出,这些转运体靠近氨基端的TM1、2、4、5和靠近羧基端的TM7、8、10、11构成与底物相互作用的通路,而TM3、6、9和12则主要嵌入在膜双层中[19]。与该模型相一致,生化研究在TM1、2以及TM7、8、10和11中都鉴定到与底物转运密切相关的关键氨基酸残基,对OATP功能的发挥或底物的选择起重要作用[13]。
1.2.2 SLC22 (OAT/OCT/OCTN) 由SLC22基因家族编码的有机阴离子转运蛋白是另一个多特异性的转运体家族,可介导各种更小、更亲水底物的转运,如类固醇激素缀合物、生物胺、各种药物和毒素[20]。OAT在全身不同组织的细胞膜上表达,肾脏的OAT1和OAT3是药物排泄过程中重要的转运体,通过反膜电位交换β-酮戊二酸对有机阴离子进行转运,而该浓度梯度由次级主动转运蛋白钠-二羧酸协同转运体维持。除了OAT,SLC22家族的药物转运蛋白还包含主要转运有机阳离子的有机阳离子转运体OCT1和OCT2,以及有机两性离子/阳离子转运体OCTN1和OCTN2。OCT的底物包括范围广泛的、结构上不相关的小分子有机阳离子,例如类固醇、激素、神经递质、多种药物和其他外源性物质。OCT介导有机阳离子沿其电化学梯度被动扩散,因此转运可能发生在任一个方向上[21]。
与OATP家族相似,计算机模型预测SLC22家族成员具有12个跨膜螺旋结构,其氨基和羧基末端位于细胞内[22]。TM1和2之间有1个大的细胞外环,TM6和7之间有1个大的细胞内环。以大肠埃希菌甘油-3-磷酸转运体 (GlpT) 的晶体结构为基础进行人体OAT1同源建模,结果显示,TM5、7、8、10和11围绕在该转运蛋白的负电性活性位点的周围,该活性位点在胞质方向开放,被TM5的Tyr230和TM10的Lys431、Phe438包围[23]。生物化学研究也在TM1、2、5、7、10和12上发现了多个与OAT1功能相关的关键氨基酸残基[13]。另一方面,基于大肠埃希菌乳糖渗透酶LacY的晶体结构进行同源性建模预测,OCT1与底物的相互作用可能是发生在一个区域内而非单个结合位点,其中TM4、10和11都存在可能参与底物结合和转运的关键氨基酸[24]。关于OCTN的研究则发现,其中的TM3、4、7、9、10和11可能与其转运功能有关[13]。但OCTN2以Na+依赖性的方式转运肉碱而以Na+非依赖性的方式转运有机阳离子,研究发现参与这2种转运过程所涉及的关键氨基酸残基有重叠但并非完全相同[25]。
1.2.3 SLC15 (POT/PTR) 质子偶联寡肽转运体(Proton oligopeptide transporter/Peptide transporter,POT/PTR家族或SLC15家族) 负责跨细胞膜转运8000多种不同的二肽和三肽配体[26],除了摄取和滞留膳食蛋白质的二肽和三肽以促进细胞代谢外,POT/PTR还在识别和转运抗生素、抗病毒药物和抗肿瘤药物中扮演着关键角色[27]。POT/PTR家族转运体是质子驱动的同向转运体,使用内向的质子电化学梯度来驱动肽在细胞膜上的摄取[28]。
PTR可能包含一个可容纳不同方向的肽的结合位点,因此具有广泛的底物转运能力。人体中有2个POT/PTR家族成员:PepT1 (SLC15A1) 和PepT2 (SLC15A2),表现出不同的转运动力学特性。PepT1转运二肽和三肽的Km值在较低的mmol水平[29];而 PepT2对其底物具有更高的亲和力,Km值在μmol范围内。通过定点突变对PepT1和PepT2 跨膜螺旋进行分析,鉴定出TM2、3、4、5、7、8和10均含有与其摄取功能相关的关键氨基酸残基[13]。
1.2.4 SLC47 (MATE) 外源性有毒化合物的排出对维持细胞的稳态必不可少。多药和有毒化合物排出蛋白(Multidrug and toxin extrusion, MATE) 为次级主动转运蛋白,参与各种化合物跨细胞和细胞器的转运。人体MATE在肝脏和肾脏均有高表达,主要分布于肝细胞的顶端及肾近端小管的刷状缘膜上,参与体内阳离子药物清除,其转运谱与OCT和OCTN所转运的药物多有重合[30]。MATE是一种电中性、不依赖Na+的pH依赖型质子逆向转运体,预测含有13个跨膜螺旋,其羧基端位于胞外。但研究发现,MATE的功能核心是由12个跨膜螺旋而非13个跨膜螺旋组成[31]。对MATE的TM7螺旋上的氨基酸残基进行突变后进行生化分析发现,突变体与底物结合能力降低,转运功能下降,说明该跨膜螺旋是MATE功能发挥的关键结构[32]。
图1总结了上述药物转运体在人体中的分布,这些跨膜蛋白在药物吸收、代谢和排泄的主要组织器官中表达,协同作用影响各类药物的生物利用度。
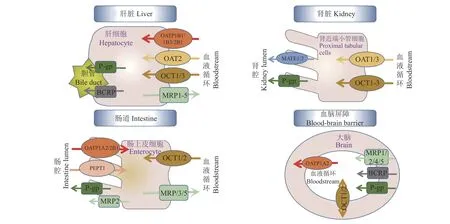
图1 药物转运蛋白在人体各组织器官中的分布Fig. 1 Distribution of drug transporters in human tissue and organs
1.3 转运体在细胞中的处置过程
在正常的细胞生理过程中,新合成的转运体往往需要经历一系列的翻译后处置过程才可以正确靶向到其行使功能的质膜上。翻译后修饰在协调新合成转运体的折叠和靶向上发挥着重要的作用。发生在内质网 (Endoplasmic reticulum)和高尔基体中的过程通常被称为“中央质量控制”,而发生在质膜附近的调节机制则被称为“外围质量控制”,通过调节质膜附近的内体循环和溶酶体降解控制转运体的动态平衡。中央和外围质量控制途径相互关联并协同工作,在胞内传输转运体-将其从内质网和高尔基体靶定到质膜,或将其传送到各种细胞内降解机制 (如内体、溶酶体、蛋白酶体、聚集体降解等)。由于受到如此复杂而精细的调控,在转运体序列中任何一个关键序列或位点的错误都可能导致其错误的折叠、靶定,滞留在错误的位点或无法行使正常的功能。例如,由ABCC7编码的囊性纤维化跨膜电导调节因子(Cystic fibrosis transmembrane conductance regulator) 的错误折叠和降解是导致囊性纤维化的主因,但由于对其机制的了解,目前可采用辅助其折叠及增加其稳定性的药物,如复方鲁马卡托和依伐卡托,作为相关患者的治疗选择[33]。
2 药物转运体的翻译后修饰及相关的关键位点
近年来,研究者们提出了一个“Proteoforms”的概念,即对于同一个蛋白,由于其翻译后修饰(Post-translational modification) 的不同而产生一系列在功能、构象、表达位点等方面略有不同的蛋白种类,以应对细胞中不同微环境变化的需求[34]。由于翻译后修饰是对已有的蛋白质进行修饰,所以只需要较短的时间就能实现。在对药物的摄取过程中,人体往往通过这种短时调控的方式快速应对这些变化[3]。
2.1 蛋白激酶调控及相关位点
2.1.1 ABC转运体 哺乳动物的蛋白磷酸化主要发生在肽链中的酪氨酸、丝氨酸、苏氨酸残基上,这些残基上具有游离的羟基,且本身不带电荷,当磷酸化作用后,蛋白质便具有了电荷,从而使结构发生变化,进一步引起蛋白质活性的变化[34]。研究发现,P-gp受蛋白激酶C(Protein kinase, PKC)和蛋白激酶A (Protein kinase A, PKA) 的调控。其中Ser661、671、667、675、683中的1个或多个可能为PKC的磷酸化位点。进一步的研究揭示,PKC可直接磷酸化Ser661、667和671,PKA则磷酸化Ser683。但应该指出的是,PKC和PKA磷酸化是否显著影响P-gp的易位和功能仍存在争议-因为同时突变P-gp的5个丝氨酸残基 (Ser661、667、671、675 和 683) 并不影响该蛋白靶向质膜或改变转运体的多药耐药性[35]。MRP1受酪氨酸激酶2(Casein kinase 2, CK2) 调节,该激酶是一种高度保守的丝氨酸/苏氨酸蛋白激酶,被认为是细胞的“主要调节剂”之一,参与细胞生长、增殖、死亡和存活的相关过程。位于第249位的苏氨酸是MRP1受CK2调节所必需的残基。用丙氨酸取代Thr249使MRP1无法发生磷酸化会导致该转运体功能显著降低,而将Thr249进行磷酸化模拟突变为谷氨酸则导致转运蛋白功能增加。Thr249的突变消除了MRP1对CK2的反应,表明CK2是通过该残基磷酸化调控MRP1的[36]。BCRP的功能可能与Pim-1/Pim-1L相关,当位于ATP结合口袋和跨膜结构域间接头区域的Thr362被突变为丙氨酸时,会影响质膜上BCRP的表达和蛋白质的二聚化或寡聚化[37]。
2.1.2 SLC转运体 研究发现,OAT家族成员OAT1受到PKC的调控,PKC的激活可加速OAT1的内化,降低其在质膜上的表达,导致转运功能下降[38]。血清和糖皮质激素诱导蛋白激酶2(Serum and glucocorticoid inducible kinase 2, SGK2)则被发现对OAT1在细胞膜上的表达有促进作用,过表达SGK2可增加OAT1的最大转运速度(vmax)而对其与底物的亲和力无影响[39]。但无论是PKC还是SGK2似乎都不是通过直接磷酸化OAT1发挥作用的。非受体酪氨酸激酶家族Src的成员Yes1可以直接磷酸化OCT2,显著影响其功能。OCT2转运奥沙利铂会造成急性感觉神经病变,因此在使用奥沙利铂时,联合临床用于肿瘤治疗的Yes1抑制剂达沙替尼,可有效降低奥沙利铂的副作用。Yes1对OCT2的作用是直接的,酪氨酸激酶抑制剂可抑制OCT2的磷酸化水平。质谱分析发现OCT2序列中的Tyr241、362、377均被磷酸化,且对3个位点的苯丙氨酸突变体进行动力学分析表明,3个突变体的转运功能均下降,其中Y362F造成的影响最大[40]。OATP家族成员的功能则被发现受丝氨酸/苏氨酸激酶的影响,如PKC[41-43]和CK2[44]。虽然有多个研究尝试确定PKC在这些转运蛋白序列上的直接磷酸化位点,迄今获得的结果仍均为阴性[41,43]。2021年的一项关于临床酪氨酸激酶抑制剂(Tyrosine kinase inhibitor, TKI)造成的药物-药物相互作用的研究发现,多种TKI药物包括尼洛替尼可显著抑制OATP1B1的功能,该抑制作用可能与OATP1B1的Tyr645磷酸化有关,该调控过程所涉及的激酶为Src家族的Lyn[45]。PepT1和PepT2分别包含着2个和1个与血清和糖皮质激素诱导激酶 1 (Serum and glucocorticoid inducible kinase 1,SGK1) 相关的潜在磷酸化位点 (R-X-R-XX-S/T)。当PepT2中的Ser185磷酸化位点突变为丙氨酸时,SGK1对该转运蛋白的调节被大大抑制[46]。MATE家族成员MATE1上有2个预测的磷酸化位点 (Thr17、299),而MATE2则可能包含4个磷酸化位点 (Ser544、586, Thr588、594),但其所涉及的具体机制并不清楚[47]。最近有研究认为CK2可能对人体MATE1有调控作用,因为抑制CK2可造成MATE1外排功能的下降[48]。
2.2 糖基化及相关位点
糖基化是新合成蛋白质最常见和最多样化的翻译后修饰方式。在大多数情况下,1个以上的碳水化合物单元被添加到蛋白质中,并通过N型或O型糖苷键连接在不同的位置。N-连接和O-连接寡糖链的末端糖具有不同的结构。整合膜蛋白和分泌蛋白合成后往往会进行糖基化修饰,N-糖基化在蛋白靶向、折叠、功能修饰,维持蛋白稳定性以及为配体提供识别结构等过程中发挥着重要作用[49]。
P-gp是高度糖基化的蛋白,在其预测的第1个胞外环中存在3个可能发生N-糖基化的共有氨基酸序列Asn-X-Thr/Ser (Asn91、94和99),对这些位点的定点突变使耐药性克隆的形成效率显著降低,表明这些位点的糖基化有助于P-gp的正确靶向或稳定性的维持[50]。2009年的一项研究发现,如破坏BCRP的N-糖基化,可加快转运蛋白的降解,但该降解过程可通过蛋白酶体抑制剂MG132来挽救;此外,N596Q的泛素化水平显著提高,表明如Asn596糖基化受影响,则蛋白的泛素水平增加,进而加速蛋白通过蛋白酶体的降解,同时也可能影响BCRP同二聚体的形成[51]。该结果与之前认为BCRP的糖基化不影响其蛋白水平和功能的报道不一致,有可能是因为使用的是不同的表达体系。
在OATP1B1细胞外环2和5上有3个糖基化位点 (Asn134、503和516),每个位点的单独突变均对蛋白的表达和功能没有影响,但当3个糖基化位点同时突变时,蛋白水平和转运功能显著下降。未糖基化的转运蛋白滞留在内质网内,降解速率可能增加[52]。OAT家族所有成员的第1个胞外环都含有潜在的N-糖基化位点。将OAT1 (Asn39、56、92和97)[53]和OAT4 (Asn39、56、63和99)[54]中所有的糖基化位点突变后,会导致转运蛋白滞留在胞质区室中,进而降低它们的转运功能。对OCTN2中糖基化位点的研究发现,预测的3个糖基化位点(Asn57、64和91) 中任何一个的突变都会降低肉碱的转运。当所有天冬酰胺残基同时被谷氨酰胺取代时,转运功能会完全丧失。显微镜观察发现突变的蛋白质滞留胞质;然而,如果仅利用糖基化抑制剂衣霉素处理OCTN2,则不影响该蛋白的成熟和质膜的靶向,表明OCTN2的糖基化位点除了与糖基化过程相关外,还在底物转运中发挥作用[55]。
2.3 泛素化及相关位点
近年来越来越多的证据表明泛素化在控制质膜蛋白的传送和靶向方面发挥着重要作用。泛素是一种由76个氨基酸残基组成的球状蛋白,在真核生物中高度保守,是泛素化过程的基本单元,可修饰底物蛋白的赖氨酸残基发生单泛素化(Monoubiquitinaion)、多重单泛素化 (Multiple monoubiquitination) 或多泛素化 (Polyubiquitination)。泛素化由泛素激活酶E1、泛素结合酶E2以及泛素-蛋白质连接酶E3这3种酶协调介导[56]。通过泛素修饰受体和通道蛋白,可以影响蛋白的降解、形成质膜内化和内体分选机制的识别信号,从而调节膜蛋白的稳定性、内化、细胞内分选和周转[3]。
糖基化抑制剂衣霉素处理会显著降低BCRP的蛋白水平,从而降低其介导的对抗癌药物SN-38的耐药性。当用谷氨酰胺代替BCRP位于第596位的糖基化位点Asn596后,非糖基化的N596Q蛋白水平仅为野生型的1/3,该突变体泛素化水平显著增加,且蛋白酶体抑制剂MG132可显著增加其蛋白水平,说明在BCRP中,糖基化与泛素化可能具有交互作用,糖基化丧失会导致蛋白不稳定,增加泛素介导的蛋白酶体降解[51]。
PKC加快了OAT1从细胞膜上内化的速度但不改变OAT1的重循环速度,因此造成细胞膜上OAT1水平的下降以及转运功能的降低[38]。OAT1内化之前的一个关键步骤是转运体的泛素化。在OAT1 TM6和7之间的大胞内环中鉴定出3个重要的泛素化位点,分别为Lys297、303和 315。这些赖氨酸残基在PKC调节的OAT1泛素化中发挥协同作用,突变其中任何1个赖氨酸残基都会阻止泛素与其他2个赖氨酸的结合[57]。
2.4 寡聚化及相关位点
从蛋白结构的角度来看,跨膜的通道和转运体在膜二维空间中的位置及取向使其易于形成多聚体复合物。大量研究表明,转运体,尤其是次级转运体,往往以寡聚体的形式存在。跨膜结构域内的几个保守基序,如GXXXG和七重亮氨酸序列对于寡聚化是非常关键的。寡聚化在蛋白质量控制中发挥作用,多个单体的适当结合可能有利于屏蔽内质网的保留信号或将多个不同输出信号拉近到一起,从而使相应的蛋白质复合物从内质网释放并靶向细胞表面[49]。
药物转运蛋白寡聚化的一个典型例子是BCRP。如前所述,该ABC家族成员是一个半转运蛋白,需要形成同二聚体或更高阶的寡聚体 (四聚体、八聚体或十二聚体)来发挥其功能。Xu等[58]鉴定了一个参与BCRP寡聚化的重要结构域TM5-ECL3-TM6,该结构域在HEK293细胞中表达时,会像完整蛋白一样形成寡聚体;此外,该结构域对BCRP的转运活性表现显性负性效应,可能因为其与BCRP形成寡聚体从而影响完整蛋白之间形成功能性的同源寡聚体。对该区域的进一步研究表明,TM5- ECL3-TM6的每个片段在BCRP寡聚化和转运功能中发挥着不同的作用;3个片段都参与寡聚化,但只有TM5对BCRP的功能是必不可少的[59]。MRP1可形成同源二聚体,其氨基端的281个氨基酸残基 (包括MSD0和L0结构域) 被证明参与二聚化并对MRP1的转运功能产生显性负性影响[60]。进一步的研究发现一个亚基中的TM5和ECL3可以与另一个亚基中的TM5和ECL3以序列非依赖的方式相互作用,TM5的位置和疏水性以及ECL3的长度对MRP1二聚体的形成可能非常关键[61]。
SLC家族成员也能形成同源寡聚体。OAT1在细胞膜中以寡聚复合物的形式存在[62],其TM6参与不同单体的接触使寡聚化发生。当多聚体状态被破坏时,质膜上的OAT1表达减少[63]。将TM2上可能与寡聚化相关的GXXXG基序中的G144和G148突变为丙氨酸会导致突变体在内质网中累积,无法靶向质膜,并随后被蛋白酶体降解。蛋白酶体抑制剂MG132虽然可以增加突变体总蛋白水平,但无法使其正确靶定到细胞表面[64]。OCT2单体间则通过共价二硫键以二聚体或更高级的寡聚形式存在。在TM1和TM2之间大胞外环上的6个半胱氨酸残基对OCT2的转运功能很重要,而位于质膜附近的Cys51和Cys143是影响OCT2寡聚化的重要氨基酸残基[65]。OATP1B1可形成寡聚体,且该寡聚体的形成可能影响其转运功能。在OATP1B1的TM8螺旋上有一个保守的GXXXG基序,将其中的G393残基突变会使寡聚体的蛋白间结合能力显著下降[66]。对OATP1B1寡聚化的进一步研究发现,在其TM3上有一个非典型的亮氨酸七重复序列与该转运体的寡聚化相关,将含有该亮氨酸七重复序列的TM3与完整的OATP1B1蛋白共表达,会显著降低OATP1B1的蛋白表达水平和功能。该七重复序列在OATP1家族中高度保守,因此可能也参与了OATP1B1和1B3间寡聚体的形成[67]。
除了转运体间形成寡聚体外,这些跨膜蛋白也可能与其他蛋白,如细胞骨架蛋白发生蛋白-蛋白相互作用,调控它们在细胞内的动态平衡。许多膜蛋白含有PDZ (Postsynaptic density 95/disclarge/zona occludens) 结合基序,用于与支架蛋白发生相互作用。PDZ基序通常由3~8个氨基酸残基组成,位于膜蛋白的胞内区域或羧基末端。支架蛋白可调节膜蛋白的亚细胞靶向、蛋白质稳定性、转运活性以及招募其他蛋白质形成复合体[68]。MRP2位于极化细胞的顶端膜,其在肝细胞中的顶端定位对于内源和外源性化合物的胆汁排泄非常重要。MRP2的羧基端含有共有序列X(S/T)Xφ (其中X可以是任何氨基酸,φ是疏水氨基酸), 是I型PDZ-containing kidney protein 1 (PDZK1) 的结合位点。将这个羧基端序列 (第1541—1545位,NSTKF) 均以丙氨酸替换后,所获得的丙氨酸五突变体丧失了与PDZK1的相互作用,且其在极化细胞顶端膜的表达显著降低[69]。早期的分析发现,OATP家族成员OATP1A2、OATP2B1、OATP3A1、OATP4A1以及OATP1C1的羧基端均含有I型的PDZ结合基序。其中OATP1A2与PDZK1、IKEPP (Intestinal and kidney-enriched PDZ protein)、NHERF1 (Na+/H+exchanger regulatory factor 1) 以及NHERF2可能都有相互作用[70]。2018年的一项研究将OATP2B1的羧基端PDZ结合基序删除后,也同样观察到OATP2B1和PDZK1相互作用减弱、转运蛋白功能降低的现象[71]。SLC22家族的成员 OAT4也与PDZ蛋白有相互作用。将其羧基端最后的3个氨基酸残基删除、或将其羧基末端-2位置的Thr548或最后位置上Leu550以丙氨酸替换后,这些突变体都失去了与PDZK1和NHERF1相互作用的能力,并对底物的转运产生了影响[72]。OCTN1和OCTN4的末端4个氨基酸残基删除后,也丧失了与PDZK蛋白相互作用的能力[73]。PepT2与PDZK1的互作增加了转运体在细胞表面的表达以及对Gly-Sar的转运功能。该转运体氨基末端的4个氨基酸残基同样与PDZK1的相互作用有关,将其删除后,PepT2几乎完全丧失了与PDZK1的互作能力[46]。此外,这些氨基酸残基也与PepT2和NHERF2的互作相关[74]。
3 蛋白稳定性和翻译后处置相关的关键基序
3.1 氨基端序列
蛋白质的氨基端往往是辅助蛋白进行正确靶定、维持蛋白正确折叠和稳定性的重要区域。研究发现,缺乏氨基端67个氨基酸的截短MRP1 (第67—1531位) 无法转运LTC4,表明含有胞外氨基端和第1个跨膜螺旋的区域可能对MRP1的功能是关键的。对该区域内的半胱氨酸残基作进一步的研究表明,以丝氨酸取代Cys43 (TM1) 和Cys265 (CL3) 的突变体对亚砷酸盐的抗性分别降低了71%和增加了3倍。此外,C43S对长春新碱的抗性也降低了[75]。对OATP1B3的研究发现,其氨基端 (特别是位于第12—28位的氨基酸残基)对该转运蛋白的膜靶向是必不可少的,缺失了该序列的蛋白分散地分布于胞浆中,无法有效靶定到细胞膜上[76]。
3.2 带酪氨酸的基序
NPXY (其中X可以是任何氨基酸) 是参与基底外侧膜蛋白分选最常见类型的信号之一。 它通常位于分选蛋白质的“胞浆面结构域”中。除了作为基底外侧分选信号外,NPXY还可能在调节蛋白质的内吞过程中发挥作用[77]。虽然大部分NPXY分选信号位于蛋白质的羧基端,OATP1B1序列中的胞内环3中却发现了1个高度保守的NPXY基序。其中的N335/P336共同作用于该转运体的翻译后处置,用丙氨酸共同取代这2个氨基酸残基会导致突变体滞留在高尔基体中,无法进行有效的糖基替换进而靶定到细胞表面;而Y338则可能与蛋白稳定性有关,Y338A突变体降解速率加快,而低温则可以部分恢复蛋白的表达水平和转运功能[78]。OATP1B1序列中还含有1个非典型的YXXφ (φ为疏水性氨基酸残基),位于其氨基端,该序列与OATP1B1的蛋白表达以及转运功能相关。动力学研究发现,缺失了该序列 (YCNGL) 转运体的Km和vmax值都发生了显著的改变[79]。
3.3 双亮氨酸基序
蛋白中的双亮氨酸基序常常以[DE]XXXL[LI]和DXXLL的形式出现,但已有多项研究表明非典型双亮氨酸基序的存在。该基序与蛋白质的内体分选或内质网输出相关,决定着许多跨膜蛋白的亚细胞定位[80]。例如,MRP1的羧基端含有1个高度保守的双亮氨酸基序,虽然丙氨酸替换不改变转运蛋白的运输,但会显著影响蛋白功能,而且如果同时突变双亮氨酸基序和删除MSD0,突变体会滞留在内质网中[81]。OAT1的TM12中含有1个双亮氨酸基序 (Leu503Leu504),其对该转运体的功能是关键的,L503A/L504A双突变体被滞留内质网中,丧失了转运能力[82]。该转运蛋白的氨基端也含有1个关键的双亮氨酸基序 (Leu6Leu7),将这2个亮氨酸残基同时突变为丙氨酸会造成转运体在细胞表面的表达水平显著降低,从而失去转运能力。该突变体滞留在内质网中,并通过蛋白酶体降解,说明该氨基端双亮氨酸序列与OAT1的内质网输出与蛋白稳定性相关[83]。
4 跨膜区域
跨膜螺旋是膜转运体的重要结构特征。在膜脂质双层中,水基本上被排除在外,多肽通常会采用α-螺旋结构,使其内部氢键最大化。跨膜螺旋一般含有18~21个非极性疏水的氨基酸残基,其形成的α-螺旋长度足以跨越通常的脂双层宽度,跨膜蛋白具有一个到多个的这种跨膜区域,对于辅助物质转运的各种药物转运体来说,这些跨膜区域对底物识别、结合和转运往往起着重要作用。SNP的研究发现,位于跨膜螺旋内的突变体通常会导致转运体功能的变化[18]。关于跨膜区域对药物转运体功能的影响,在之前的综述论文[13]中已有详细总结,在此不作赘述。
5 转运体调控和关键结构研究的临床意义
翻译后的处置会影响转运体的蛋白稳定性、正确位点的靶定,直接或间接地影响这类蛋白对药物底物的转运,进而影响药物的生物利用度,可能造成不良反应,影响药效。但在一些病理和药理情况下,翻译后修饰相关机制往往会受到影响。例如,酪氨酸激酶 (Tyrosine kinases) 参与了恶性肿瘤细胞增殖、凋亡、血管生成和转移等关键信号事件/通路的调节,许多类型的癌症被发现与酪氨酸激酶失调有关,因此近年来,越来越多的TKI被开发用于抑制特定类型的癌症。如索拉非尼可显著延长晚期肝癌患者的生命,是治疗肝癌的一线药物,它通过靶向血管内皮细胞生长因子受体 (Vascular endothelial growth factor receptor, VEGFR) 1~3和血小板衍生因子受体β (Platelet-derived growth factor receptor,PDGFR-β) 等受体酪氨酸激酶以阻断VEGF和PDGF依赖性血管生成[84]。舒尼替尼靶向VEGFR1~3、PDGFR-α、PDGFR-β、EGFR等酪氨酸激酶,可抑制多种恶性肿瘤的增殖和血管生成[85]。丝裂原活化蛋白激酶 (Mitogen-activated protein kinase, MAPK) 途径 (也称RAS/RAF/MEK/ERK途径) 是癌症生物学中最明确的信号转导途径之一,有40%以上的人类癌症病例与其过度激活有关。该通路激活增殖基因、促进细胞过度生长,同时通过抑制腺苷活化蛋白激酶 (5'AMP-activated protein kinase, AMPK) 信号使细胞克服代谢应激。有多个抗肿瘤药物靶定MAPK途径不同成员,例如抑制BRAF的维莫非尼、康奈非尼,抑制ERK的比美替尼、司美替尼、曲美替尼等[86]。由于激酶抑制剂在治疗中应用的广泛性,因此可能通过不同的途径直接或间接影响转运体的功能。
此外,功能性的SNP在药物转运体中也很常见,这些遗传多态性的存在,会使带有突变体的种群对药物有不同的转运能力,也可能产生不同的药物-药物相互作用。鉴于其重要的临床意义,美国食品和药物管理局 (FDA) 在2013年发布了临床药物基因组学指南《Guidance for industry clinical pharmacogenomics: Premarket evaluation in earlyphase clinical studies and recommendations for labeling》,以辅助更高效安全的药物研发[87]。许多与药物转运相关的转运体都具有非同义的SNP,对于外排转运体BCRP,研究得最广泛的是一个非同义的SNP rs22331142 (c.421C>A ),对应于第141位的谷氨酰胺突变为赖氨酸。该多态性在亚洲人中占比约10%,相应蛋白表达水平比野生型下降30%~40%,从而造成转运功能的下降。c.421C>A突变体的泛素化水平增加,使其更容易被蛋白酶体降解且其靶向质膜的能力也受到抑制。带有该突变体的病人在多种药物如他汀类药物、抗肿瘤药物的处置中表现出中度到高度的突变-药物关联性[88]。摄取型转运体OATP1B1的编码基因SLCO1B1也是一个高度变异基因,不同人种中的突变等位基因发生频率较高。其中,rs4149056 (c.521T>C) 突变是目前最具有临床意义的基因多态性,在欧洲人中占比约8%~20%,在东亚人中占比可达到10%~15%。该突变体在质膜上的蛋白表达水平下降,从而导致其功能减弱。带有该突变的患者如服食他汀类药物,会大大增加该药物的系统暴露量,导致这类患者发生肌病,甚至横纹肌溶解症[89]。临床药物遗传学实施联盟 (CPIC) 据此在2014年的指南更新中建议根据SLCO1B1基因型调整相关他汀类药物的用药剂量[90]。如能明确影响转运体功能发挥的关键位点及其作用机制,系统地阐明其结构-功能关系,将可以有效地预测功能性SNP的存在,对不同个体更有针对性地用药。
6 总结与展望
药物转运体是多种临床药物吸收、分布和排泄的关键决定因素,它们在药物的吸收和排泄过程中所发挥的重要作用毋容置疑,但我们对它们的调控机制以及相关的结构-功能关系的了解仍然非常有限。翻译后修饰对蛋白功能快速而直接的调控作用使其成为重要的药物设计靶标,SNP造成的药物代谢和药效的改变也日益引起重视。传统的药物-药物相互作用主要关注直接在转运体上发生的相互作用-一个药物是否会竞争性或非竞争性地抑制或促进另一个药物的转运,但对转运体的翻译后处置过程特别是翻译后修饰过程的研究表明,新生成的膜蛋白需要经历一个复杂的过程才能到达细胞表面其发挥作用的位点,转运药物进出细胞期间的任何一个步骤受到干扰,都有可能改变这些跨膜蛋白的功能,对其底物药物的效应或代谢产生与预期不同的影响,从而可能使患者产生不良反应。而一些重要的临床药物,如主要用于治疗肿瘤的TKI对蛋白的翻译后修饰会有影响,且其多为长期口服的药物,往往需要每天服用,因而增加了其吸收方式和吸收效率的不可预测性,易造成药代动力学的个体差异以及多重用药所导致的药物-药物相互作用[91]。2019年的一项研究表明,接受TKI治疗的患者中有97.1%同时服用至少1种其他药物,中位数为同时服用4种药物,而47.4%的患者经历了至少1种可能由TKI介导的药物-药物相互作用[92],说明激酶抑制剂通过改变蛋白翻译后修饰,直接或间接影响转运体的功能是临床上一个高概率发生的事件。明确各类转运体的调控机制,可以更好地预测药物-药物相互作用,提高药效和防止不良反应的发生。此外,对患者间药物反应差异的因素进行有效地预测是药物开发的重要步骤和目标,如能阐明不同药物转运体序列中与转运功能调控相关的关键位点及明确其所涉及的分子与细胞学机制,可更有效地预测突变等位基因对药效和药物-药物相互作用的影响,从而进一步建立相应的预防措施,更好地为个性化用药提供信息。对药物转运体的翻译后处置过程及结构-功能关系的研究仍处于起步阶段,对其深入系统的研究将有助于更有效地预测药物-药物相互作用以及优化药物的转运、更有针对性和前瞻性地了解转运体遗传多态性对不同个体的影响、为药物设计提供更合理的方案,提高药物使用的安全性和效率。

