高中化学情境教学的实践
——以“化学反应原理”为例
岳沭宁
(江苏省沭阳高级中学 223600)
1 情境教学在化学反应速率教学中的实践
情境一:实验情境.
课堂上使用少量催化剂为学习者展示H2O2在水溶液中发生分解反应的实验.实验依据的原理为
而后要求其依据表1H2O2溶液分解时c(H2O2)的变化,画出H2O2分解的浓度-时间曲线,并以10 min为间隔,探讨平均每分钟H2O2的物质的量的变化值.

表1
学习者通过计算可以看出在不同的时间短内H2O2物质的量的变化是不同的,而后要求其思考,哪一时间短速率较快,哪一时间短速率较慢,该用什么参数进行表示呢?
在此基础上讲解化学反应速率的概念,并结合aA+bB=cC+dD这一反应,分别展示使用A、B、C、D四种物质表示化学反应速率的表达式,帮助学习者建立清晰的计算模型.
情境二:实验以及多媒体情境.
实验情境1:课堂上准备两个锥形瓶(标记为甲、乙)、两个气球、碳酸氢钠粉末等.向甲、乙两个锥形瓶分别加入60mL 2mol/L、60mL 0.2mol/L的盐酸,而后向两个气球中均加入10g碳酸氢钠粉末.将两个气球均套在锥形瓶上使碳酸氢钠粉末落入锥形瓶和盐酸发生反应.要求学生观察实验现象、分析实验原理、总结从实验中获得的启发,使其能够初步认识浓度越大化学反应速率越快.同时,预留空白时间要求其自学课本中的“碰撞理论”内容,使其能够运用“碰撞理论”解释实验结论.
多媒体情境:使用多媒体技术为学习者动态展示相关课件:在两个容器中发生相同的化学反应,其中逐渐缩小其中一个容器的体积,使其内部的压强增大,使学习者能够直观地看到反应中物质分子的变化情况,启发其联系所学的浓度对化学反应速率的影响,分析压强给化学反应带来影响的本质.
实验情境2:将2mL 0.01mol/L的酸性高锰酸钾溶液分别加入到三甲、乙、丙个试管中,而后再分别加入2mol 0.1mol/L H2C2O4溶液,甲试管放在冰水中,乙试管放在80℃的热水中,试管处在常温下,均发生化学反应

K2SO4+2MnSO4+10CO2↑+8H2O
要求学生观察实验现象,讨论出现不同实验现象的原因,总结结论.
实验情境3:向A、B、C3支试管中均加入等体积5%的H2O2溶液,而后均加入2~3滴洗涤剂,向A试管中加入2~3滴FeCl3溶液,向B试管中加入少量MnO2粉末,C试管什么都不加入,要求学习者观察实验现象.同时,要求其自学课本中反应速率理论,分析催化剂给化学反应速率的影响.
在完成上述内容讲解后,要求学习阅读课本中“其他因素对化学反应速率的影响”部分,更加全面的认识到化学反应速率的影响因素.
2 情境教学在化学反应方向与限度中的实践
该部分内容理论知识较多,学习的关键在于深入理解.在进行该部分内容教学中,采用以下情境:
情境一:自学情境.教学中预留25分钟左右的时间要求学习者认真阅读课本,牢记课本中的相关概念.
情境二:问题情境.设计如下问题,要求其思考、回答:
(1)下列有关化学反应的说法错误的是( ).
A.综合分析焓变及墒变可确定反应能否自发进行
B.改变条件可使非自发反应变为自发反应
C.若某过程自发性已知,则可确定该过程是否一定会发生


A.单位时间内消耗1 mol H2O的同时生成1 mol H2
C.反应容器内气体密度不再发生变化
D.混合气体相对分子质量不再发生变化
设计的三个问题均较为基础,课堂上通过提问学生代表了解做题的正确率.针对错误的习题,要求学习者认真分析原因,及时回归课本,真正的将相关概念搞清楚,弄明白.同时,针对学习者存在的共性问题,在课堂上集中进行讲解,更好地澄清学生认识.
3 情境教学在化学平衡移动教学中的实践
化学平衡移动是该部分的重点与难点.为更好地加深学生印象,理解与掌握化学平衡移动相关理论,实践中创设以下教学情境:
情境一:实验情境.
实验情境1:课堂上展示如下实验原理:


实验情境2:课堂上告知学习者实验依据的原理为:

[CoCl4]2-(aq)+6H2O(l),ΔH>0
其中[Co(H2O)6]2+为粉红色,[CoCl4]2-为蓝色.向一支试管中加入少量氯化钴晶体(CoCl2·6H2O),再逐滴加入浓盐酸至晶体完全溶解,而后加水至溶液呈紫色为止.将其分装到甲、乙、丙三支试管中,分别放入热水、冰水以及室温下.要求学习者结合反应吸放热、反应温度的高低讨论化学平衡移动的方向.
情境二:互动情境.设计的互动问题如下:
(1)请你任意选取一个可逆反应,使用勒夏特列原理解释改变物质浓度、反应压强、温度时平衡向哪个方向移动.
(2)某可逆反应正反应的ΔH<0,升高温度平衡向哪个方向移动,在实际生产中为什么还要提高反应温度呢?
(3)对于反应前后气体分子数不变的可逆反应,增大压强或加入催化剂平衡是否移动,为什么?增大压强、加入催化剂反应速率是否发生改变,怎样改变?

课堂上围绕上述问题与学习者互动,加深其了对勒夏特列原理的认识,帮助其清楚地认识化学反应速率与化学平衡移动之间的关系,使其认识到在实际化工生产中需要综合考虑化学反应速率、化学平衡移动方向以及生产成本等因素,以选择合理的反应条件.
情境三:问题情境.实践中创设以下问题情境:

A.改变条件平衡正向移动,D的百分含量一定增大
B.升高温度,A的浓度增大,说明正反应为吸热反应
C.增大压强,平衡不移动,说明m+n一定等于p+q
D.增加B的量平衡后体系颜色加深,表明B必为气体
(2)在恒容密闭容器中发生如下反应,T1,T2下X物质的量浓度c(X)与反应时间t变化的曲线如图1所示,则( ).
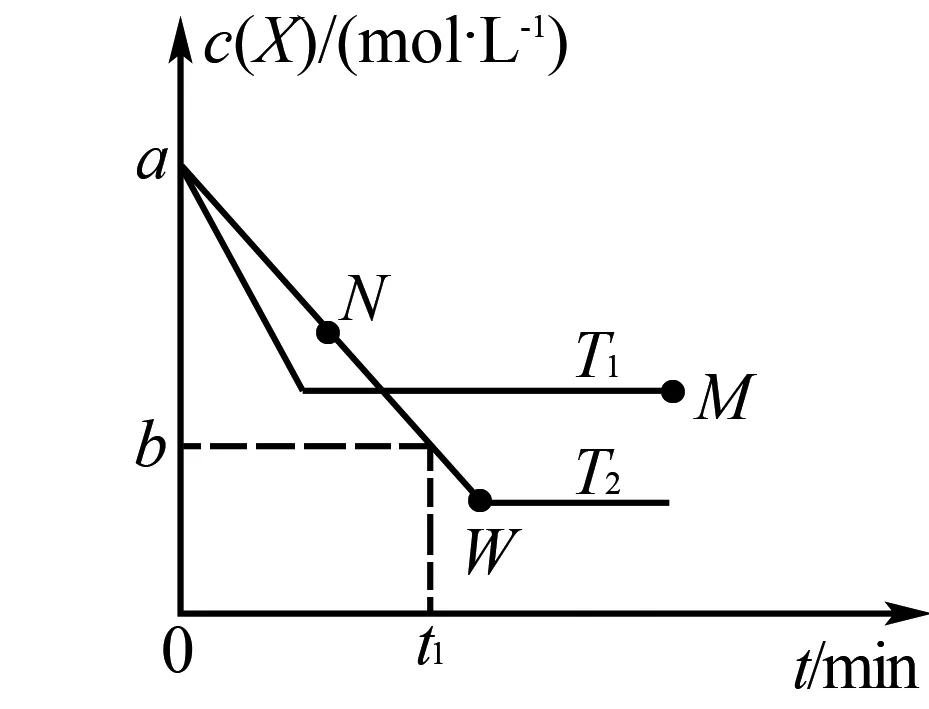
图1
A.由图可知T2>T1
B.M点正反应速率较N点逆反应速率大
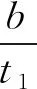
D.M点再加入一定量X,平衡后X的转化率减小

A.平衡时A的总转化率为40%
B.达到平衡时K1=0.5
C.达到平衡时c(B)=2c(D)
D.达到平衡时K2=1.2
三个问题由易到难,逐步深入,巩固学习者所学的同时能很好地锻炼学习者的学以致用能力.
“化学反应与化学平衡”教学中结合教学内容难易程度,灵活创设实验情境、多媒体情境、自学情境、互动情境、问题情境,很好地激发了学生的学习热情,营造了一种积极活泼的课堂氛围,使学生能够当堂理解与掌握所学,确保教学目标的顺利完成.

