注射液中不溶性微粒的统计学分析
*魏静 秦天琦 吴愫青
(珠海市食品药品检验所 广东 519090)
注射剂不溶性微粒是指除气泡外,随机存在于液体制剂包括灭菌粉针剂所制成的液体中的可流动的不溶性外来物质,其粒径在50μm以下,肉眼看不见,具流动不溶性,在肌体内不能代谢[1]。不溶性微粒的种类主要包括无机微粒:如金属颗粒、玻璃碎屑、矿物尘粒等;有机微粒:如植物纤维、人的皮屑、塑料等;生物微粒:如细菌、霉菌、芽孢等。产生它的途径,一是来源于外源污染如金属屑、橡胶屑、纤维、粉尘、晶体、碳化物等;二是来源于内源因素,如注射剂生产、储存、运输过程及临床配药操作污染等途径引入的污染[2],以及药物配伍时理化性质的变化而产生的[3]。其粒径超过一定大小,或数量超过一定限度,就会在人体内蓄积,会对人体产生一些危害,可引起肺水肿、静脉炎、热原样反应、血栓、组织坏死等,严重时甚至还可引起过敏反应危及生命,因此有必要对注射剂的不溶性微粒进行检查并严格控制其数量[4]。
很多国家药典中均制定了不溶性微粒检查的限度,《中国药典》2020年版四部通则0903不溶性微粒检查法光阻法[5]的限度规定为:(1)每1ml中含10μm及10μm以上的微粒数不得过25粒,含25μm及25μm以上的微粒数不得过3粒(标示装量为100ml或100ml以上的静脉用注射液);(2)每个供试品容器中含10μm及10μm以上的微粒数不得过6000粒,含25μm及25μm以上的微粒数不得过600粒(标示装量为100ml以下的静脉用注射液、静脉注射用无菌粉末、注射用浓溶液)。控制微粒数量不超过规定范围是注射剂质量的重要指标之一,这对于增强其临床使用的安全性起到了积极作用。本实验中我们对总计172个批次的注射剂进行了不溶性微粒的测定,这些注射剂为近两年我所的抽检样品,样品来源基本涵盖国内目前注射剂的生产厂家,选取的类型也包括了小容量注射剂、大容量注射剂和粉针剂,实验结果基本能反映出目前国内注射剂不溶性微粒数量的情况,也从一个侧面反映出目前国内注射剂生产的质量控制情况,我们对实验结果进行统计学分析,希望在此基础上能够发现不同容量和剂型注射剂不溶性微粒的统计学意义,为注射剂制备过程中可能引入的微粒污染、临床使用中最大限度减少微粒污染提供理论参考。
1.仪器与试药
APSS 2000不溶性微粒检测仪(美国PMS公司),仪器试验操作环境应不得引入外来微粒,测定前的操作应在洁净工作台进行。
不溶性微粒检查用水:将蒸馏水用孔径为0.45μm的微孔滤膜过滤即得。经检测符合《中国药典》不溶性微粒检查用水的要求:每10ml含10μm及10μm以上的不溶性微粒数应在10粒以下,含25μm及25μm以上的不溶性微粒数应在2粒以下。
注射剂:总计172个批次。其中静脉用注射液101批次(小容量注射液76批次,总计23个品种,标示装量从1ml至20ml;大容量注射液25批次,总计5个品种,标示装量从100ml至500ml);静脉注射用无菌粉末71批次,规格10mg至2.5g,总计26个品种。
2.实验方法
静脉用注射液:根据注射液的标示装量不同,取每个批次的供试品不少于4支,小心翻转20次,充分混匀待测溶液,小心开启容器,合并至少4个供试品的内容物(使总体积不小于25ml),置于烧杯中,静置10min使其脱气泡,置于取样器上进行测定。依法测定4次,舍弃第1个数据,测定结果以后3次测定数据的平均值为准。根据每个供试品的总体积和每个容器的标示装量,计算每个容器所含微粒数。
静脉注射用无菌粉末:取每个批次的供试品至少4支,根据不同品种要求的浓度,每瓶分别精密加入适量微粒检查用水,缓缓振摇使内容物溶解,合并容器中的溶液(使总体积不小于25ml),置于烧杯中,静置10min使其脱气泡,置于取样器上进行测定。依法测定4次,第1个数据不计,取后3次测定数据的平均值作为测定结果。根据每个供试品的总体积,计算每个容器所含微粒数。
APSS 2000型不溶性微粒检测仪达到目前所有的USP、E、JP和CHP标准,仪器有多个检测通道可供选择,本文根据药典规定选取≥2μm粒径,≥10μm粒径,≥25μm粒径3个通道,同时采集这3个粒径通道的数据,并对实验结果进行汇总分析。
3.实验结果
(1)不溶性微粒数据的统计学特征
通过分析静脉用注射液,注射用无菌粉末的不溶性微粒数据,结果发现:≥2μm,≥10μm,≥25μm三种粒径的微粒数据按每瓶的微粒总数计,均符合指数分布,通过考察样本数量和样本中不溶性微粒数量的统计学关系,发现两者呈负指数相关,即样本数量越大,不溶性微粒的数量越少。以≥10μm粒径的微粒数据为例,统计微粒数量与样本数量的关系,结果如下图所示。

表1 ≥10μm微粒数与样本数数据汇总
从图1可以看出,虽然不同剂型的注射剂≥10μm不溶性微粒的数量分布跨度较大,但大多数样本均分布在较低微粒数量范围内,且远低于药典规定的限度。说明在不超出药典规定的限度基础上,各厂家均能将不同注射剂不同粒径的微粒数量进行合理控制,尽可能降低不溶性微粒对使用者的影响。
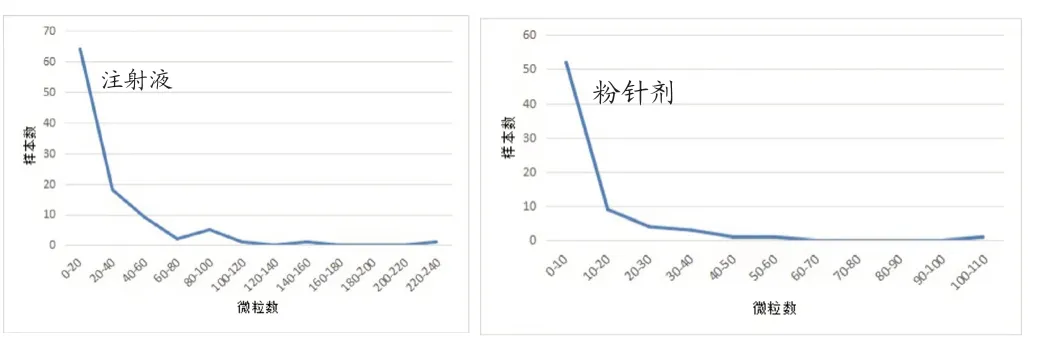
图1 注射剂≥10μm微粒数与样本数关系图
(2)不同类型注射剂的微粒分布的差异
考察小容量注射液(<100ml),大容量注射液(≥100ml),注射用粉针剂,不同粒径的微粒数量分布,结果如表2所示。

表2 不同剂型注射剂微粒数量分布
从表2可知,考察药典规定的≥10μm粒径、≥25μm粒径两种微粒,以每瓶中微粒总数作为检查结果,小容量注射液、大容量注射液和粉针剂的结果均符合药典规定的限度要求,但厂家和批次之间的结果有一定的差别。例如对于≥10μm的微粒来说,含量最少的样品每瓶微粒数为0粒,含量最多的样品每瓶微粒数为234粒,而对于不计入药典规定限度范围内的≥2μm的微粒数,这一跨度更为夸张,每瓶微粒数从1粒到10000粒不等,虽然存在偶然误差的影响,但仍说明不同批次样品的微粒含量有着巨大差别。这也提示药厂应以最高的标准要求自己,进一步优化生产工艺,从源头上降低不溶性微粒的潜在隐患,提高制剂质量。
从表中我们可以看出,在每瓶微粒数量上,小容量注射液>注射用粉针剂>大容量注射液,为了进一步验证这一结论,我们对不同容量的注射剂微粒数量进行细化分析。
(3)不同容量注射剂微粒数均值的差异
观察不同剂型注射剂微粒数量分布数据,每瓶微粒数量对比,小容量注射液>注射用粉针剂>大容量注射液。为了进一步验证这一结论,我们对不同容量的注射剂微粒数量进行细化分析,结果如表3。
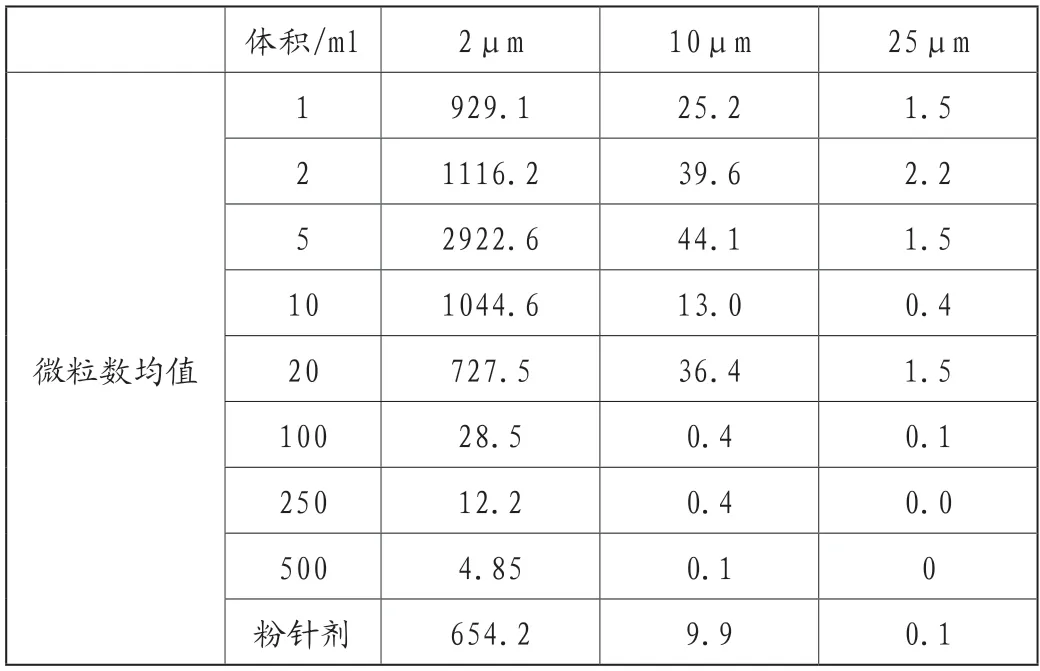
表3 不同容量注射剂微粒数均值
从微粒数均值的数据可以看出,对于药典规定的≥10μm、≥25μm两种粒径的微粒,用于分析的172批次注射剂每瓶中的微粒总数均符合《中国药典》规定的限度要求,相对于小容量注射液,大容量注射液对人体健康影响更大,标准更严格,微粒数更少,制剂安全性更高。注射用无菌粉末的微粒数介于大容量与小容量注射液之间。
我们再以2μm的数据为例,对小容量注射液的不溶性微粒数的数据进行统计学分析,得出以下结果如表4。
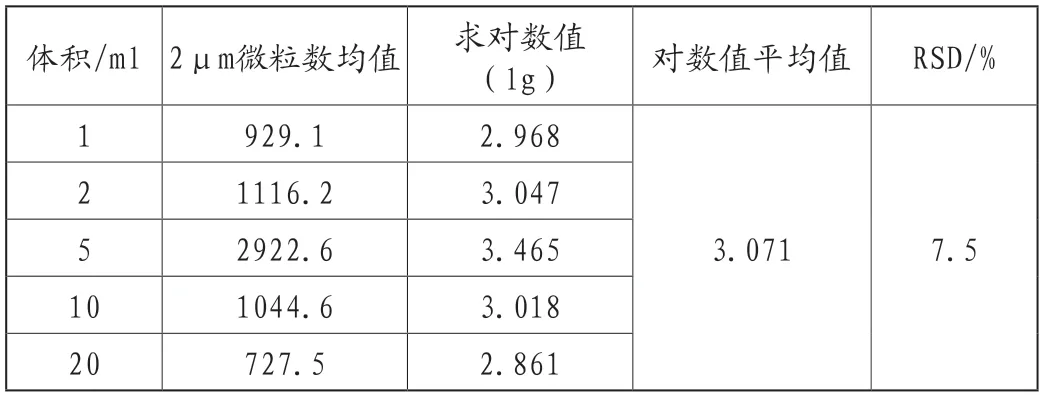
表4 小容量注射液微粒数分析
从数据可以看出,小容量注射液的微粒数的对数值和注射剂自身的体积之间不存在显著性差异,这和小容量注射液的生产工艺多数是配料、配液、安瓿清洗、安瓿灌封、灭菌等一系列相似的工艺流程有一定的关系。
我们再对以上大容量注射液和粉针剂的2μm数据继续分析,得到表5的结果。

表5 大容量注射液和粉针剂微粒数分析
数据表明,大容量注射液的体积和不溶性微粒的对数值呈负相关。我们将表5粉针剂的不溶性微粒的对数值和表4小容量注射液微粒数的对数值进行统计学分析,两者的相对平均偏差为4.3%,不存在显著性差异,这和注射用无菌粉末在测定前需要用微粒检查用水进行复溶再测定有一定的关系,其测定结果除了与制剂本身的质量有关以外,还和检验者的操作手法、制剂本身的溶解性有一定的关系,如水溶性较差的粉针剂用不溶性微粒检查用水溶解后检查时,因为溶解不完全的原因,微粒检查结果都存在比其他粉针剂结果偏高的现象,这就提示我们,从不溶性微粒的角度来看,对于相同同成分的产品,临床使用时,注射液与粉针剂应优选注射液,这样既可以减少不溶性微粒产生的风险,提高患者用药的安全性,也减少了护士的配液工作量。另外,溶解时的振摇过程,也会将胶塞和瓶壁上的微粒更多的引入溶液中,在一定程度上也会造成结果偏大。
4.讨论
通过对172批次注射剂不溶性微粒测定结果的统计学分析,我们发现了不同粒径微粒的统计学分布特征,以及不同类型和不同容量的注射剂微粒数量分布的差异,并对影响注射剂不溶性微粒数量的因素进行了简要的分析,不溶性微粒可能来源于产品本身,如高微粒负载的原材料、包装材料等,也可能来源于一些易产生微粒的生产工艺,如注射用水、喷涂、切割等,还有可能来源于环境,如空气中的悬浮粒子、手套的粉尘、员工的皮屑、衣物纤维等。通过数据分析,我们对国内注射剂不溶性微粒污染情况有了一个整体了解。
静脉输液和静脉注射疗法是现代临床治疗中的重要手段和方法,通过这种治疗方法,注射剂中的不溶性微粒一旦进入人体,可终身存在体内,对人体造成危害,如异物微粒可侵入组织形成肉芽肿、可引起局部组织血栓或坏死等,这就直接关系到患者的用药安全。同时,不溶性微粒的检查结果也间接地反映出不同企业按照GMP要求生产的差距,对于药品监管部门的监管和企业落实质量管理主体责任有着一定的参考依据。药品生产质量管理规范(药品GMP)自诞生以来在保证药品质量方面发挥了巨大的作用,1999年8月1日起实施的《药品生产质量管理规范》(1998年修订)是其一个里程碑,我国所有药物制剂和原料药在2004年7月1日实现按照药品GMP生产,并且药品GMP(2010年修订)中包括了无菌药品的附录,这个附录对注射剂的质量管理也提出了具体要求,药品GMP的发展历程对药品企业做好药品全生命周期的监管提出了新的挑战,我们的研究就是建立在此基础上。希望我们的研究对于药厂优化生产处方和生产工艺,合理选择药包材,提高制剂质量及临床应用的安全性具有一定的借鉴作用。

