张掖市某牛场1例牛源格氏乳球菌的分离鉴定及毒力基因检测
史金莲,达举云,宋 倩,李怡娜,丁渲攀,赵兴绪*,张 勇*
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.甘肃省动物生殖生理及繁殖调控重点实验室,甘肃 兰州 730070)
格氏乳球菌属于厚壁菌门、芽孢杆菌纲、乳杆菌目、链球菌科之一,2001 年版《伯杰氏系统细菌学手册》将乳球菌从链球菌属中分出,单列为链球菌科的第2 个属即乳球菌属(Lactococcus),包括格氏乳球菌(Lactococcus garvieae)、乳酸乳球菌(Lactococcus lactis)等种或亚种。有研究认为格氏乳球菌是正常菌或益生菌,因为一些手工乳制品的主要微生物种群包括该菌[1],也有报道显示格氏乳球菌和鱼乳球菌(Lactococcus piscium)可引起鱼类感染发病,是全球鱼类养殖中的一种新型病原体,其中易感宿主为虹鳟鱼[2]。人类感染主要引起尿路感染、心内膜炎、腹膜炎和脑膜炎等疾病[3]。虽然尚不明确该菌在动物与人类之间的相互关系,但据目前的报道认为其对人类致病性较低,偶发食用生鱼片造成人的胃肠道感染[4-5]。迄今国内外鲜有对牛源格氏乳球菌的报道,但最早认为该菌是导致牛乳腺炎的病因[6]。本研究从患乳腺炎奶牛的乳汁中分离到一株格氏乳球菌,并对其生物学特性、药物敏感性、毒力基因、小鼠的致病性等做了检测,为进一步了解该菌及其所致相关疾病的研究奠定了基础。
1 材料与方法
1.1 主要实验材料12 份乳腺炎患牛乳汁样品于2021 年4 月采自甘肃省张掖市某牛场。营养肉汤培养基、MHB 培养基、琼脂粉、无菌脱纤维绵羊血、DNA 提取试剂盒和TaqDNA 聚合酶等均购自青岛海博生物技术有限公司;微量生化发酵管和药敏纸片购自杭州滨河微生物技术有限公司;18 g~22 g 昆明系小鼠购自兰州大学实验动物中心。
1.2 病原菌分离及革兰氏染色检查将无菌采集的乳汁样品接种于50 mL/L 的鲜血琼脂培养基上,37 ℃培养18 h~24 h,观察细菌的生长情况,挑选典型的单菌落进行纯培养,并经革兰氏染色镜检。
1.3 分离菌的生化试验将分离菌株接种于6.5%氯化钠肉汤、七叶苷、海藻糖、棉子糖、蔗糖、阿拉伯糖、木糖、水杨苷、乳糖、甘露醇等微量生化反应管中,37 ℃培养24 h~48 h,观察颜色变化并记录试验结果,参考《伯杰氏细菌鉴定手册》判定结果。
1.4 分离菌16S rRNA 的PCR 扩增及序列同源性分析利用细菌基因组DNA 提取试剂盒提取分离菌株的DNA 作为模板,采用细菌16S rRNA 通用引物[7]经PCR 扩增。PCR 扩增条件:94 ℃5 min;94 ℃30 s、58 ℃30 s、72 ℃90 s, 共34 个循环;72 ℃7 min,PCR 产物经琼脂糖凝胶电泳检测后由兰州天启生物技术有限公司测序,将测序结果在NCBI 上经BLAST比对分析,并利用MEGA 软件构建该基因的系统进化树,分析其遗传演化关系。
1.5 分离菌的小鼠感染试验将12 只小鼠随机分为实验组与对照组,每组6只。将分离菌以腹腔注射方式接种6只小鼠,每只小鼠0.2 mL(1.5×108cfu/mL),对照组小鼠注射同体积的营养肉汤,各组小鼠分笼饲养,在7 d 的观察期内观察小鼠的临床症状及死亡情况,7 d或死亡后剖检观察小鼠大体病变并再次分离细菌,取死亡小鼠的病变组织在4%的甲醛溶液中固定24 h,石蜡包埋后制备切片,HE 染色后在显微镜下观察。
1.6 分离菌的药敏试验利用Kirby-Bauer(K-B)纸片扩散法检测分离菌株对9 类15 种药物的敏感性,参照美国临床实验室标准委员会(NCCLS)推荐标准判断结果。
1.7 分离菌株的毒力基因检测参照文献[8-11]合成11 种毒力基因:Adhesin Pav、Adhesin PsaA、Enolase、LPxTG-2、LPxTG-3、Adhesin cluster 1、Adhesin cluster 2、Adhesin、Capsule gene cluster、folp、gapc的扩增引物,以分离菌基因组DNA 为模板,采用PCR方法扩增上述毒力基因。
2 结 果
2.1 分离菌株的培养特性及形态接种12 份病牛乳汁样品的血琼脂平板有3 份在37 ℃培养24 h 后,长出直径约2 mm~3 mm,灰白色、半透明、光滑的圆形菌落,菌落边缘较整齐(图1A)。革兰氏染色镜检结果均为革兰氏阳性菌,无荚膜、无芽孢、球状或球杆状,散在、成对或者成短链排列,两端钝圆,部分两端稍尖(图1B)。结果表明3 份病牛乳汁样品中分离出相同的1 株革兰氏阳性球菌。
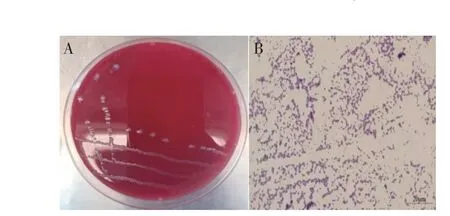
图1 分离菌在血琼脂平板的菌落形态(A)及革兰氏染色(B)结果Fig.1 Morphology of colonies on blood agar plate(A)and gram staining results(B)of the isolate
2.2 分离菌的生化鉴定结果分离菌的生化鉴定结果显示,分离菌的木糖和阿拉伯糖试验为阴性,在6.5%的氯化钠培养基上生长缓慢,蔗糖、乳糖、甘露醇、海藻糖、棉子糖、七叶苷等试验均为阳性。参考伯杰氏细菌鉴定手册显示该分离菌株与格氏乳球菌的生化特性符合,初步表明,从患病奶牛乳汁中分离到了1 株格氏乳球菌。
2.3 分离菌16S rRNA 基因的PCR 扩增及同源性分析结果以提取的分离菌基因组为模板,利用PCR扩增分离菌株的16S rRNA 基因,结果显示在约1 500 bp 处有一条目的条带,与预期大小相符(图2)。16S rRNA 基因的同源性分析结果显示,分离菌株与格氏乳球菌参考株(MT597590.1)的同源性高达100%。通过MEGA 软件构建该基因的系统进化树,结果显示,本研究分离的格氏乳球菌(MT597590.1)与格氏乳球菌(MF369865.1)聚为一支(图略),上述结果表明分离菌为格氏乳球菌,命名为LG01。

图2 分离菌16S rRNA基因的PCR扩增结果Fig.2 Amplification of 16S rRNA gene of the isolate by PCR
2.4 分离菌的小鼠致病性试验结果将分 菌LG01 株经腹腔注射感染小鼠,6 h 后小鼠出 畏寒、竖毛、精神沉郁等症状,于感染后16 h~48 h 陆续死亡。剖检死亡小鼠可见胸腔和腹腔充血、肠道肿胀等,肺脏、脾脏、肾脏以及肝脏均严重出血及淤血,无菌采集发病小鼠的肝脏、脾脏、肾脏等做细菌的分离鉴定,结果得到了与LG01 菌株形态、生化特性均一致的细菌。对照组小鼠的精神状态良好,剖检后组织器官无异常。
对感染致死小鼠以及对照组小鼠的各组织制备病理切片,并在显微镜下观察可见各组织均呈不同程度的病变,肝脏中央静脉充血、出血(黑色箭头);脾脏红细胞增多,淋巴细胞稀疏,动脉周围淋巴鞘增厚(红色箭头);肺脏充血出血、炎性细胞增多(黄色箭头);肾脏毛细血管充血、肿胀,远曲小管与近曲小管上皮增厚(蓝色箭头);对照组小鼠各组织均无明显病变(图3)。分离的格氏乳球菌对感染小鼠各组织均能造成较严重的剖检和病理学变化,表明该菌对小鼠的致病性较强。

图3 各组小鼠各组织的病理学变化Fig.3 Histopathological changes of mice in control and infection groups
2.5 分离菌的药敏试验结果分离菌株的药敏试验结果显示,该菌对氨基糖苷类的阿米卡星、β-内酰胺类的苯唑西林、头孢类的头孢他啶、大环内酯类的克拉霉素、硝基呋喃类的呋喃妥因、多肽类的多粘菌素B、磺胺类的复方新诺明等药物耐药,对氨基糖苷类的卡那霉素中介,对四环素类的四环素、喹诺酮类的诺氟沙星和环丙沙星、β-内酰胺类的氨苄西林、头孢类的头孢西叮、氨基糖苷类的庆大霉素以及多肽类的万古霉素等药物敏感(表1)。表明该分离菌株的耐药谱较广。

表1 分离菌株的药敏试验结果Table 1 Results of drug susceptibility test of isolate
2.6 分离菌毒力相关基因的检测结果经PCR 扩增分离菌的11 种毒力基因,结果显示,分离菌株携带其中粘附素(Adhesin PsaA)、烯醇化酶(Enolase)、一种表面蛋白基因(LPxTG-3)、粘附素簇1(Adhesincluster 1)、粘附素簇2(Adhesin cluster 2)、荚膜基因簇(Capsule gene cluster)、二氢叶酸合成酶(folp)、3-磷酸甘油醛脱氢酶(gapc)等毒力相关基因(图4)。推测该分离菌株对小鼠较强的致病性可能与其携带多种毒力基因有关。

图4 分离菌各毒力基因的PCR检测结果Fig.4 PCR detection results of different virulence genes of isolate
3 讨 论
有研究结果显示,致奶牛乳腺炎的病原种类较多,主要以链球菌、大肠杆菌和金黄色葡萄球菌感染引起的乳腺炎最常见。格氏乳球菌已被确定为鱼链球菌病的病原之一,可以导致鲆、虹鳟鱼等水产动物感染发病,但自奶牛乳腺炎病例中分离到该菌后,有学者认为该菌可引起奶牛乳腺炎[12]。2015 年Abdelfatah 等从生鲜乳中分离出了致病性格氏乳球菌,发现该分离菌携hly(溶血素基因)、gyrb(DNA 促旋酶亚基B 基因)等毒力基因,且对青霉素、甲氧西林、头孢吡肟和头孢菌素耐药的菌株高达100%,而对氨苄西林和四环素的敏感性较高[13]。Devriese等从患乳腺炎的乳汁、生牛奶中分离到了格氏乳球菌[12],其对青霉素、甲氧西林和头孢噻吩有抗性,而对四环素、利福西林敏感。Carvalho 等从奶牛乳汁中分离并鉴定格氏乳球菌及分析其致病性,认为格氏乳球菌是引起奶牛乳腺炎的主要病原[14],但至今对格氏乳球菌性奶牛乳腺炎相关的研究仍较少,且其致病机理尚不清楚。
本研究从患奶牛乳腺炎的乳汁中分离到1 株格氏乳球菌,药敏试验结果显示,分离的格氏乳球菌对四环素、诺氟沙星等8 种药物敏感,因此在临床上可以选用这几种药物治疗由格氏乳球菌引起的奶牛乳腺炎;该菌对阿米卡星、苯唑西林等7 种药物耐药,这与洪保华等对养殖梭鱼格氏乳球菌的药敏试验结果部分一致[15],不同之处可能与菌株来源、养殖场的用药习惯等有关,且万古霉素、四环素等药物虽对革兰氏阳性菌的杀菌作用较强,但其不良反应较多,所以在药物使用时应结合国家用药准则,有选择性地使用敏感药物治疗,并轮换用药,以防止耐药菌株的产生。
小鼠的致病性试验结果显示,感染分离菌的小鼠在6 h 后开始出现被毛凌乱、畏寒、厌食等症状,而对照组无该症状。剖检感染小鼠发现脾脏发黑、肿大,肝脏和肺脏充血,其他脏器无明显变化。病理切片结果显示,死亡小鼠的肝脾肺肾等均有不同程度的病变,表明分离的格氏乳球菌对小鼠的致病性较强。
格氏乳球菌致病机制较为复杂,可能是由多种毒力因子共同作用所致,因此检测分离菌所携带的毒力基因对了解其潜在的致病性至关重要。毒力基因检测结果显示,在检测的11 种毒力基因中,有8种毒力基因呈阳性,且不排除还有其他毒力基因的可能,这可能与该菌株对小鼠的致病性较强有关。格氏乳球菌的毒力因子主要是其产生的多种细胞外毒素、溶血素、粘附素等,这些毒力因子的生物学特性不同,致其的致病特征也不同。Coutte 等发现fbp基因是促进细菌粘附到其他细菌或宿主细胞表面最重要的毒力基因之一[16];Miyauchi 的研究结果显示,鱼源格氏乳球菌基因组中存在NADHoxidase、Adhesin等毒力基因,导致该菌对黄尾鱼有致病性,而从乳腺炎中分离出的格氏乳球菌对鱼类无致病性[17]。本实验从分离的奶牛源格氏乳球菌中检测到了Adhesin cluster、Adhesin等毒力基因,该结果与Ture 等对格氏乳球菌检测的毒力基因结果部分一致[18]。菌株来源不同及遗传背景差异可能是造成毒力因子分布差异的原因之一,进一步研究不同感染部位、不同地域环境分离株毒力因子分布的差异及与菌株耐药性演变之间的相关性,对了解该菌的致病性和致病机制有重要意义。总之,本研究为奶牛源格氏乳球菌感染的防控及合理用药提供了参考。

