结核分枝杆菌转录调控蛋白Rv0827c(KmtR)调控靶点的初步研究
王 慧,崔莹莹,唐祎依,吕明月,党光辉,崔子寅,曹 俊,宋宁宁,刘思国*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病创新团队,黑龙江 哈尔滨 150069;2. 潍坊医学院生命科学与技术学院,山东 潍坊 261053)
结核病(Tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)引起的一种严重危害人类健康的重要传染病,根据2020 年世界卫生组织统计结果显示,2019 年全球新发TB 患者约1 000万人,其中我国新发TB 患者排名全球第二位[1],而与艾滋病的双重感染及耐药结核菌的出现也是造成人类TB 死亡的重要原因。MTB 能够在宿主体内进入休眠状态,并通过转录调控蛋白实现对活性氧(ROS)、金属离子以及药物杀灭等不利因素的适应,从而维持自身稳定和生存,因此MTB 的转录调控蛋白具有成为药物靶标的潜在可能。
Rv0827c(KmtR)属于ArsR/SmtB 家族转录因子中的一员,具有保守的DNA 识别基序,即螺旋-转角-螺旋(helix-turn-helix)结构,通常形成同源二聚体结合到自身基因启动子区域[2]。在缺乏金属离子的情况下,ArsR/SmtB 家族转录抑制因子与编码蛋白质基因的启动子结合,而这些蛋白质参与过量金属离子的流出或者螯合反应[3]。如果环境中重金属离子达到有毒浓度阈值时则能够释放操纵子,使生物体能够在有毒环境中生存。然而,目前受调控蛋白Rv0827c调控的靶基因及其影响调控作用的辅助因子尚不清楚。Rv3616c(EspA)是ESX-1 分泌系统成员之一,EspA 的缺失导致细菌细胞壁的完整性受到破坏[4],进而影响MTB 的毒力[5]。但是,EspA 的表达受到哪些转录调控蛋白的调控尚不清楚。
Rv0827c 转录调控蛋白是否能够与预测的23 种启动子结合,以及rv3616c是否为转录调控蛋白Rv0827c 新的调控靶点?金属离子等小分子是否会影响Rv0827c与rv3616c的结合?本研究对这几个问题深入研究,为了解Rv0827c的转录调控机制奠定基础。
1 材料与方法
1.1 菌株、载体、实验动物及主要试剂MTB H37Ra 株基因组和pET-22b 载体由本实验室保存;E. coliDH5α 和E. coliBL21(DE3)感受态细胞购自南京诺唯赞(Vazyme)生物科技有限公司;新西兰大白兔购自坤达养殖场;7H9 和LB 液体培养基/固体培养基均购自美国BD 公司;PrimeSTAR Premix 购自大连TaKaRa 公司;PCR 产物纯化试剂盒、胶回收试剂盒、质粒提取试剂盒均购自OMEGA 公司;亲和层析树脂购自美国GE 公司;BCA 蛋白定量检测试剂盒、Protein A/G Magnetic Beads、M-280 山羊抗兔IgG 免疫磁珠以及EMSA(Electrophoretic Mobility-Shift Assay)试剂盒购自美国Thermo Fisher Scientific 公司;i-Pure DNA 提取试剂盒购自Diagenode 公司;SA 芯片以及10×HBS-EP 缓冲液购自美国思拓凡公司;放线菌素-D 购自Alphabio 公司;弗氏不完全佐剂和甲基绿均购自Sigma-ALDRICH 公司;小鼠抗His 单克隆抗体(MAb)购自天根生化科技(北京)有限公司;山羊抗鼠IDDye 荧光素IgG 购自LI-COR 公司。
1.2 重组Rv0827c 蛋白(rRv0827c)的表达与纯化参照GenBank 中MTB H37Ra 标准株中23 种基因序列,以其上游350 bp 左右作为启动子片段,利用Primer 6.0 软件设计引物(表1),引物由吉林省库美生物科技有限公司合成。以MTB H37Ra 基因组为模板,采用特异性引物(表1)通过PCR 扩增rv0827c基因,经BamH I与NdeI双酶切后克隆至pET-22b载体,构建重组质粒pET-22b-rv0827c并经酶切与测序鉴定。重组质粒转化至E.coliBL21(DE3)感受态细胞后在37 ℃180 r/min 条件下培养至OD600nm=0.8,加入终浓度1 mmol/L IPTG 37 ℃诱导表达4 h,8 000 r/min 离心收集菌体。超声破碎后离心,收集沉淀,经0.5%SKL变性以及复性后,利用Ni-NTA 亲和树脂纯化。重组蛋白经200 mmol/L、500 mmol/L 咪唑洗脱液洗脱并浓缩除盐,经BCA 蛋白定量检测试剂盒测定蛋白浓度。以小鼠抗His MAb(1∶5 000)为一抗,山羊抗鼠IDDye 荧光素IgG(1∶10 000)为二抗,经western blot 鉴定正确后,-40 ℃保存备用。

表1 PCR引物序列Table 1 The primers sequence of PCR
1.3 rRv0827c 多克隆抗体的制备与纯化 选取2 只体重约2.0 kg 的新西兰大白兔,先取少量耳静脉血作为阴性对照,随后将纯化的rRv0827c 与弗式不完全佐剂按照1∶1 的体积比乳化,将其背部多点皮下注射免疫兔子,400 μg/只,每隔12 d 免疫1 次,免疫3 次后经颈动脉采血,分离血清并保存于-80 ℃。将获得的免疫血清结合于protein G 亲和层析柱介质,利用Elution buffer 依次洗脱,得到rRv0827c 多克隆抗体,采用ELISA 方法检测多克隆抗体的效价[6],以免疫前血清作为阴性对照,用于后续试验。
1.4 rRv0827c 与启动子DNA 体外结合的凝胶迁移(EMSA)试验 根据细菌单杂交数据的预测,rRv0827c具有广泛的调控作用,能够与多个基因的启动子结合。以MTB H37Ra 株基因组为模板,采用特异性引物(表1),通过PCR 分别扩增23 个基因的启动子,按照EMSA 方法,配制20 μL EMSA 反应体系:2 μL 30 ng/μL 启动子DNA;3 μL 10.04 μmol/L rRv0827c;4 μL 5×binding buffer,ddH2O 补足,以未加蛋白的体系作为对照,将rRv0827c 与上述23 个基因启动子37 ℃孵育30 min,后经8%非变性聚丙烯酰胺凝胶分析,验证体外条件下rRv0827c 与23 种启动子的结合情况。
1.5 rRv0827c 与启动子DNA 菌体内结合的免疫共沉淀(ChIP)试验 根据染色质ChIP 试验方法,将200 mL MTB H37Ra 株菌液培养至对数生长期(OD600nm=0.8),加入终浓度1%的甲醛交联10 min,随后加入终浓度125 mmol/L甘氨酸终止交联,3 500 r/min离心15 min 收集菌体沉淀,并用预冷的PBS 洗涤2 次,用3 mL 裂解液重悬沉淀后经超声破碎,13 000 r/min离心收集上清,转移至新的EP 管中。取上清100 μL进行反交联,通过酚氯仿法提取菌体中的基因组后,经1.5%琼脂糖凝胶电泳检测,确保基因组片段破碎后分布在100 bp~700 bp;取上述1.3 方法中制备的rRv0827c 多克隆抗体100 μL,4 ℃包被M-280 山羊抗兔IgG 免疫磁珠90 min,后取1.2 mL 超声后上清与已包被磁珠于4 ℃过夜孵育,洗涤磁珠后,利用i-Pure DNA 提取试剂盒收集磁珠上多克隆抗体富集的rRv0827c-DNA 复合物,纯化并分离出复合物中的DNA,通过乙醇沉淀得到DNA。将收集的DNA 100倍稀释后作为模板,采用表1 中的引物对23 种启动子进行PCR 扩增,验证体内条件下rRv0827c 与23 种启动子的结合情况。
1.6 rRv0827c 与rv3616c启 动 子DNA 特 异 性 结 合及大沟小沟结合试验 以MTB H37Ra 基因组为模板,采用5′端Cy5 标记引物Rv3616c-F/R(表1),PCR 扩增得到Cy5 标记的rv3616c启动子,分别将终浓度为40 nmol/L、60 nmol/L、80 nmol/L未标记Cy5的rv3616c启动子加入到终浓度36.1 nmol/L Cy5 标记的rv3616c启动子与rRv0827 蛋白的反应体系中,进行EMSA,使未标记的rv3616c竞争结合蛋白;甲基绿和放线菌素-D 已被报道能够分别结合于DNA 的大沟以及小沟[7],将rRv0827c 和Cy5 标记的rv3616c启动子DNA 分 别 与0.05 mmol/L、0.25 mmol/L、0.5 mmol/L、1.25 mmol/L 的放线菌素-D,及分别与20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L 的甲基绿混合,进行EMSA,37 ℃孵育30 min,经8 %非变性聚丙烯酰胺凝胶在200 V 下电泳3 h,结束后用Typhoon 扫描仪对结果进行扫描分析,检测rRv0827c 与rv3616c启动子的特异性结合及结合区域。
1.7 金属离子对rRv0827c 与rv3616c启动子DNA结合影响的检测 利用EMSA 方法检测10 种常见金属离子(Cu2+、Mn2+、Co2+、Pb2+、Cr3+、Fe3+、Ni2+、Zn2+、Mg2+、Cd2+)对rRv0827c 与rv3616c启动子结合的影响。如上述方法1.4 中的EMSA 方法所述,加入启动子rv3616c及rRv0827c 后,分别加入终浓度为20 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L 的10种金属离子,37 ℃孵育30 min后经凝胶成像分析金属离子对rRv0827c与rv3616c启动子结合的影响。
1.8 rRv0827c 与rv3616c启动子DNA 结合的表面等离子共振(SPR)试验 以MTB H37Ra 基因组为模板,用生物素化的Rv3616c 引物(表1)扩增rv3616c启动子片段,使得rv3616c启动子3′端带有生物素标签。采用SPR 试验检测rRv0827c 和rv3616c启动子之间的相互作用,将生物素标记的rv3616c启动子片段用HBS-EP 缓冲液稀释至0.125 ng/μL,打开Biacore 8K Control Software 中的偶联(Immobilization)程序,选择芯片种类为SA 芯片,设置流速为10 μL/min,进样时间为20 s,将生物素标记的rv3616c启动子偶联至SA 芯片表面,随后使100 nmol/L~1 000 nmol/L 的rRv0827c流经芯片表面,设置结合时间为300 s,解离时间为600 s,缓冲液为HBS-EP,通过Biacore Evaluation 软件,进一步分析rRv0827c 和rv3616c启动子的特异性结合。
1.9 启动子DNA 保守核苷酸位点的确定 根据rRv0827c 与23 种启动子DNA 的结合特性,将与rRv0827c 结合的启动子DNA 序列利用MEME 软件,分析保守的核苷酸位点并绘制Sequence logo 图。
2 结 果
2.1 rRv0827c 的表达、纯化及多克隆抗体的鉴定结果将经酶切和测序鉴定构建正确的重组质粒pET-22b-rv0827c转 化E. coliBL21(DE3)感 受 态 细胞,经IPTG 诱导表达亲和层析纯化后,利用western blot 鉴定。结果显示在18.7 ku 处有目的条带,与预期蛋白大小相符(图1),表明rRv0827c 正确表达。将纯化的rRv0827c 3 次免疫新西兰大白兔后,对获得的血清进行亲和纯化,经SDS-PAGE 检测结果显示,在50 ku 以及20 ku 处出现重链以及轻链目的条带(图2),表明获得纯化的rRv0827c 多克隆抗体。

图1 rRv0827c的western blot鉴定结果Fig.1 Identification of the recombinant protein rRv0827c by western blot
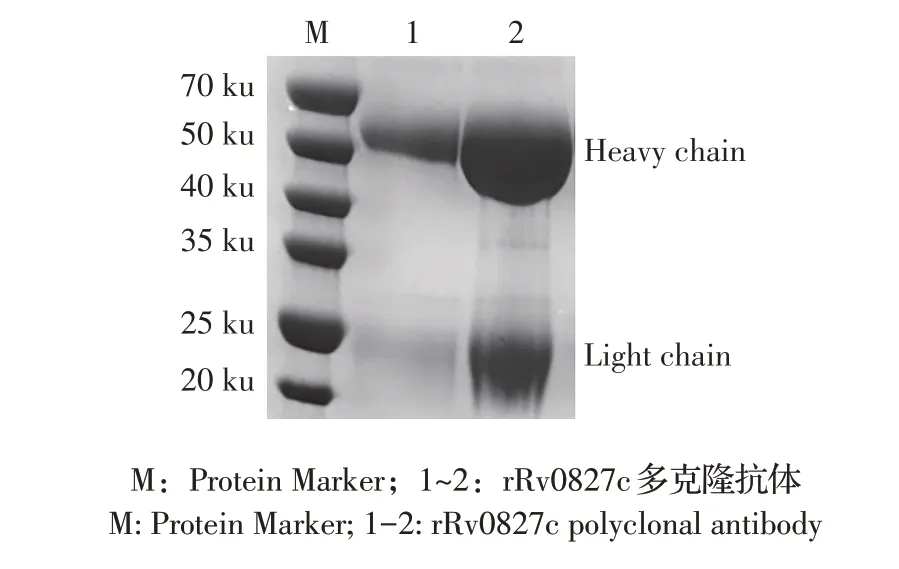
图2 抗rRv0827c多克隆抗体的SDS-PAGE鉴定结果Fig.2 Identification of anti-rRv0827c polyclonal antibody by SDS-PAGE
2.2 rRv0827c 与启动子DNA 体外结合的EMSA 试验结果利用EMSA 试验在体外验证rRv0827c 与预测的23 个基因或基因簇的启动子结合情况,启动子片段经PCR 扩增并纯化后与rRv0827c 37 ℃孵育30 min 后进行凝胶成像分析。结果显示23 种启动子均能够与rRv0827c 形成复合物,与未加入蛋白的游离启动子DNA 对照相比,加入蛋白后可以观察到明显的蛋白-DNA 滞后带(图3),表明rRv0827c 在体外条件下能够与这23 种启动子结合。
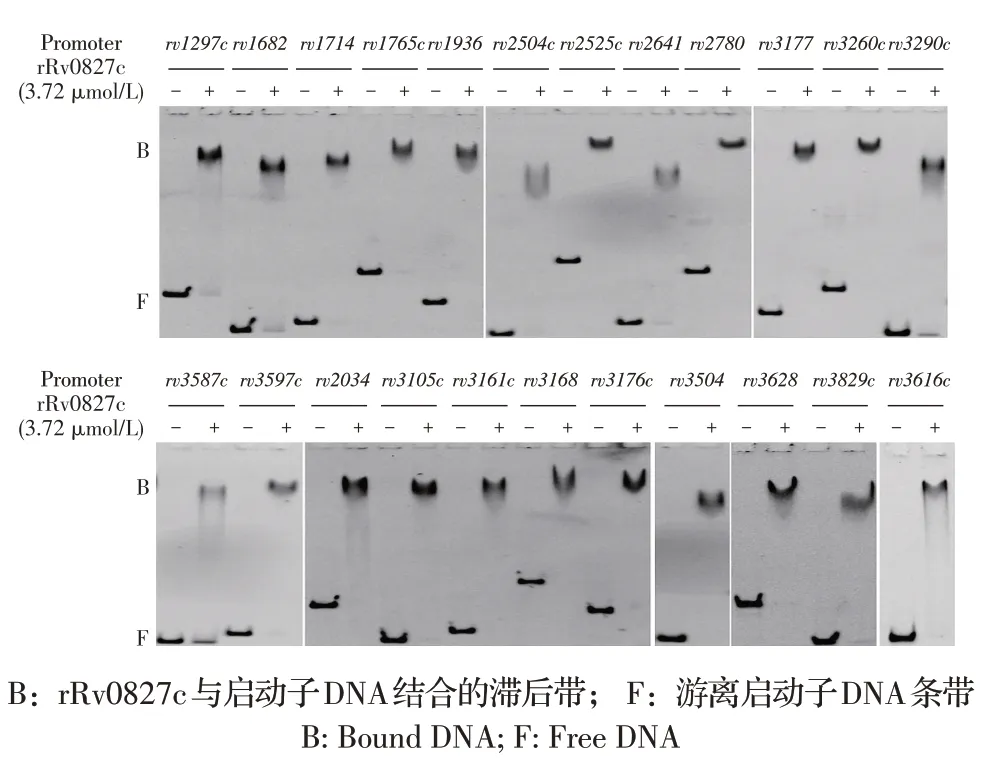
图3 rRv0827c与23种启动子在体外结合的EMSA检测结果Fig.3 The EMSA results of rRv0827c binding to 23 promoters in vitro
2.3 rRv0827c 与启动子DNA 菌体内结合的ChIP 试验结果利用ChIP 试验检测rRv0827c 在菌体内与预测的23 种启动子的结合情况,以多克隆抗体富集的rRv0827c-DNA 复合物作为模板,利用相应的引物(表1)通过PCR 分别扩增23 种启动子片段,并设置MTB H37Ra 基因组DNA 及免疫前血清作为阳性及阴性对照。经1%的琼脂糖凝胶电泳检测,结果显示加入rRv0827c 多克隆抗体富集的DNA 及MTB H37Ra 基因组DNA 均能够扩增出明暗一致的条带,而免疫前血清对照组未出现明显条带(图4),表明rRv0827c在体内也能够与这23 种启动子结合。

图4 rRv0827c与23种启动子在菌体内结合的ChIP检测结果Fig.4 The ChIP results of rRv0827c binding to 23 promoters in vivo
2.4 rRv0827c 与rv3616c启动子DNA 的特异性结合及大沟小沟结合试验结果为探究rRv0827c 与rv3616c启动子DNA 能否特异性结合,本研究将高浓度的rv3616c启动子DNA 分别与低浓度Cy5 标记的rv3616c启动子DNA 共同孵育,以竞争结合rRv0827c。结果显示,随着未标记启动子DNA 的浓度逐渐升高,rRv0827c 与Cy5 标记的rv3616c启动子DNA 的结合复合物减少,游离Cy5 标记的rv3616c启动子DNA逐渐增多,表明rRv0827c 能够特异性结合rv3616c启动子DNA(图5)。为进一步探究rRv0827c 是结合在rv3616c的大沟还是小沟,将不同浓度的甲基绿与放线菌素-D 加入反应体系后分析,结果显示随着甲基绿浓度的增加,rRv0827c 与Cy5 标记的rv3616c启动子DNA 的复合物逐渐减少,出现了更多的游离DNA;相反,增加放线菌素-D的浓度对该蛋白-DNA复合物的形成并未产生明显的影响(图6),表明rRv0827c 结合在rv3616c启动子DNA 的大沟。
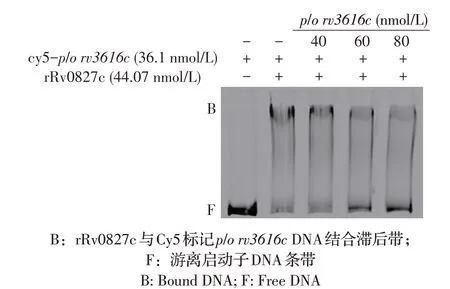
图5 体外EMSA验证rRv0827c特异性结合p/o rv3616c DNA Fig.5 EMSA identification of specific binding of rRv0827c to p/o rv3616c

图6 rRv0827c与p/o rv3616c DNA大沟的结合试验Fig.6 rRv0827c binds to the major groove of p/o rv3616c
2.5 金属离子对rRv0827c 与rv3616c启动子结合影响的EMSA 结果本研究利用EMSA 从10 种常见金属离子中筛选影响rRv0827c 与rv3616c启动子DNA 结合的金属离子。结果显示,Mn2+、Co2+、Pb2+、Cr3+、Fe3+、Ni2+、Mg2+在200 μmol/L 浓度下能够影响二者的结合。其中Co2+、Ni2+、Cr3+影响较为显著,进一步验证发现,随着Co2+、Ni2+浓度由20 μmol/L 提高至200 μmol/L 时,能够明显抑制rRv0827c 与rv3616c启动子复合物的形成,游离DNA 逐渐增加;相反,随着Cr3+浓度的逐渐增加,该蛋白-DNA 复合物更加稳定,游离DNA 浓度逐渐减少至无(图7)。结果表明Co2+、Ni2+能够抑制rRv0827c 与rv3616c启动子的结合,而Cr3+则能够促进rRv0827c与rv3616c启动子的结合。

图7 金属离子对rRv0827c与p/o rv3616c DNA结合的影响Fig.7 The effect of metal ion on rRv0827c binding to p/o rv3616c
2.6 rRv0827c 和rv3616c启动子DNA 结合的SPR试验结果将rRv0827c 经SPR 检测,分析rRv0827c与rv3616c启动子DNA 之间的相互作用。结果显示,由上到下的曲线依次是浓度由高到低的rRv0827c 在rv3616c启动子DNA 表面流过的响应值,随着蛋白浓度由100 nmol/L 升高至1 000 nmol/L,响应值由0.23 RU 逐渐上升至3.58 RU(图8),响应值的变化表明rRv0827c 能够特异性结合rv3616c启动子DNA。

图8 rRv0827c与rv3616c启动子DNA结合的SPR试验结果Fig.8 SPR analysis of rRv0827c binding to rv3616c promoter
2.7 保守核苷酸位点的确定利用MEME 软件分析23 种启动子DNA 序列,绘制了Sequence logo,确定了长11 bp 的碱基序列,横坐标代表核苷酸的位置,纵坐标代表该碱基在该位置的保守性。结果显示,G4 和G10 非常保守,T2 和G7 相对保守(图9),表明4G 和10G 为rv3616c启 动 子DNA 与rRv0827c 互 作 的关键核苷酸位点。

图9 保守核苷酸位点的确定Fig.9 Determination of conserved nucleotide sites
3 讨 论
ArsR/SmtB 家族为目前研究的较为广泛的金属离子感应蛋白,尽管ArsR/SmtB 家族成员具有许多共同的特征,但该家族成员间却表现出对不同金属离子的适应性,如SmtB 蛋白介导的转录抑制作用能够被Zn2+缓解[8],CzrA 介导的抑制作用能够被Co2+以及Zn2+缓解[9]。Rv0827c(KmtR)属于ArsR/SmtB 家族转录因子中的一员。本研究首先通过EMSA 试验与ChIP试验证实发现Rv0827c 能够与细菌单杂交预测的与氧化还原及金属离子转运等功能相关的23 种启动子发生结合,表明Rv0827c 能够参与菌体内各种重要的生理过程,对维持菌体内金属离子环境稳态发挥着不可忽视的作用,具有极其广泛的转录调控功能与潜在的研究价值。
MTB 作为胞内寄生菌给人类的健康造成了严重的危害,但目前对MTB 的致病机制仍知之甚少。MTB 的ESX-1 分泌系统对其毒力以及与宿主之间的相互作用是必需的,同时ESX-1 对ESAT-6 以及CFP-10 的分泌同样至关重要,ESAT-6 是一种主要的毒力因子[10],与多种宿主病原体相互作用有关[11],包括宿主细胞裂解[12]、T 细胞抑制[13]和巨噬细胞炎性体激活[14]。Rv3616c(EspA)作为ESX-1 分泌系统的新成员之一受到越来越多的关注,EspA 和ESAT-6 的分泌相互依赖,EspA 的缺失导致ESAT-6 分泌的降低甚至丧失[15]。EspA 中二硫键形成的破坏虽然保留了ESX-1 的功能,但产生了大量的弱毒株,表明EspA 本身是一种主要的毒力因子[16]。细菌单杂交预测EspA 为Rv0827c 的潜在靶点,通过EMSA 试验、ChIP试验以及SPR 试验证实Rv0827c 能够特异性地结合rv3616c启动子,这表明Rv0827c 能够直接调控rv3616c的表达,影响MTB 的毒力。
金属离子是生物体生存所必需的,过高浓度的金属离子会产生毒性,在本研究中,Ni2+、Co2+能够抑制Rv0827c 与rv3616c启动子DNA 的结合,Cr3+则促进二者的结合,表明Rv0827c 蛋白表现出不同的金属离子适应性,但这种差异产生的原因尚不清楚,原因之一可能是不同的金属离子与蛋白结合后会带来Rv0827c 蛋白构象的变化进而导致结合能力发生改变。通过分析23 个基因的启动子序列结果显示G4 以及G10 在大多数的DNA 序列中均非常保守,Rv0827c蛋白与启动子的结合很大程度上依赖这两个核苷酸位点发生相互作用。
本研究首次解析了MTB ArsR/SmtB 转录抑制因子家族中Rv0827c 潜在的23 个调控靶点,并对Rv0827c与毒力因子rv3616c调控靶点的相互作用进行了更进一步的研究,Rv0827c 能够直接结合rv3616c启动子DNA,推测其可能参与EspA 转录的调控甚至影响ESX-1 分泌系统的功能,表明Rv0827c 不仅在金属离子转运方面具有一定的调控作用,对MTB 毒力也有着重要的影响。综上,本研究为深入解析Rv0827c的调控功能及完善Rv0827c 的调控网络研究奠定了实验基础,也为开发新的抗MTB 药物提供了参考。

