武昌湖退化湿地菰草根际水体细菌多样性
刘赵文,汪雨,羊礼敏,叶姗,程起航
武昌湖退化湿地菰草根际水体细菌多样性
刘赵文1,汪雨2,羊礼敏1,叶姗1,程起航1
(池州学院 1. 材料与环境工程学院,2. 地理与规划学院,安徽 池州 247000)
为研究湿地细菌群落结构及功能与退化湿地环境之间的关系,选取武昌湖湿地菰草()根际水体环境样本,提取样本细菌基因组DNA,并利用16S rDNA基因进行454高通量测序,共得到优质序列17 051条,产生3 032条OUT.结果表明,武昌湖退化湿地菰草根际水体细菌群落结构涉及15门50属,其中以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线细菌门(Actinobacteria)、蓝细菌(Cyanobacteria)为主要门类;菰草根际不同水体环境细菌群落结构存在显著差异,生物多样性指数Shannon,Chao,ACE指数及OTUs的变化特征均表明菰草介入导致其根际水体细菌群落多样性降低;湿地微环境下菌种组成与环境功能之间有密切的联系.探究湿地退化过程中植被菰草根际细菌群落结构特征,对揭示长江中下游浅水湖泊湿地退化机理具有重要意义.
湿地;菰草;细菌多样性;高通量测序;武昌湖
湿地作为同时兼顾水生和陆生环境的一种特殊生境,面积虽然不到陆地面积的1/10,却承载了地球上1/5已知生物的生存环境[1].湿地生态系统具有调节生物多样性、气候和土壤碳储存等重要的生态系统服务功能[2].武昌湖湿地位于长江中下游北岸,近年来湖面大面积菰草()繁殖导致湿地退化现象非常严重,植物群落数量均极大降低,使植物群落趋向同质化,生物多样性遭到破坏[3-4].
微生物作为湿地中的主要分解者,参与了根际微环境N,P元素的循环和利用,直接影响着植物生长发育等[5],根际微生物可有效提高植物对土壤氮素的吸收和利用[6].植物入侵会对湿地土壤理化性质和土壤微生物群落产生显著影响.研究表明,植物入侵会改变土壤性质以及土壤微生物群落结构等[7].郑洁[8]等研究发现互花米草入侵使红树林土壤质量发生明显退化,土壤微生物群落多样性指数明显下降.Cui[9]等在研究互花米草入侵沿海湿地时发现植物入侵使硫酸盐还原菌群落的丰富度和多样性显著提高.Liu[10]等在研究红树林湿地植物入侵时发现,植物入侵改变了土壤细菌群落组成和功能.YANG[11]等研究发现,植物入侵使土壤真菌功能类群发生了改变,腐生真菌的相对丰度显著增加,共生真菌和病原性真菌的相对丰度显著降低.
根际微生物进行代谢不断向体外分泌养分和低分子有机物等,极大地提高了植物对养分的利用效率,因此微生物多样性对植物的生长、发育、群落结构演替具有重要的作用[12].但从研究对象来看,目前学者研究植物根际土壤微生物较多,而关于植物根际水体微生物的研究鲜有报道.通过研究入侵植物菰草根际水体细菌群落结构多样性,探究湿地退化过程中植被根际微生物群落结构特征,对揭示长江中下游浅水湖泊湿地退化机理具有一定的借鉴意义.
1 材料与方法
1.1 研究区概况
武昌湖湿地位于安徽省西南部安庆市望江县东北部,东经116°26′~116°53′,北纬30°9′~30°24′,属北亚热带季风湿润气候区,这里四季分明,全年平均气温约为16.5 ℃,雨水充足,全年平均有130~150 d为降水日,降水量可达到1 400 mm,全年日照可达到2 052~2 065 h.该湿地系断裂带局部凹陷洼地,经长江泥沙长期淤塞、积水而成的淡水湖湿地是长江中下游北岸古雷池遗迹的重要组成部分.景区水域面积达102.5 km2,水生资源极为丰富,其生态作用主要体现在调节气流、改善气候、区域旅游、渔业养殖等[13].武昌湖湿地区位与菰草种群空间分布情况见图1.武昌湖湿地是以草本沼泽和湖泊为主的一块湿地,其东西长约20 km,南北长约7.5 km,1993年修建的跨湖公路将武昌湖分割为上湖和下湖2个区域.湿地植被建群种主要以挺水植物——菰草为主,高度为0.8~2.1 m,生长茂盛,盖度常可达60%~70%,其它伴生种主要有莲子草、愧叶萍、丘角菱、水鳖、浮萍等.

图1 武昌湖湿地区位与菰草种群空间分布图
1.2 样品采集
采样前期通过查阅相关文献及实地多次观察发现,武昌湖湿地菰草部分群落在每年的丰水期会大面积漂浮在水上,随着水位下降,种群会漂到不同的环境下重新扎根生长.本文选取武昌湖湿地菰草群落重新扎根在不同的微环境下生长后的菰草根际水体作为研究对象.结合现实可操作性以及该区域的地形地势,选取了武昌湖湿地4个样点作为釆样区域,采样点的基本概况见表1.采样时使用GPS卫星定位,记录采样区域的地理位置,各样点优先选择采集水样.采集水样时先将蓝盖瓶用采样点水样润洗几遍后再取水样1 000 mL.

表1 采样点基本概况
1.3 样本理化参数测定
水体浊度的测定(GB 13200—91)、水体总氮的测定(GB HJ 636—2012)、水体氨氮的测定(GB HJ 536—2009)、水体总磷的测定(GB 11893—89)、水体化学需氧量(CODcr)的测定(GB 11914—89).
1.4 样品基因组DNA的提取及高通量测序
采用PowerSoil®DNAIsolation试剂盒分别提取菰草根际水体环境样本总DNA,样本经0.22 μm滤膜负压过滤收集水体细菌后,用干冰保存样品,并寄至上海美吉生物公司完成DNA抽取和测序.利用Nanodrop-2000检测总DNA浓度,并利用1%琼脂糖凝胶电泳检测DNA质量.分别对各环境样本总DNA进行16S rRNA基因PCR扩增,所采用的引物为338F:5′-ACTCCTACGGGAGGCAGCAG-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′.PCR扩增体系包含2 μL dNTP(2.5 mmol/L)、0.8 μL正/反向引物(5 μmol/L)、0.4 μL 5×FastPfu缓冲液、10 ng模板DNA、0.2 μL BSA、0.4 μL FastPfu聚合酶,并加ddH2O至反应体积为20 μL.扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,28次循环,最后72 ℃延伸10 min.利用2%琼脂糖凝胶电泳检测PCR产物,并用纯化试剂盒纯化,然后对目标产物用Illumina进行高通量测序并分析.
2 结果与讨论
2.1 武昌湖退化湿地菰草生长水环境
菰草根际水体各样点的理化性质见表2.由表2可见,武昌湖湿地菰草根际水体基本偏弱酸性.菰草根际水体样品间浊度大小为W3>W4>W2>W1,这可能是由于采样点间的微环境不同,从而导致各水样间浊度存在一定差异.

表2 武昌湖湿地菰草根际水体理化性质
水中总氮、总磷和氨氮的含量是水生植物最主要的营养物质来源,其含量的多少是直接导致水质污染现象的最主要原因之一.菰草根际水体总氮含量的大小为W3>W2>W1>W4,总磷含量的大小为W3>W1>W2>W4,氨氮含量的大小为W3>W4>W2>W1.根据我国地表水环境质量标准(GB 3838—2002)发现,总氮含量W1,W4水样符合三类水(≤1.0 mg/L)的标准,W2,W3水样符合四类水(≤1.5 mg/L)标准;氨氮含量除了W3水样属于四类水(≤1.5 mg/L)标准,其它3组水样属于三类水(≤1.0 mg/L)标准;总磷含量只有W4符合三类水(≤0.05 mg/L)标准,其它3组属于四类水(≤0.1 mg/L)标准;化学需氧量除了W2外,其它3组属于四类水(≤30 mg/L)标准.W3水样中的营养元素含量高于其它组,这可能与该环境中菰草常年漂浮生长在水面上有关,水体中的营养元素基本上成为该环境下菰草生长的唯一来源,使菰草根际某些微生物可能对营养元素具有一定的富集作用.这一发现与相关学者研究结果具有一定的相似性,如Eileen[14]等在研究斑点矢车菊过度繁殖时发现,其根际的菌根菌通过地下菌丝网络将碳水化合物等由本土植物向斑点矢车菊根际运输,从而抑制了本土植物的生长,促进了斑点矢车菊在河漫滩地的过度生长.Fumanal[15]等在研究植物豚草时发现,接种其根际的丛枝菌根真菌能显著增加豚草的叶片数、株高以及总生物量干质量等,促进了其种群的进一步扩大.植物紫茎泽兰在入侵我国西南部时,重度入侵区土壤中总磷、硝态氮的含量及土壤中自生固氮菌的数量和种类的多样性都显著高于轻度入侵区和未入侵区[16-17].而水样其它的理化性质具有一定的差异性,很可能跟采样点的选取及采样点微环境的不同存在一定联系.
2.2 菰草根际水环境中微生物群落多样性分析
随机抽样测试序列,并基于所抽到获得的序列数表征其可代表的数目,构建稀释性曲线(见图2).就稀释曲线分析4个水环境样本基本达到0.97%,总体处于平坦的状态,但是尚未能饱和.这说明样品中包含很多与数据样本有关的信息,能够总体说明湿地细菌群落情况.Rank-abundance曲线的作用主要体现在说明物种的丰富程度及其均匀程度,一般可用曲线形状说明,如果曲线较为平坦则说明其所对应的物种组成具有较高的均匀度;通过横轴上曲线的长度可说明物种的丰富程度,如果该曲线越宽,则表征具有越为丰富的物种组成.通过W4水样的曲线说明采样点具有较高的物种丰富度,其中W2的物种丰富程度最小,这一结果与上面根据多样性指数所得到的结果基本保持一致,存在小的差异可能是由于不同计算方法之间存在一定的误差所导致.

图2 武昌湖湿地水样Rank-abundance曲线
运用Mothur软件基于97%分类,计算出其多样性生物指数(见表3).由表3可见,不同水体微环境下,OTUs的大小为W4>W1>W3>W2,细菌多样性Chao指数大小为W4>W1>W2>W3,ACE指数大小为W4>W2>W1>W3,Shannon指数大小为W4>W3>W1>W2,Simpson指数大小为W2>W1>W3>W4.利用16S rDNA基因进行454高通量测序,在97%相似度水平下,利用Mothur软件对各环境样本进行分析发现,武昌湖湿地水体细菌菌属按照W4>W3>W1>W2规律依次递减.退化湿地菰草水环境中细菌多样性十分丰富,共涉及15门,50个属.

表3 武昌湖湿地菰草水环境细菌群落丰富度及多样性
OTUs分布维恩图见图3.由图3可见,3种微环境下相同的OTUs为155个,约占OTUs总数的9.5%;从OTUs分布情况来看,W1和W2的相似性最大,共有389个相同OTUs,占两者OTUs总数的54%;其次是W1和W4两者共有483个相同OTUs,占两者OTUs总数的34%;W2和W3共有274个相同OTUs,占两者OTUs总数的32%;W1和W3共有309个相同OTUs,占两者OTUs总数的31%;W2和W4共有357个相同OTUs,占两者OTUs总数的26%;W3和W4为4组样品两两之间相似性最低的,共有327个相同OTUs,占两者OTUs总数的23%.

图3 武昌湖湿地菰草水环境样本细菌群落OTUs分布维恩图
通过测试分析表明,武昌湖菰草水环境细菌在门分类水平上(见图4)绝对优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线细菌门(Actinobacteria)、蓝细菌(Cyanobacteria).但是各菌门丰度在各样品间存在一定差异,变形菌门在各样本中相对丰度为W2(75.19%)>W4(66.03%)>W1(48.45%)>W3(21.02%),拟杆菌门在各样品中相对丰度为W1(28.91%)>W3(17.38%)>W4(8.42%)>W2(7.98%),放线细菌门在样品中相对丰度为W3(28.93%)>W1(13.36%)>W2(11.56%)>W4(7.85%),蓝细菌在样品中相对丰度为W3(22.37%)>W1(3.36%)>W4(2.25%)>W2(2.06%).

图4 武昌湖湿地菰草水环境样本细菌群落结构(门水平上)组分图
2.3 菰草根际水体优势菌种环境功能分析
菰草根际水体样本细菌群落Heatmap图见图5.由图5可见,菰草根际水体在不同微环境下细菌在属水平上的优势菌种作为W1文库中第一类优势菌属,其比例高达26.69%,而且Hahn[18]等发现该菌属于化学有机营养的兼性厌氧微生物,广泛存在于淡水和湖泊中,具有同化乙酸盐、甘油酸盐和葡萄糖酸盐等功能.第二类是广泛分布于土壤和水中的典型有机化能营养型的好氧反硝化细菌——黄杆菌属,该菌在文库中的比例为13.67%.而第三大类丛毛单胞菌属在文库中比列为6.69%,研究表明该菌属可用于活性污泥处理废水的脱氮除磷处理工艺,不仅能够将蛋白质分解成氨基酸,而且还能分解苯酚、有机酸和氨基酸[19].作为W2文库中第一类优势菌属(29.91%),Kim[20]等发现其广泛存在于湖泊、淡水沉积物和沼泽中,该细菌严格好氧且主要以甲烷、甲醇等含甲基单碳化合物作为碳源和能源.(10.80%)兼性甲基营养菌细胞呈椭圆形或杆状.除了甲胺外,还可以利用果糖、甜菜碱、甲醇、丙酮酸和乙醇作为碳源,利用铵、硝酸盐和尿素可作为氮的来源[21].是一种兼性厌氧化自养菌,以硫化物、元素硫、硫代硫酸盐和氢作为电子供体,能够利用不同的硫种类和硝酸盐[22].W3文库中最主要优势菌属是.W4文库中优势菌属为(14.25%),红环菌在文库中的比例为9.59%,该类微生物能够分解不同有机物获得碳源进行生存,其在环境有机污染物降解方面具有较好的应用前景[23].革兰氏阴性需氧细菌(6.95%)在结构和功能上都专门利用甲烷作为唯一的能量和碳源,该细菌能够适应自然生态位中的显著温度变化[24].
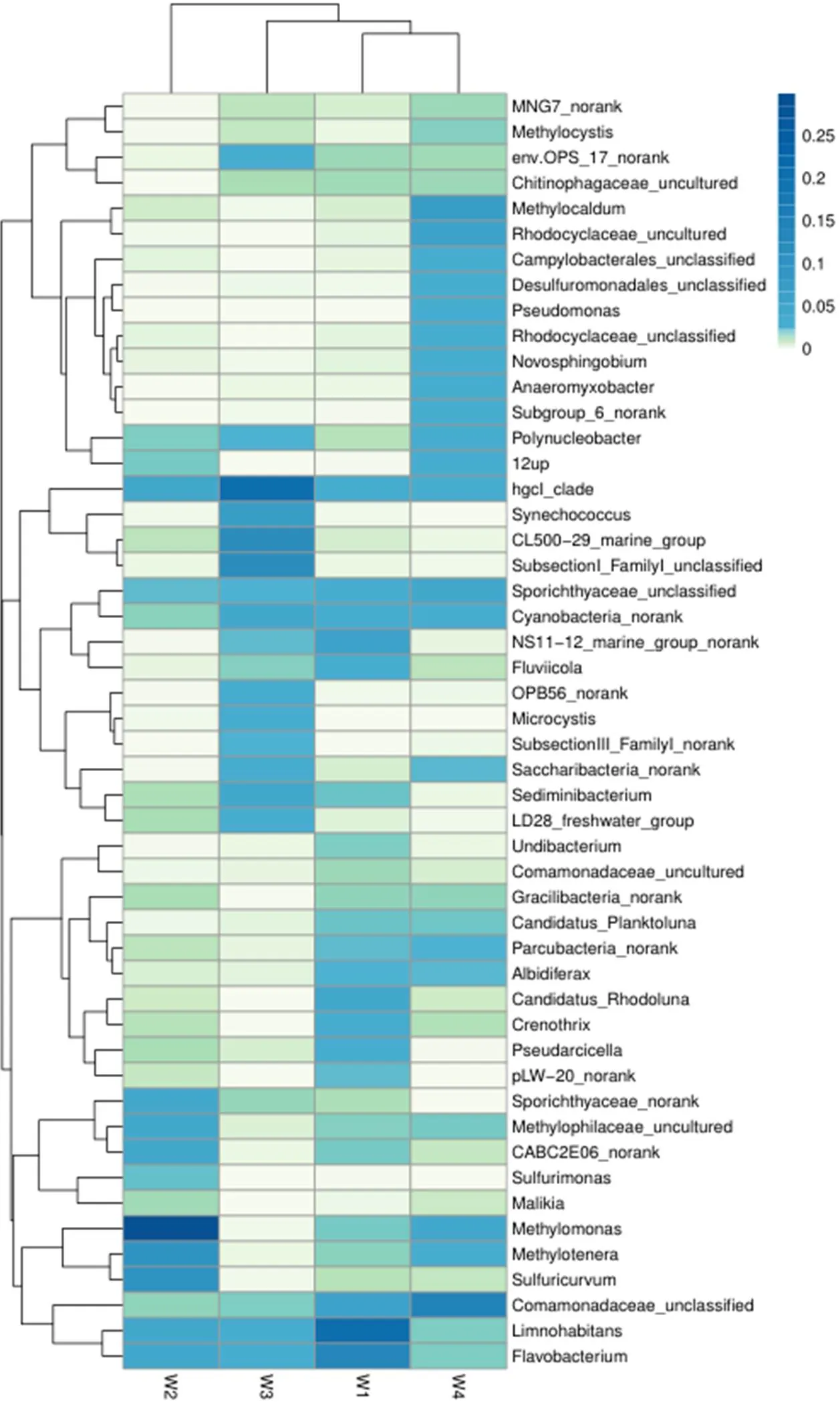
图5 武昌湖湿地水环境样本细菌群落Heatmap图
菰草根际水体不同微环境细菌群落结构存在明显差异.W1优势菌种为Proteobacteria,Actinobacteria,Bacteroidetes,3种之和占检测总门数的94.08%;W2优势菌种为Proteobacteria,Actinobacteria,2种之和占检测总门数的86.78%;W3优势菌种为Proteobacteria,Bacteroidetes,Actinobacteria,Cyanobacteria,4种之和占检测总门数的89.7%;W4优势菌种为Proteobacteria,该菌门占检测总门数的66.03%.尽管Proteobacteria在4种水体微环境中都是绝对优势菌种,但在不同的环境中所占的比例各不相同,在W3(21.02%),W1(48.45%),W4(66.03%),W2(75.19%)中的比例逐渐增大;4组水体样品生物多样性指数表明了各样本的细菌间存在差异性丰度,这一点通过OTU聚类即可进一步验证说明,W4样品的Shannon指数最大,W3和W1样品的Shannon指数大小差别不大,W2的Shannon指数较小,这说明W4样本多样性最高,这一点通过Simpson指数也能够得到验证4组样品细菌的多样性高低为W4>W3>W1>W2.
3 结论
不同环境下根际水体细菌Shannon指数大小为3.78~5.78,根际水体的细菌绝对优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线细菌门(Actinobacteria)、蓝细菌(Cyanobacteria);退化湿地菰草水环境中细菌多样性十分丰富,共涉及15门,50个属.菰草根际不同水体环境细菌群落结构存在显著差异,生物多样性指数Shannon,Chao,ACE指数及OTUs的变化特征均表明菰草介入导致其根际水体细菌群落多样性降低,湿地微环境下菌种组成与环境功能之间有密切的联系.不同微环境下菰草根际细菌多样性存在一定差异,湿地微环境下细菌组成与环境功能之间有密切的联系,它们主要参与脱氮除磷,降解大分子有机物和重金属以及为植物群落的演替提供了良好的生境.
[1] 周雅心,陈钰,郑毅,等.中国典型滨海湿地转变为养殖塘对土壤细菌多样性及群落结构的影响[J].环境科学学报,2021,41(6):2402-2413.
[2] 肖涛,石强胜,闻熠,等.湿地生态系统服务研究进展[J]. 生态学杂志,2022,41(6):1205-1212.
[3] 周葆华,尹剑,金宝石,等.30年来武昌湖湿地退化过程与原因[J].地理学报,2014,69(11):1697-1706.
[4] 刘赵文,周葆华,寇乐勇,等.武昌湖典型退化湿地菰草根际微生物群落结构[J].地球与环境,2018,46(4):339-347.
[5] Nico E,Stefan S,Alexandre J,et al.Bacterial Diversity Stabilizes Community Productivity[J].PLoS ONE,2012,7(3):e34517.
[6] Cole L,Staddon P L,Sleep D,et al.Soil animals influence microbial abundance,but not plant microbial competition for soil organic nitrogen[J].Functional Ecology,2004,18(5):631-640.
[7] Montserrat Vilà,José L Espinar,Hejda M,et al.Ecological impacts of invasive alien plants:A meta-analysis of their effects on species,communities and ecosystems[J].Ecology Letters,2011,14(7):702-708.
[8] 郑洁,刘金福,吴则焰,等.闽江河口红树林土壤微生物群落对互花米草入侵的响应[J].生态学报,2017,37(21):7293-7303.
[9] Cui J,Chen X,Nie M,et al.Effects of Spartina Alterniflora Invasion on the Abundance,Diversity,and Community Structure of ulfate Reducing Bacteria along a Successional Gradient of Coastal Salt Marshes in China[J].Wetlands,2017,37(2):221-232.
[10] Liu M,Yu Z,Yu X,et al.Invasion by cordgrass increases microbial diversity and alters community composition in a mangrove nature reserve[J].Frontiers in Microbiology,2017,8:2503.
[11] YANG W,JEELANI N,XIA L,et al.Soil fungal communities vary with invasion by the exotic Spartina alternifolia Loisel in coastal salt marshes of eastern China[J].Plant and Soil,2019,442(1/2):215-232.
[12] 赵官成,梁健,淡静雅,等.土壤微生物与植物关系研究进展[J].西南林业大学学报,2011,31(1):83-88.
[13] 周葆华,操璟璟,朱超平,等.安庆沿江湖泊湿地生态系统服务功能价值评估[J].地理研究,2011,30(12):2296-2304.
[14] Eileen V Carey,Marilyn J Marler,Ragan M Callaway.Mycorrhizae transfer carbon from a native grass to an invasiveweed:evidence from stable isotopes and physiology[J].Plant Ecology,2004,172(1):133-141.
[15] Fumanal B,Plenchette C,Chauvel B,et al.Which role can arbuscular mycorrhizal fungi play in the facilitation of Ambrosia artemisiifolia L. invasion in France?[J].Mycorrhiza,2006,17(1):25-35.
[16] Xu Chanwen,Yang Mingzhi,Chen Yunjiao,et al.Changes in non-symbiotic nitrogen-fixing bacteria inhabiting rhizosphere soils of an invasive plant Ageratina adenophora[J].Applied Soil Ecology,2012,54:32-38.
[17] Xin S,Cheng G,Guo L D.Changes in soil microbial community and enzyme activity along an exotic plant Eupatorium adenophorum invasion in a Chinese secondary forest[J].Science Bulletin,2013,58(33):4101-4108.
[18] Hahn M W,Kasalický V,Jezbera J,et al.Limnohabitans australis sp. nov. isolated from a freshwater pond,and emended description of the genus Limnohabitans[J].International Journal of Systematic and Evolutionary Microbiology,2010,60(12):2946-2950.
[19] Ge H,Batstone D J,Keller J.Biological phosphorus removal from abattoirWastewater at very short sludge ages mediated by novel PAO clade Comamonadaceae[J].Water Research,2015,69:173-182.
[20] Kim S,Lee W,Song I,et al.Production of uracil from methane by a newly isolated Methylomonas sp. SW1[J].Journal of Biotechnology,2016,240:43-47.
[21] Vorobev A,Beck D,Kalyuzhnaya M G,et al.Comparative transcriptomics in three Methylophilaceae species uncover different strategies for environmental adaptation[J].Peer J,2013,1(1):e115.
[22] Han C,Kotsyurbenko O,Chertkov O,et al.Complete genome sequence of the sulfur compounds oxidizing chemolithoautotroph Sulfuricurvum kujiense type strain(YK-1T)[J].Standards in Genomic Sciences,2012,6(1):94-103.
[23] Jinwook C,Sunghoon S,Jeill O.Characterization of a microbial community capable of reducing perchlorate and nitrate in high salinity[J].Biotechnology Letters,2009,31:959-966.
[24] Medvedkova K A,Khmelenina V N,Suzina N E,et al.Antioxidant systems of moderately thermophilic methanotrophs Methylocaldum szegediense and Methylococcus capsulatus[J].Microbiology,2009,78(6):670-677.
Bacterial diversity in rhizosphere water ofin degenerating wetland of Wuchang Lake
LIU Zhaowen1,WANG Yu2,YANG Limin1,YE Shan1,CHENG Qihang1
(1. School of Materials and Environmental Engineering,2. School of Geography and Planning,Chizhou University,Chizhou 247000,China)
In order to study the relationship between wetland bacterial community structure and function and degraded wetland environment,selects the rhizosphere water environment samples ofin Wuchang Lake wetland,extracts the bacterial genome DNA,and uses 16S rDNA gene for 454 high-throughput sequencing.A total of 17 051 high-quality sequences and 3 032 OUT were obtained.The results showed that the bacterial community structure ofrhizosphere water in the degraded wetland of Wuchang Lake involved 15 phyla and 50 genera,among which Proteobacteria,Bacteroides,Actinobacteria and Cyanobacteria were the main phyla.There are obvious differences in bacterial community structure in different water environments in the rhizosphere of.The variation characteristics of biodiversity indexes Shannon,Chao,ACE index and OTUs all show that the intervention ofleads to the decrease of bacterial community diversity in the rhizosphere of.There is a close relationship between species composition and environmental function in wetland microenvironment.Exploring the structural characteristics of rhizosphere bacterial community ofin the process of wetland degradation is of great significance to reveal the mechanism of wetland degradation in shallow lakes in the middle and lower reaches of the Yangtze River.
wetland;;bacterial diversity;high throughput sequencing;Wuchang Lake
1007-9831(2022)10-0059-08
X826
A
10.3969/j.issn.1007-9831.2022.10.012
2022-05-31
池州学院校级重点项目(CZ2019ZRZ02,CZ2021ZRZ12);大学生创新创业项目(202011306157);材料加工实验实训中心项目(2021XSXZX01);材料与化工一流本科人才示范引领基地项目(2020rcsfjd28)
刘赵文(1992-),男,安徽铜陵人,助理实验师,硕士,从事环境污染微生物防治研究.E-mail:liuzhaowen92@163.com

