大鼠颅脑损伤后不同时间基因差异表达
高玉华 魏民 邢鸣 夏鹏飞 陆峰 颜勋 傅宇彤 郑学明
(1南京市高淳人民医院神经外科,江苏 高淳 211300;2盐城市滨海人民医院;3丹阳市中医院;4江苏大学医学院)
颅脑损伤(TBI)是当今威胁人类生命健康的主要疾患之一,在暴力性死亡中TBI的死亡率居首位〔1,2〕。TBI后会引起脑水肿、神经细胞的功能丧失、神经细胞的凋亡等〔3,4〕,但TBI对大脑不同区域神经细胞的影响及导致神经功能丧失的发生发展机制尚未完全清楚。本研究拟利用生物信息学技术筛选出大鼠TBI后不同时间、不同大脑区域的差异表达基因并富集分析差异的生物过程及信号通路,为进一步的深入研究提供线索。
1 材料和方法
1.1数据的下载和预处理 从国家生物技术信息中心(NCBI)的基因表达综合数据库(GEO)下载大鼠(Rattus norvegicus)TBI基因表达芯片数据集GSE2871,芯片平台为 Affymetrix Rat Genome U34 Array(GPL85)。该数据集来自侧流冲击(lateral fluid percussion)TBI的大鼠模型,为不同时间(损伤后4 h和24 h)、不同大脑区域的基因表达谱数据。该数据集由47个基因芯片数据组成,包括:TBI 4 h同侧皮质7例,对侧皮质8例,同侧海马芯片数据7例,对侧海马9例;TBI 24 h同侧皮质9例,对侧皮质7例。根据芯片的注释信息,把探针替换成对应的基因名,去除对应多个基因的探针数据,对应同一基因的多个探针数据,取其平均值。对所有的样品进行标准化,使得不同样品中探针强度具有相似的分布。最后对探针强度数据进行对数(log2)转化得到所有样品的基因表达数据矩阵,进入下一步的差异表达基因(DEG)分析。
1.2差异基因分析 依据TBI后时间和区域对进行样品分组,分别研究TBI后同侧皮质、对侧皮质及整体24 h和4 h基因表达差异。样品的分组和不同组的DEG分析通过R软件Bioconductor的limma包〔5〕实现,运用 “BH” 算法对DEG的P值进行调整得到矫正后的P值。筛选 |logFC| ≥ 1及矫正后的P值≤0.05的基因为有效的DEG。
1.3DEG的功能富集分析 根据芯片的注释信息把DEG名称(Gene Symbol)转化成NCBI Entrez基因数据库的ID号(entrez gene id)。通过R软件Bioconductor的clusterProfiler包〔6〕及大鼠的基因组注释包org.Rn.eg.db进行基因本体(GO)富集分析(enrichGO函数)及京都基因与基因组百科全书(KEGG)通路的富集分析(enrich KEGG函数),P和Q的值选择默认的参数(P=0.05,Q=0.2)。
2 结 果
2.1DEG筛选 为了研究大鼠TBI后24 h和4 h的脑组织表达基因差异,我们根据样品信息,设计了3组实验分别对大脑不同区域及整体进行DEG研究。大鼠TBI后24 h和4 h相比,大脑不同区域筛选到的DEG及之间的关系如图1所示。损伤同侧皮质筛选到的DEG最多,共79个,其中上调43个,下调36个。损伤对侧皮质共找到差异基因60个,其中上调32个,下调28个。而只考虑时间因素,大鼠TBI 24 h和4 h相比,只有44个基因的表达水平发现显著变化,其中上调25个,下调19个。3种分组共同的DEG有3个:脱氧胞苷激酶(Dck)、Smad7及CCAAT/增强子结合蛋白β(Cebpb)。其中上调基因为Dck和Smad7,下调基因为Cebpb。Dck〔7〕为脱氧核糖核酸脱氧胞苷(dC)、脱氧鸟苷(dG)和脱氧腺苷(dA)磷酸化所需,为核苷酸补救合成途径中的关键调控酶。Smad7为SMAD家族成员7,是转化生长因子( TGF)-β和肌动蛋白(actin)的负调节蛋白〔8〕。Cebpb是调节免疫和炎症反应相关基因表达的重要转录因子〔9〕,在脂肪生成、糖异生途径、肝脏再生和造血方面也发挥着重要作用〔10,11〕。
2.2同侧皮质差异表达基因富集分析 对TBI大鼠同侧皮质进行DEG GO富集分析发现DEG主要为膜电位调节、皮质类固醇刺激反应及脂多糖的细胞反应等(图2A)。KEGG信号通路分析发现受影响的信号通路主要为Toll样受体信号通路、肿瘤坏死因子(TNF)信号通路及环磷酸腺苷(cAMP)信号通路等(图2B)。
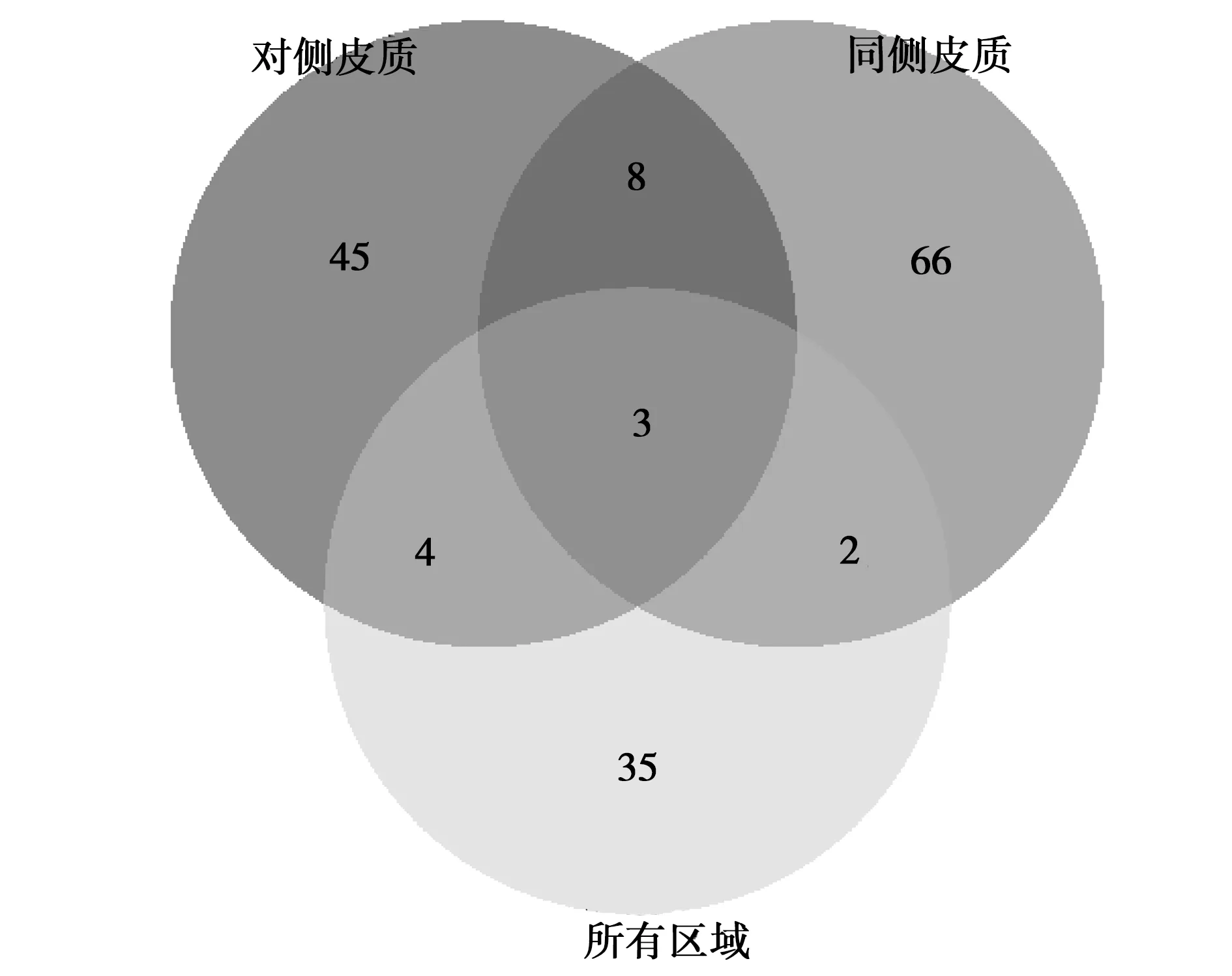
图1 不同分组DEG
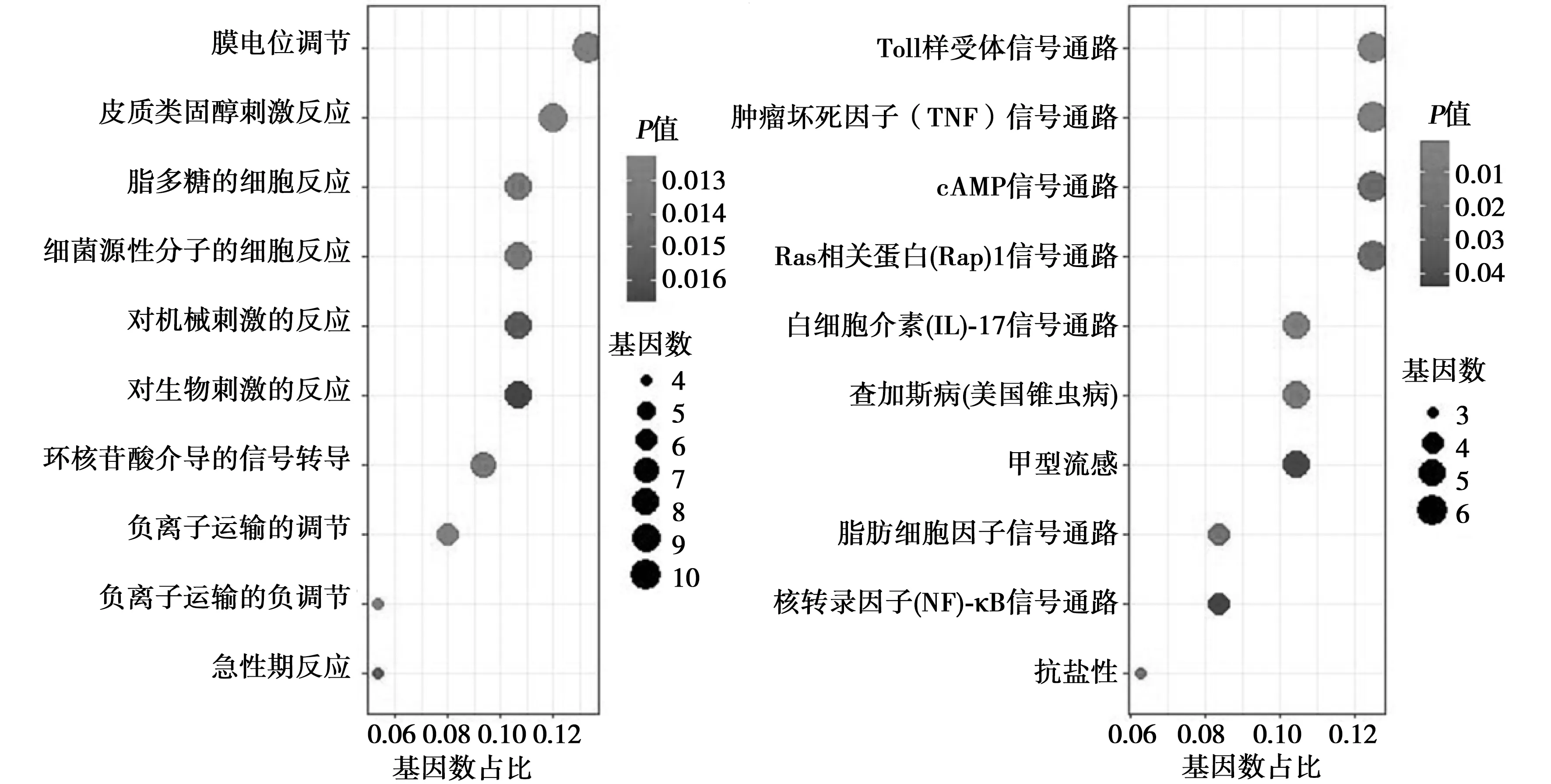
图2 同侧皮质差异表达基因GO(A)及KEGG(B)富集分析结果
2.3对侧皮质差异表达基因富集分析 对TBI大鼠对侧皮质进行DEG GO富集分析发现DEG主要和蛋白质四聚体组装有关(图3A)。KEGG信号通路分析发现受影响的信号通路主要为神经活性配体-受体相互作用及抗坏血酸和醛酸代谢(图3B)。
2.4整体DEG富集分析 对TBI大鼠的所有样品按时间分组进行DEG GO富集分析,发现损伤后24 h和4 h相比,DEG主要和血液循环〔Smad7、嗅觉受体(Olr)59、b1肾上腺素能受体(Adrb1)、5羟色胺受体1A(Htr1a)、钠通道蛋白1型亚单位a(Scn1a)、电压依赖性T型钙通道亚单位2-1H(Cacna1h)、信号转导子和转录激活子(Stat1)、G蛋白信号调节因子(Rgs)4、多巴胺D2受体(Drd)2和信号素3A(Sema3a)〕、心脏收缩(Smad7、Adrb1、Scn1a、Cacna1h、Rgs4、Drd2和Sema3a)及面神经结构等有关〔神经肽(Nrp)2、E2SUMO蛋白连接酶(Egr2)、Sema3a〕。见图4。KEGG信号通路分析没有发现明显差异的信号通路。
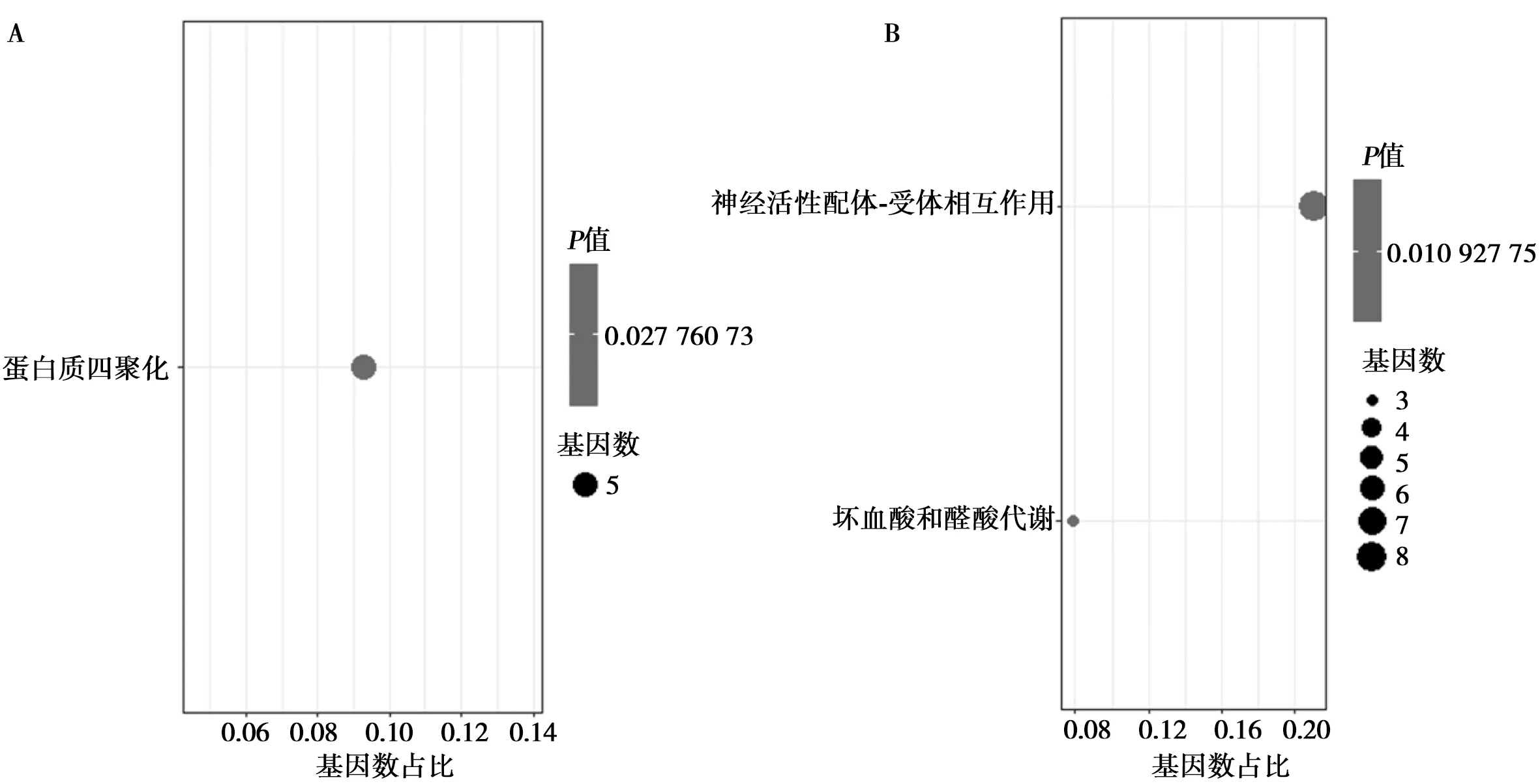
图3 对侧皮质差异表达基因GO(A)及KEGG(B)富集分析结果
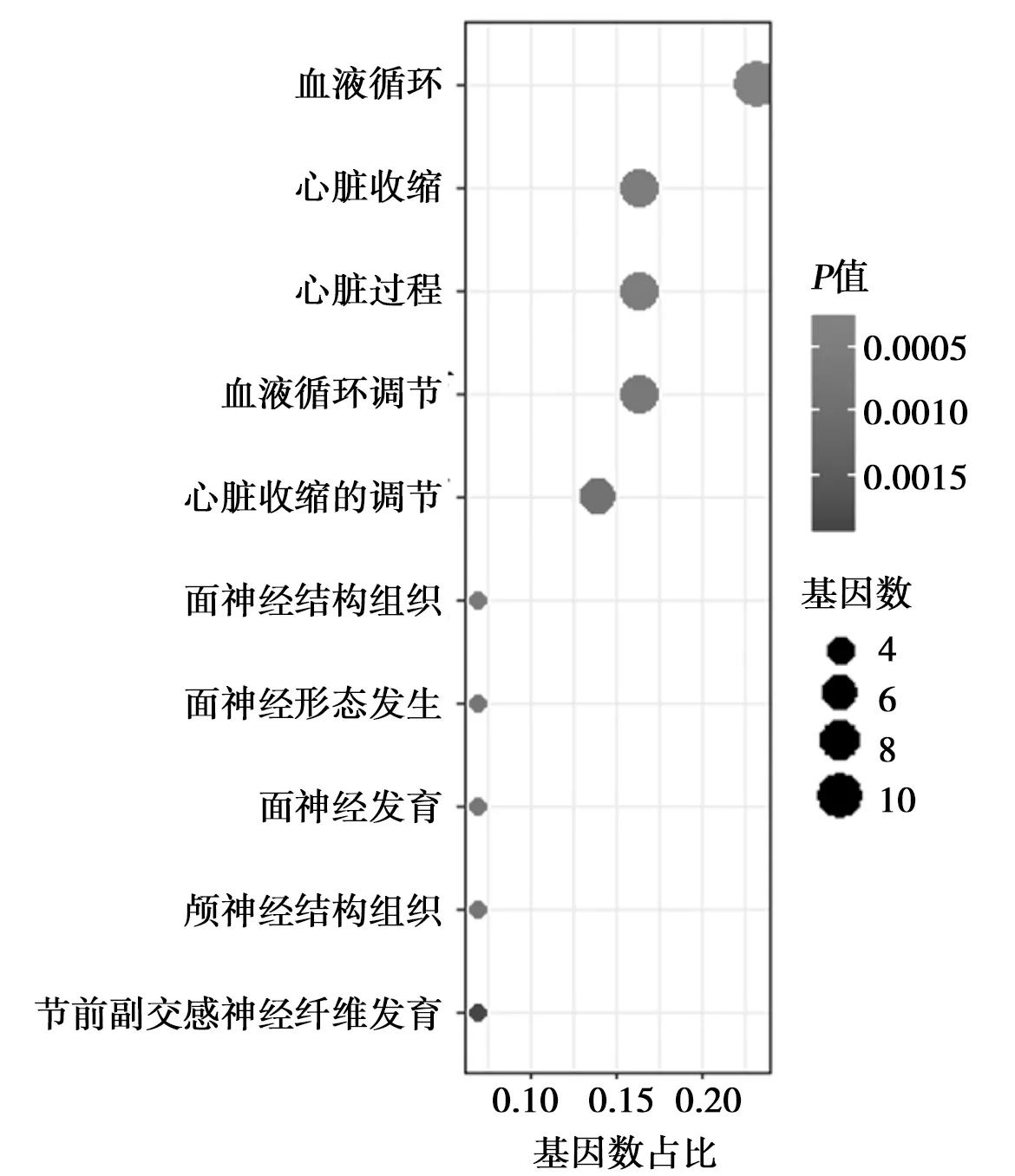
图4 整体差异基因GO富集分析结果
3 讨 论
基因表达谱是从整体水平上反应各个基因的表达水平,大鼠TBI后不同时间的基因表达谱分析可以揭示TBI后一系列症状的发生发展机制。本研究对TBI后大鼠大脑的不同区域及整体分别进行24 h和4 h的差异表达基因分析。分析结果表明大脑的不同区域在损伤后不同时间的DEG有非常大的差异,因此,分区域进行分析非常重要。
大鼠TBI后24 h和4 h相比,同侧皮质比对侧皮质有更多的DEG并富集到更多的信号通路和生物过程。同侧皮质的DEG一部分属于对生物、机械刺激的反应及免疫、炎症等信号通路相关。机械刺激的反应可能直接应答侧流冲击,而对生物刺激的反应及免疫、炎症等信号通路是否由于损伤后感染所致还有待进一步的研究。另一部分DEG属于膜电位和负离子运输调节及细胞凋亡、细胞黏附、细胞-细胞连接等信号通路,揭示可能的神经细胞功能障碍机制。膜电位的变化及负离子的运输是否和TBI引起的脑水肿有关系需要进一步的验证。对侧皮质的DEG主要为蛋白质四聚体组装及神经活性配体-受体相互作用相关,揭示了这一部分神经细胞功能障碍可能的机制。这些差异基因及信号通路需要进一步的实验验证和深入研究。
本研究对整体样品进行分析发现,损伤24 h和4 h相比,主要的DEG为调节血液循环、心脏收缩及面神经结构组织(Nrp2、Egr2和Sema3a)等基因,为进一步揭示TBI引起的神经功能障碍的机制提供了线索。另外,3种分组共同的DEG在TBI中的功能值得进一步的实验验证和深入研究。综上,大鼠TBI模式大大促进了人TBI发生发展机制的研究。本研究发现的大鼠TBI后不同时间、不同区域的DEG,为人TBI的监控与治疗提供新的线索。

