大黄免煎颗粒通过miR-135a/FAM129A分子轴影响胰腺泡细胞损伤的作用机制
程冰洁 郭霞 戴雅琴 陈佩 李长雪
(1湖北省第三人民医院中医科,湖北 武汉 430033;2武汉科技大学中医康复科;3湖北省第三人民医院 药学部)
胰腺炎是外科中常见的无菌性胰腺炎症,致病因素多为酒精滥用和胆结石等,具有复杂多样临床表现〔1,2〕。轻中度胰腺炎不需特殊治疗,重症胰腺炎伴有多种并发症和全身过度炎症,病死高达30%~40%〔3〕。研究发现,胰腺泡细胞损伤是胰腺炎发生和发展中发挥重要作用〔4,5〕,因此,减轻胰腺泡细胞损伤对治疗胰腺炎具有重要的意义。大黄免煎颗粒在治疗重症胰腺炎方面历史悠久〔6~8〕,但其对胰腺泡细胞损伤作用机制尚待研究。大量研究表明,miRNAs在多种疾病的发生发展中扮演着重要的角色,如miR-23b〔9〕、miR-25-3p〔10〕、miR-135a〔11〕和miR-140-5p〔12〕等miRNAs通过调控下游蛋白对多种疾病关键细胞的增殖和凋亡具有重要的调控作用。本研究探讨大黄免煎颗粒通过miRNAs调控下游蛋白对胰腺泡细胞损伤的作用机制。
1 材料与方法
1.1细胞株及主要试剂 大鼠胰腺泡细胞AR42J购于美国ATCC。DMEM培养基、牛胆酸钠、青霉素-链霉素溶液和胎牛血清购于美国Sigma公司;各引物序列、miR-135a mimics/inhibitor和pcDNA-FAM129A由中国Biomics Biotech公司设计和合成;Trizol、反转录试剂盒和实时定量PCR试剂盒购于美国Amresco公司;二喹啉甲酸(BCA)试剂盒及RIPA裂解液购自中国beyotime公司;脂质体2000转染试剂盒、脂肪酶及淀粉酶试剂盒购于法国EP公司;CCK-8试剂盒和膜联蛋白(Annexin) V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)试剂盒购于美国BD公司。FAM129A一抗及二抗购于美国CST公司。
1.2细胞培养及转染 将大鼠胰腺泡细胞AR42J培养于含1%青霉素-链霉素溶液和10%胎牛血清的DMEM培养基中,并放于37℃、5%条件下的培养箱中培养。细胞融合率为85%时进行传代。将AR42J细胞随机分为空白对照(NC)组、模型(Model)组、大黄免煎颗粒(DHG)组、miR-135a抑制物(miR-135a inhibitor)组、过表达FAM129A(pcDNA-FAM129A)组及miR-135a模拟物+过表达FAM129A(miR-135a mimic+pcDNA-FAM129A)组。NC组为空白对照;Model组用500 μmol/L牛胆酸钠处理;DHG组用500 μmol/L牛胆酸钠和1.25 μmol/L大黄免煎颗粒处理;miR-135a inhibitor用500 μmol/L牛胆酸钠、1.25 μmol/L大黄免煎颗粒和转染miR-135a inhibitor处理;pcDNA-FAM129A组用500 μmol/L牛胆酸钠、1.25 μmol/L大黄免煎颗粒和转染pcDNA-FAM129A处理;miR-135a mimic+pcDNA-FAM129A组用500 μmol/L牛胆酸钠、1.25 μmol/L大黄免煎颗粒及转染miR-135a mimic和pcDNA-FAM129A处理。细胞转染过程参考脂质体2000转染试剂盒。
1.3RT-qPCR检测AR42J细胞及损伤模型中miRNAs的表达水平 取NC组、Model组、DHG组、miR-135a inhibitor组中处于对数生长期的AR42J细胞,Trizol溶液提取AR42J细胞总RNA,定量分析后,参考反转录试剂盒将总RNA反转录为cDNA。然后以U6为内参,进行实时定量PCR试剂盒进行miRNAs的定量分析,引物U6正义:5′-CTCGCTTCGGCAGCACA-3′、反义:5′-AACGCTTCACGAAT-TTGCGT-3′;miR-23b正义:5′-GGGTTCCTGGCATGCTGATT-3′、反义:5′-TCGTGGTTGCGTGGTAATCC-3′;miR-25-3p正义:5′-TGTTGAGAGGCGGAGACTTG-3′,反义:5′-GCACTGTCAGACCGAGACAA-3′;miR-135a正义:5′-AGCTGTCGTGTCTTATGGCT-3′,反义:5′-TGACTGCGTGTTTAGTGGC-3′;miR-140-5p正义:5′-TCTGTGTCCTGCCAGTGGTT-3′、反义:5′-CCAGTATCCTGTCCGTGGTTC-3′。qPCR体系:10 μl TB Green Premix Ex Taq Ⅱ,各0.8 μl PCR正反引物,0.4 μl ROX Reference Dye,2 μl DNA模板及6 μl H2O2。qPCR条件:95℃ 5 min,94℃变性30 s,60℃退火30 s,进行35个循环。实验结果采用2-ΔΔCt法进行计算。
1.4Western印迹检测各组AR42J细胞中FAM129A的表达水平 取Model组、pcDNA-FAM129A组及miR-135a mimic+pcDNA-FAM129A组中处于对数生长期的AR42J细胞,冰上通过RIPA裂解液裂解后,BCA试剂盒进行蛋白定量分析。进行10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳3 h后,半干转膜法转印至聚偏二氟乙烯膜上,用含5%脱脂牛奶的TTBS封闭1 h后,加入FAM129A一抗(1∶10 00),4℃孵育过夜,洗涤4次,加入FAM129A二抗(1∶2 000),再次洗涤4次,加入电化学发光(ECL)底物,在GIS凝胶成像系统中显影并拍照,用Image J进行条带灰度值分析。
1.5双荧光素酶报告基因验证miR-135a和FAM129A的靶向关系 采用Starbase生物信息学数据库(http://www.starbase.sysu.edu.cn/)预测miR-135a和FAM129A潜在结合区域。将WT-FAM129A-3′-UTR和MUT-FAM129A-3′-UTR区域构建至pGLO-basic载体萤火虫荧光素酶基因下游,然后分别与miR-NC和miR-135a inhibitor共转染入至293T细胞中。在37℃、5% CO2培养箱培养8 h,用含10%胎牛血清的DMEM培养基培养48 h后,收集细胞,参考双荧光素酶试剂盒说明书,以海肾荧光值作为内参,采用酶标仪检测荧光素酶活性。
1.6CCK-8检测各组AR42J细胞活力 取NC组、Model组、DHG组、miR-135a inhibitor组、pcDNA-FAM129A组及miR-135a mimic+pcDNA-FAM129A组中对数生长期AR42J细胞种于96孔板中(5×103个/孔),并置于37℃、5% CO2培养箱培养24 h后,每孔加入10 μl CCK-8溶液,培养箱孵育2 h,然后使用酶标仪在450 nm处测定OD值,并利用各时间点的测定OD值绘制细胞增殖曲线。
1.7Annexin V-FITC/PI检测各组AR42J细胞凋亡水平 用预冷的PBS重悬NC组、Model组、DHG组、miR-135a inhibitor组、pcDNA-FAM129A组及miR-135a mimic+pcDNA-FAM129A组中对数生长期AR42J细胞,2 000 r/min离心10 min,并洗涤细胞,加入300 μl去离子水稀释的1×结合缓冲液,再加入5 μl Annexin V-FITC和500 μl预冷缓冲液,室温避光孵育15 min,然后加入2.5 μl PI,最后补加200 μl的1×结合缓冲液上机检测细胞凋亡情况。
1.8脂肪酶和淀粉酶试剂盒检测脂肪酶和淀粉酶活性 脂肪酶和淀粉酶试剂盒利用耦联酶促反应来检测NC组、Model组、DHG组、miR-135a inhibitor组、pcDNA-FAM129A组及miR-135a mimic+pcDNA-FAM129A组中对数生长期AR42J细胞中脂肪酶及淀粉酶活性。脂肪酶在波长为570 nm处进行比色,淀粉酶在波长为405 nm处进行比色,步骤参考脂肪酶和淀粉酶试剂盒说明书。
1.9统计学方法 采用SPSS20.0统计学软件进行t检验,单因素方差分析。相关图片采用Graphpad 8.0软件进行绘制。
2 结 果
2.1牛胆酸钠构建胰腺泡细胞损伤模型 采用梯度浓度牛胆酸钠处理大鼠胰腺泡细胞AR42J,CCK-8结果显示,随着牛胆酸钠处理浓度(50,100,200,400,800,1 600,3 200,6 400 μmol/L)的上升,AR42J细胞活力抑制率〔(17.12±2.21)%;(20.87±3.04)%;(32.26±3.91)%;(42.96±4.53)%;(64.18±6.09)%;(80.13±7.05)%;(86.18±7.86)%;(90.75±6.02)%〕显著上调,且牛胆酸钠的半抑制浓度(IC50)为522.8 μmol/L。故后续试验采取500 μmol/L处理AR42J细胞作为大鼠胰腺泡细胞损伤模型,并设为Model组。
2.2miR-135a在胰腺泡细胞损伤模型中异常高表达,且大黄免煎颗粒能抑制其表达 RT-qPCR结果显示,Model组中miR-23b、miR-25-3p、miR-135a及miR-140-5p的表达水平显著高于NC组(P<0.05);且Model组中miR-135a的表达水平显著高于miR-23b、miR-25-3p及miR-140-5p的表达水平(P<0.05),见表1。此外,后续试验探讨了大黄免煎颗粒对Model组中miR-135a表达水平的影响,NC组miR-135a表达为(0.99±0.07),Model组(0 μmol/L大黄免煎颗粒)miR-135a表达为(1.86±0.05),DHG组(0.25、0.50、1.25、2.50、5.00 μmol/L大黄免煎颗粒)miR-135a表达分别为(1.74±0.06,1.43±0.03,1.05±0.04,0.64±0.04,0.40±0.03),结果表明,DHG组大黄免煎颗粒能显著抑制Model组中miR-135a的表达水平(P<0.05);且当DHG组中大黄免煎颗粒处理浓度为1.25 μmol/L时,miR-135a的表达水平与NC组无显著性差异。提示胰腺泡细胞损伤模型中,miR-135a异常高表达,且大黄免煎颗粒能够抑制胰腺泡细胞损伤模型中miR-135a表达。
2.3大黄免煎颗粒通过miR-135a对胰腺泡细胞模型损伤的影响 RT-qPCR结果显示,Model组中miR-135a的表达水平显著高于NC组、DHG组及miR-135a inhibitor组(P<0.05);DHG组miR-135a的表达水平显著高于miR-135a inhibitor组(P<0.05),且与NC组无显著性差异(P>0.05);miR-135a inhibitor组miR-135a的表达水平显著低于NC组(P<0.05)。CCK-8结果显示,Model组中AR42J细胞活力显著低于NC组、DHG组及miR-135a inhibitor组(P<0.05);DHG组AR42J细胞活力显著低于miR-135a inhibitor组(P<0.05),且与NC组无显著性差异(P>0.05);miR-135a inhibitor组AR42J细胞活力显著高于NC组(P<0.05)。Annexin V-FITC/PI及脂肪酶和淀粉酶试剂盒结果显示,Model组中AR42J细胞凋亡及脂肪酶和淀粉酶水平显著高于NC组、DHG组及miR-135a inhibitor组(P<0.05);DHG组AR42J细胞凋亡及脂肪酶和淀粉酶水平显著高于miR-135a inhibitor组(P<0.05),且与NC组无显著性差异(P>0.05);miR-135a inhibitor组AR42J细胞凋亡及脂肪酶和淀粉酶水平显著低于NC组(P<0.05),见表2和图1。由以上结果可知,大黄免煎颗粒通过抑制胰腺泡细胞损伤模型中miR-135a的表达水平,从而促进AR42J细胞损伤模型增殖,并抑制其凋亡及脂肪酶和淀粉酶水平,进而缓解AR42J细胞的损伤。

表1 miR-140-5p胰腺泡细胞损伤模型细胞中miRNA的相对表达

表2 miR-135a对胰腺泡细胞模型损伤细胞的功能影响
2.4miR-135a和FAM129A的靶向关系验证 通过生物信息学数据库Strabase预测miR-135a的潜在靶基因,结果显示,FAM129A是miR-135a的潜在靶基因,两者潜在靶向序列见图2A。此外,双荧光素酶报告基因结果显示,miR-135a mimic能够显著抑制野生型FAM129A载体的荧光素酶活性(P<0.05),见表3,且对突变型FAM129A载体的荧光素酶活性无显著抑制作用。进一步,Western印迹结果显示,miR-135a mimic组中FAM129A蛋白的表达水平显著低于NC组(P<0.01),见图2B。由以上实验结果可知,FAM129A是miR-135a的靶基因,且miR-135a靶向负调控FAM129A蛋白的表达水平。
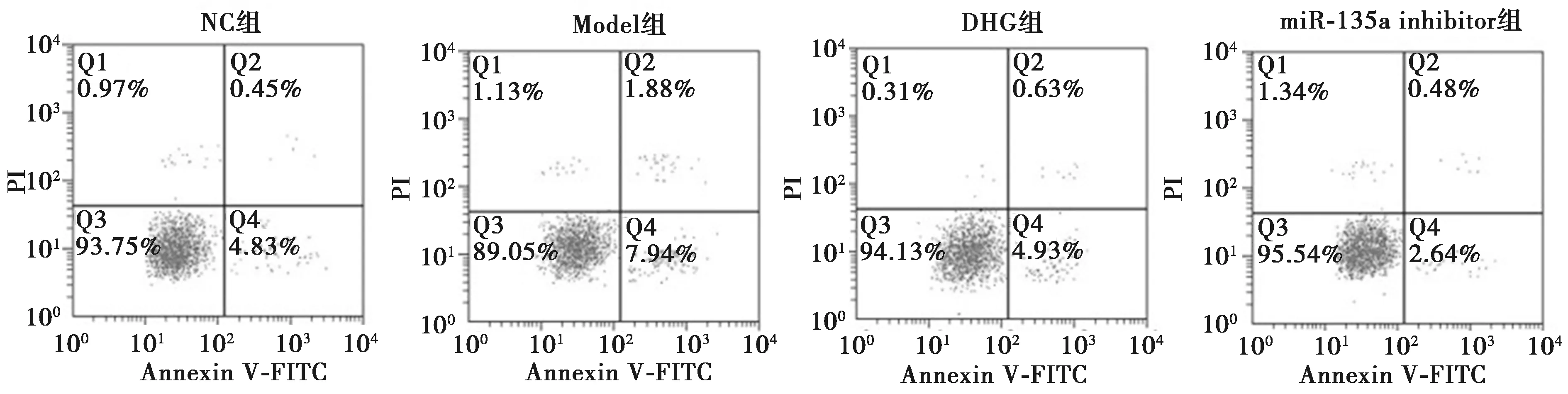
图1 miR-135a对胰腺泡细胞模型损伤细胞的凋亡影响

表3 双荧光素酶报告基因实验验证miR-135a和FAM129A的靶向关系
2.5大黄免煎颗粒通过miR-135a/FAM129A分子轴对胰腺泡细胞模型损伤的影响 Western印迹结果显示,pcDNA-FAM129A组中FAM129A蛋白的表达水平显著高于DHG组和miR-135a mimic+pcDNA-FAM129A组(P<0.05),见图3;且DHG组与miR-135a mimic+pcDNA-FAM129A组无显著性差异。CCK-8结果显示,pcDNA-FAM129A组中AR42J细胞活力显著高于DHG组和miR-135a mimic+pcDNA-FAM129A组(P<0.05);且DHG组与miR-135a mimic+pcDNA-FAM129A组无显著性差异。Annexin V-FITC/PI及脂肪酶和淀粉酶试剂盒结果显示,pcDNA-FAM129A组中AR42J细胞凋亡及脂肪酶和淀粉酶水平显著低于DHG组和miR-135a mimic+pcDNA-FAM129A组(P<0.05);且DHG组与miR-135a mimic+pcDNA-FAM129A组无显著性差异,见表4和图4。由以上实验结果可知,大黄免煎颗粒通过抑制miR-135a上调FAM129A蛋白的表达水平,从而促进AR42J细胞损伤模型增殖,并抑制其凋亡及脂肪酶和淀粉酶水平,进而缓解AR42J细胞的损伤。

图2 miR-135a和FAM129A的靶向关系

1~3:DHC组,pcDNA-FAM129A组,miR-135a mimic+pcDNA-FAM129A组图3 3组FAM129A表达

表4 miR-135a/FAM129A分子轴对胰腺泡细胞模型损伤细胞的功能影响

图4 miR-135a/FAM129A分子轴对胰腺泡细胞模型损伤细胞FAM129A蛋白和凋亡率的影响
3 讨 论
胰腺炎前中期是自限性的,中度的疾病,多数患者经过胃肠减压、手术清除坏死胰腺组织等治疗方法均可痊愈,但是在临床上胰腺炎易发为重症胰腺炎,并进一步发展为胰腺癌,因此在外科中一直是危重症〔13〕。胰腺炎病理特征表现为胰蛋白酶异常激活,其会引起急性炎症反应并导致胰腺损伤,且进一步会导致全身炎症反应及多器官功能障碍综合征〔14〕。研究表明,在胰腺炎中,胰腺泡细胞增殖活力降低和凋亡水平的升高等损伤生物学行为会加重胰腺炎病情〔15〕,因此,探讨缓解胰腺泡细胞的损伤是胰腺炎治疗的理想途径之一。大黄免煎颗粒性味寒苦,具有泻火清热、祛瘀活血、泻下攻积和解毒清热等功效,在治疗急性重症胰腺炎具有预后良好的疗效。研究表明〔16〕,采用大黄免煎颗粒中的主要成分大黄治疗重症胰腺炎患者,能有效降低患者体内促炎细胞因子水平,从而减轻炎性反应程度,进而缓解或消除重症胰腺炎患者继发感染。但是大黄免煎颗粒对胰腺泡细胞损伤的作用机制尚待研究,本研究发现,大黄免煎颗粒能有效促进胰腺泡细胞增殖并抑制其凋亡及脂肪酶和淀粉酶水平,从而缓解胰腺泡细胞损伤。此外,还发现其能抑制胰腺泡细胞损伤模型中异常高表达miR-135a水平。
miRNAs由内源基因编码的非编码单链RNA分子,它们通过转录后基因表达的调控〔17〕。研究表明,多种miRNAs对胰腺炎的发生发展中起到重要的调控作用。例如,Wen等〔18〕发现,miR-374a-5p在胰腺炎胰腺泡细胞中表达明显下调,其通过调节肌酸激酶(NCK)1和基质金属蛋白酶(MMP)14表达介导核转录因子(NF)-κB和p38信号通路参与早期胰腺炎的发展进程;Wan等〔19〕发现,miR-155通过抑制3-MA表达介导自噬功能受损,从而促进胰蛋白酶激活,腺泡细胞异常分泌和坏死,进而推进胰腺炎进程。本研究发现,胰腺泡细胞损伤模型较正常胰腺泡细胞中miR-135a异常高表达,且敲降miR-135a能够缓解牛胆酸钠诱导的胰腺泡细胞损伤。此外,通过生物信息学数据库和双荧光素酶报告基因实验证实,FAM129A是miR-135a的靶基因,且miR-135a靶向负调控FAM129A蛋白的表达水平。
细胞凋亡调节因子(NIBAN1/FAM129A)调控包括EIF2A、EIF4EBP1和RPS6KB1在内的一系列参与翻译调控的蛋白的磷酸化,进而参与内质网应激反应和p53通路介导的细胞凋亡。研究发现,FAM129A通过促进FAK的磷酸化,从而上调MMP2和细胞周期蛋白(Cyclin)D1的表达水平,进而促进非小细胞肺癌细胞的增殖和的侵袭〔20〕;此外,Zhang等〔21〕发现,上调FAM129A蛋白表达水平能抑制雨蛙肽诱导的胰腺炎模型促炎症细胞因子的表达。本研究发现,过表达FAM129A促进胰腺泡细胞损伤模型增殖并抑制其凋亡及脂肪酶和淀粉酶水平,从而缓解胰腺泡细胞损伤。
综上,大黄免煎颗粒通过抑制miR-135a表达上调FAM129A蛋白的表达水平,从而促进AR42J细胞损伤模型增殖,并抑制其凋亡及脂肪酶和淀粉酶水平,进而缓解AR42J细胞的损伤,进一步缓解胰腺炎的发展进程。

