基于蛋氨酸代谢调控的内源性抗氧化分子机制
王正旋,杨 林
(哈尔滨工业大学 化工与化学学院,哈尔滨 150001)
蛋氨酸是一种常见的含硫氨基酸(Sulfur-containing amino acids, SAAs),具有内源性抗氧化功能,能够有效清除体内活性氧(Reactive oxygen species, ROS)蓄积,缓解氧化应激(Oxidative stress)[1]。目前国内外对于蛋氨酸抗氧化作用多集中报道蛋氨酸代谢调控GSH合成方面,并且缺乏对蛋氨酸代谢调控抗氧化作用的全面报道。因此本综述主要集中在蛋氨酸抗氧化功能方面,综合目前有关蛋氨酸抗氧化方面的报道,较为系统、全面地总结了基于蛋氨酸代谢调控的抗氧化分子机制,为蛋氨酸应用提供了新的视角。
ROS是机体在正常代谢过程中形成的一种非常短暂的物质,能够被身体内抗氧化系统有效清除。然而过量的ROS会引起氧化应激,进而引起DNA、脂质和蛋白损伤,导致心血管疾病及癌症等多种疾病[1-3]。因此,抑制ROS引起的氧化应激是一种预防疾病的有效途径。机体为防止ROS蓄积产生了一套内源性抗氧化防御体系,如核因子E2-相关因子2(Nuclear factor-erythroid 2-related factor 2, Nrf2)抗氧化体系、蛋氨酸亚砜还原酶(Methionine sulfoxide reductase, MSR)抗氧化系统以及谷胱甘肽(Glutathione, GSH)合成与代谢等,有效地改善机体氧化应激状态,维持体内氧化还原状态稳定[4-5]。
1 蛋氨酸的结构与功能
蛋氨酸作为常见的含硫氨基酸之一,是真核生物蛋白质合成的起始氨基酸,在蛋白质的结构和新陈代谢中都发挥着独特的作用[6]。从蛋氨酸的分子结构可知,蛋氨酸含有与硫原子共价键合的甲基[7]。甲基和硫基对蛋氨酸结构特征和代谢功能至关重要。
首先,蛋氨酸在蛋白质的结构与功能中发挥重要作用[8]。其作用主要包括三个方面:疏水性作用、硫的氧化作用和蛋白质合成作用。蛋氨酸由于侧链末端含有甲基,因此具有高疏水性,是最疏水的氨基酸之一。对于球状蛋白质而言,虽然有超过三分之二的蛋氨酸残基被埋在蛋白质的疏水内部,但仍有将近三分之一的蛋氨酸残基可能存在于蛋白质表面。这些表面蛋氨酸残基一般聚集在蛋白质活性部位,保护其免受ROS攻击[9]。研究表明,蛋氨酸的疏水性在氨基酰-tRNA(transfer RNA, tRNA)与小亚基结合的过程中发挥至关重要的作用。
其次,蛋氨酸在蛋白质合成起始阶段具有独特的作用。蛋氨酸是真核生物蛋白质合成的起始氨基酸,并且蛋氨酸衍生物N-甲酰基蛋氨酸在原核生物中具有同样的功能。然而随着蛋白质翻译的进行,这些蛋氨酸残基大部分随后被移除,表明蛋氨酸是在翻译的起始阶段发挥作用,而不是在蛋白质结构中[7]。
2 蛋氨酸代谢
蛋氨酸代谢包含转甲基化、再甲基化和转硫化。转甲基化涉及通过甲硫氨酸腺苷转移酶将甲硫氨酸活化成S-腺苷甲硫氨酸,然后通过甲基转移酶(Methionine adenosyltransferase, MAT)转移S-腺苷甲硫氨酸甲基,最后通过将S-腺苷高半胱氨酸可逆水解成腺苷和同型半胱氨酸完成了转甲基化[7, 10]。
2.1 蛋氨酸转硫途径
蛋氨酸的分解代谢主要通过转硫途径来实现。蛋氨酸在蛋氨酸腺苷转移酶和S-腺苷同型半胱氨酸水解酶(S-Adenosyl-L-HomocysteineHydrolase, SAHH)作用下转化成同型半胱氨酸,随后在半胱氨酸β-合酶(Cystathionine beta-synthase, CBS)的催化下,同型半胱氨酸与丝氨酸(Serine, Ser)缩合生成胱硫醚(Cystathionine)[11]。然后胱硫醚在半胱氨酸裂解酶(Cystathionine in cysteine lyase, CTH)的催化下被裂解成半胱氨酸(Cysteine, Cys)、α-酮丁酸酯(α-ketobutyrate)和氨(Ammonia)。蛋氨酸经转硫途径转化成半胱氨酸的过程(见图1)。

图1 蛋氨酸经转硫途径转化成半胱氨酸的过程
同型半胱氨酸转化为半胱氨酸是不可逆的[11-12]。因此,蛋氨酸可以转化为半胱氨酸,但半胱氨酸不能转化为蛋氨酸。这与营养学观察结果相符,即在蛋氨酸摄入的情况下,半胱氨酸是一种可有可无的氨基酸,然而半胱氨酸摄入不能弥补蛋氨酸缺乏。因此转硫途径在为GSH合成提供半胱氨酸方面发挥着特别重要的作用[12]。
2.2 蛋氨酸代谢调控
蛋氨酸的代谢调控是复杂的。首先,同型半胱氨酸在再甲基化和转硫化之间的分配至关重要,而Mudd的经典平衡研究表明,同型半胱氨酸再甲基化与转硫之间的平衡取决于甲基的可用性[12]。当摄入含少量甲基基团的饮食时,同型半胱氨酸倾向于被再甲基化,而不是被分解代谢;而当摄入含过量甲基的饮食时,同型半胱氨酸倾向于转硫化,进一步分解代谢。以上的这种代谢转换可能是由S-腺苷蛋氨酸通过变构机制进行调控的。首先,蛋氨酸腺苷转移酶的肝亚型具有异常的反馈激活特性,该酶可被S-腺苷甲硫氨酸激活,这确保了在蛋氨酸供应充足的情况下促进肝脏S-腺苷甲硫氨酸生成;其次,S-腺苷蛋氨酸既可作为胱硫醚β-合酶的变构激活剂,又可作为亚甲基四氢叶酸还原酶的变构抑制剂[13]。因此,补充蛋氨酸可以促进转硫途径,并且抑制再甲基化。
另外,蛋氨酸代谢可以通过氧化应激进行调控。研究表明,转硫途径在产生半胱氨酸以用于合成GSH的过程中起着重要调控作用。肝脏中的氧化应激可促进蛋氨酸的转硫作用以及促进谷胱甘肽合成,这可能是由于胱硫醚β-合酶中血红素修复基团的氧化还原状态改变而引起[10]。
3 蛋氨酸抗氧化功能
蛋氨酸是一种含硫的必需氨基酸,在参与蛋白质合成的同时,也是GSH合成原料半胱氨酸的主要来源。研究表明,蛋氨酸在体内具有抑制ROS,调控抗氧化防御体系以保护机体免受氧化损伤的作用[8]。
3.1 蛋氨酸与蛋氨酸亚砜还原酶抗氧化系统
研究表明,蛋白质表面许多氨基酸残基易受ROS所氧化,并且这种氧化修饰的蛋白质会在氧化应激或衰老中逐渐积累[8]。蛋氨酸残基和半胱氨酸残基对ROS特别敏感,极易被ROS氧化成蛋氨酸亚砜(Methionine sulfoxide, MetO)。然而蛋氨酸残基的氧化是可逆的,可以被特异性的蛋氨酸亚砜还原酶还原成蛋氨酸[8, 14]。
蛋氨酸亚砜还原酶体系主要由蛋氨酸亚砜还原酶组成,其中包括蛋氨酸亚砜还原酶A(Methionine sulfoxide reductase, MsrA)和蛋氨酸亚砜还原酶B(Methionine sulfoxide reductase, MsrB)[15]。在蛋氨酸被ROS氧化过程中,Met的硫原子与氧结合形成MetO。由于硫原子为手性中心,因此存在两个MetO差向异构体:R-MetO和S-MetO。在MsrA的催化下,S-MetO被特异性还原成蛋氨酸,而R-MetO则不受影响,相反在MsrB的催化下,R-MetO被特异性还原成蛋氨酸,而S-MetO则不受影响[7]。在蛋氨酸亚砜还原酶的催化下,被ROS氧化的MetO又可被烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate, NADPH)还原为Met。,因此Met与MetO之间形成了氧化还原反应循环,并且在每一个循环中,都会消耗等量的ROS,进而有效地清除体内ROS,减少氧化应激产物如丙二醛及蛋白质羰基等的产生,降低体内氧化应激水平[16-17]。
虽然MsrA和MsrB具有相同的亚硫氨酸还原功能,但它们在底物特异性、活性位点组成、亚细胞定位和进化等方面存在差异。MsrA存在于线粒体、胞质和细胞核中,在肝脏内表达丰富。相反,MsrB2和MsrB3主要在非肝组织中表达,其中MsrB2存在于线粒体中,而MsrB3定位于内质网和线粒体中[15]。此外,MsrA和MsrB在还原游离的蛋氨酸亚砜过程中具有完全不同的催化性能,其中MsrA催化S-MetO还原的效率要比MsrB催化R-MetO还原的效率高1000倍,表明MsrA可能在MSR抗氧化体系中起主导作用。已有研究表明,补充膳食蛋氨酸,可以促进MSR表达,进而减少ROS蓄积[18]。
3.2 蛋氨酸促进GSH合成
谷胱甘肽(GSH)是最为重要且分布最广、含量最多的内源性非酶类抗氧化物质。GSH是一种三肽,其全名为γ-L-谷氨酰基-L-半胱氨酰甘氨酸,存在于所有哺乳动物组织中,是含量最丰富的非蛋白质硫醇,可以保护身体免受氧化应激[11]。GSH作为氧化还原信号传导的关键决定因素,在外源性生物的解毒过程中起重要作用。GSH的抗氧化功能主要由谷胱甘肽过氧化物酶(Glutathione peroxidase, GPx)催化的反应完成。当GSH被氧化成氧化型谷胱甘肽(GSSG)时,会减少过氧化氢和脂质过氧化物等氧化物,而GSSG则通过GSSG还原酶在NADPH的作用下还原为GSH,因此GSH与GSSG之间形成了氧化还原循环,其可直接或间接地清除体内活性氧ROS,消除机体内脂质过氧化物等有害代谢成分以及阻止机体内各类生物分子的氧化[19]。
GSH合成分为两个过程,首先是Cys和谷氨酸(Glutamicacid, Glu)在GCL的催化下形成γ-谷氨酰半胱氨酸,随后在GSH合成酶(Glutathione synthase, GS)的作用,γ-谷氨酰半胱氨酸和Gly合成GSH。研究表明,GCL作为GSH合成中的第一限速酶,其活性的高低对GSH合成速率具有决定性作用,然而GCL的活性又受到Cys水平的调控,即高水平Cys可以提高GCL活性,促进GSH合成。蛋氨酸通过转硫途径转化成Cys,可以提高GCL活性,促进GSH合成,因此补充蛋氨酸在提高Cys水平的同时,也刺激了GCL活性,促使更多GSH的合成,进而提高了机体抗氧化能力[7]。蛋氨酸促进GSH合成的过程(见图2)。
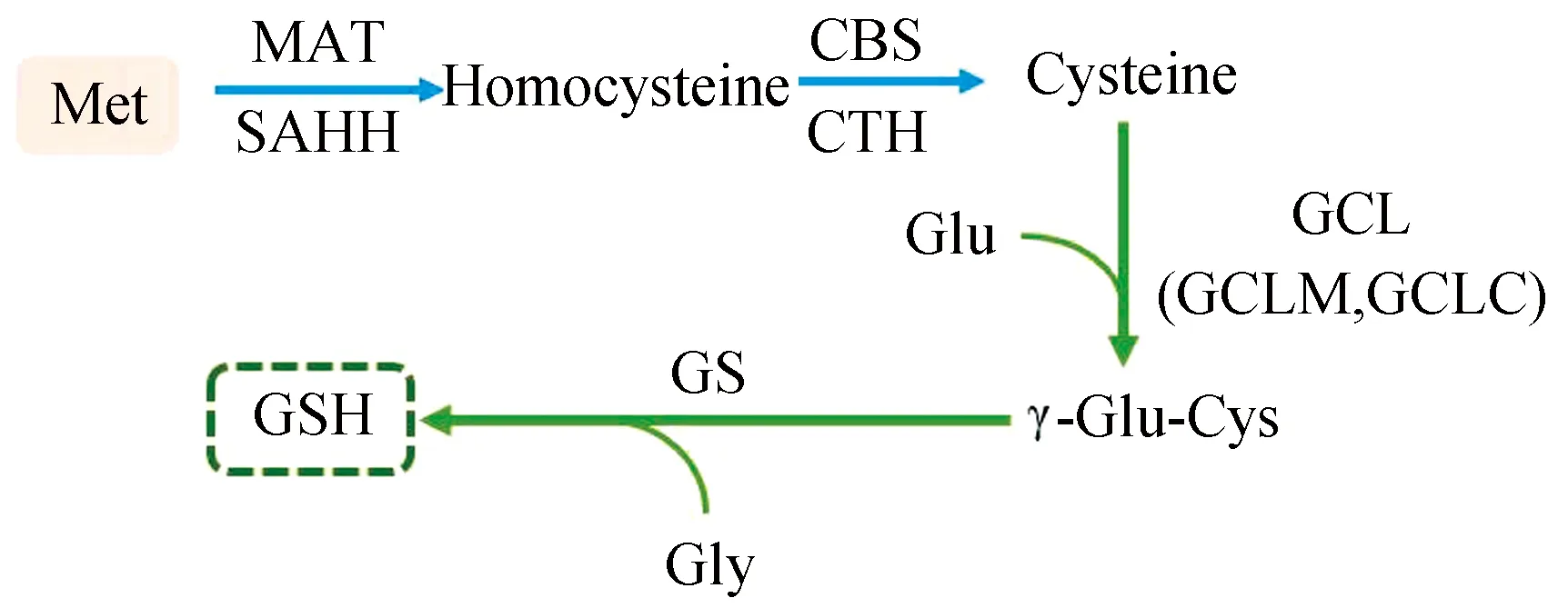
图2 蛋氨酸促进GSH合成的过程
3.3 蛋氨酸与Nrf2抗氧化系统
Nrf2是细胞氧化应激反应中的关键因子,是细胞抗氧化还原的中枢调节者。Nrf2通过与抗氧化反应元件(Antioxidant response element, ARE)相互作用,激活抗氧化酶和相关解毒酶的表达,在细胞的防御保护中发挥重要作用。
Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1, Keap1)是基于泛素连接酶Cullin 3(Ubiquitin Ligase Cullin 3, Cul3)的衔接子亚基,能够调节Nrf2活性。在无应激条件下,Keap1与细胞质中的Nrf2结合,促进Nrf2泛素化和蛋白酶体降解。当暴露在化学物质(通常是亲电的)或活性氧(ROS)时,Keap1/Cul3复合物的泛素E3连接酶活性下降,Nrf2变得稳定。随后稳定的Nrf2在细胞核中积累并促进下游抗氧化酶、GSH合成和代谢相关酶以及转运蛋白等基因的表达。研究表明,由于Keap1保留多个半胱氨酸残基传感器,可检测各种应激刺激,因此Keap1还可作为氧化和亲电应激的传感器[20]。
Nrf2通过与ARE的相互作用来促进下游抗氧化蛋白和II相解毒酶的表达,是迄今为止发现的最为重要的内源性抗氧化通路。受Nrf2与ARE相互作用调节的抗氧化酶主要包括γ-谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthetase, γ-GCS)、过氧化氢酶(Catalase, CAT)超氧化物歧化酶(Superoxide Dismutase, SOD)、血红素氧合酶(Heme oxygenase-1, HO-1)等,而II相解毒酶主要包含谷胱甘肽S转移酶(Glutathione-S-transferases, GST)、醌氧化还原酶1(NAD(P)H-quinone oxidoreductase l, NQO1)等[5]。
研究表明,蛋氨酸对Nrf2-ARE通路激活具有促进作用[20]。作为氧化应激的传感器,Nrf2通过激活和上调受ARE驱动的解毒和抗氧化分子的表达,严格调节内源性抗氧化防御系统。蛋氨酸通过激活Nrf2通路,从而有效提高CAT、SOD、HO-1和GPx的活性和表达。此外,Nrf2的激活上调了GCLC、GCLM和GS表达,从而进一步刺激内源性谷胱甘肽合成。Lu等[19]在利用microRNA调节蛋氨酸代谢的过程中发现,Nrf2通路对转硫途径促进GSH合成具有重要调控作用。蛋氨酸是激活Nrf2-ARE通路,刺激GSH合成以抑制ROS产生氧化应激的关键因素。
3.4 蛋氨酸代谢对Nrf2激活与MSR表达的影响
研究表明,蛋氨酸能够激活Nrf2-ARE抗氧化通路[21]。由于Nrf2-ARE通路的激活通常意味着氧化还原失衡的发生,因此添加蛋氨酸显而易见地影响了氧化还原环境。由于补充蛋氨酸能够刺激MsrA和MsrB的分子表达,这意味着补充的蛋氨酸容易被ROS氧化,导致蛋氨酸亚砜水平上升,而蛋氨酸亚砜可能作为一种促氧化剂激活内源性抗氧化防御系统。而Wang等的研究中,MsrA、MsrB2和MsrB3分子表达水平与Nrf2核含量之间分别呈显著正相关,正好验证了该观点[21]。因此,Nrf2的激活可能是刺激MSR表达的一个开关。
另一方面,作为蛋氨酸代谢物,同型半胱氨酸可能参与Nrf2-ARE通路的激活,因此同型半胱氨酸在再甲基化和转硫之间的分配很关键。有研究表明,补充蛋氨酸能够促进转硫作用,抑制再甲基化的发生。转硫途径的缺失会导致细胞氧化还原稳态失衡以及GSH产生减少。在转硫途径中,CBS和CTH催化高半胱氨酸转化成半胱氨酸的过程会产生硫化氢(H2S),而H2S除了本身具有抗氧化作用外,还可以通过提高Keap1的硫巯基化水平,减弱Keap1对Nrf2的抑制作用,促使Nrf2移至细胞核中,激活Nrf2-ARE通路[20]。补充蛋氨酸可有效地刺激CBS和CTH的表达,促进同型半胱氨酸不可逆反应生成半胱氨酸以用于合成GSH或H2S[20-21]。因此蛋氨酸可以通过转硫途径产生的H2S激活Nrf2-ARE通路。
蛋氨酸代谢是复杂的,虽然本综述总结了基于蛋氨酸代谢调控的三种内源性抗氧化机制,但是关于基于蛋氨酸代谢调控的更全面及更深入的抗氧化机制还有待研究。随着科技的发展,生物信息大数据的挖掘为蛋氨酸代谢的深入研究提供了新的研究角度及研究方法[22]。在基因组学和蛋白质组学的基础上,采用代谢组学的方法对蛋氨酸代谢进行深入研究,弄清楚蛋氨酸代谢路径及其产物对抗氧化通路的影响,最后以组群指标分析为基础,以高通量检测和数据处理为手段,以信息建模与系统整合为目的,对蛋氨酸代谢调控的抗氧化基因和相关蛋白的分析与归纳,从而更全面及更深入地理解蛋氨酸代谢影响的抗氧化分子机制,为蛋氨酸的应用及开发提供切实可行的理论依据[23-24]。
综上所述,蛋氨酸抗氧化分子机制(见图3):(1)蛋氨酸可以通过转硫途径,在MAT、SAHH、CBS和CTH的作用下,生成半胱氨酸,进而促进GSH的合成;(2)蛋氨酸被ROS氧化成蛋氨酸亚砜后,在蛋氨酸亚砜还原酶(MsrBs或MsrA)作用下又被还原成蛋氨酸,蛋氨酸与蛋氨酸亚砜形成的氧化还原循环可以直接消耗ROS;(3)蛋氨酸可以刺激Nrf2通路,进而增加Nrf2/ARE调控的下游抗氧化相关基因的表达,进一步发挥抗氧化作用。
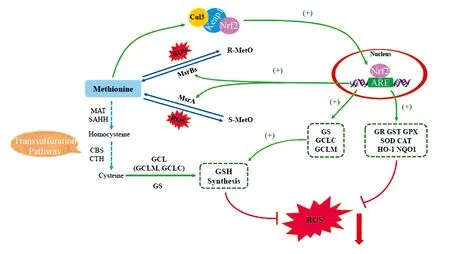
图3 蛋氨酸抗氧化的分子调控通路
4 结论及展望
从蛋氨酸结构及其代谢出发,探究了蛋氨酸对激活蛋氨酸亚砜还原酶系统、促进GSH合成以及激活Nrf2抗氧化通路的调控作用。蛋氨酸通过自身氧化还原反应提高MSR表达,同时在转硫途径作用下转化成Cys促进GSH合成,而蛋氨酸转硫代谢产物能够激活Nrf2抗氧化通路,进而提高GCL、GS以及MSR表达,进一步增强内源性抗氧化作用。对蛋氨酸抗氧化的分子调控机制进行了一定的综述,为全面了解蛋氨酸在抗氧化方面的作用提供了一定的理论基础。然而关于蛋氨酸抗氧化的精确分子机制需要更加深入研究,可以采用生物信息学的方法,通过分析和整理基于蛋氨酸代谢调控的抗氧化基因与蛋白,从而更全面及更深入地探究基于蛋氨酸代谢调控的内源性抗氧化分子机制。

