DNA甲基化在癌症预防与治疗中的研究进展
★ 罗黎明 刘志勇(江西中医药大学 南昌 330004)
世界卫生组织在2019年提出癌症是导致人类死亡的第1或第2大因素,国际癌症研究机构编制的GLOBOCAN显示,癌症的诊断和治疗受到新冠的影响,2021年全球估计有1 929万例新癌症病例和995.8万例癌症死亡[1-2]。以往研究癌症的发生机制主要着眼于基因突变、缺失等DNA序列改变,从而导致癌基因和抑癌基因进一步激活或者失活。科研工作者在不断研究攻克癌症的过程中,发现DNA序列的改变可癌症的发生,非传统遗传的表观遗传调控也同样在癌症发生发展中发挥关键作用。本文主要以表观遗传修饰之DNA甲基化为靶点,简单总结其在癌症发生发展中的作用和中药抗肿瘤的去甲基化作用。
1 DNA甲基化
早在1983年,有研究发现与正常组织相比,人类结肠癌细胞中特定基因的DNA甲基化减少。同年,另有研究报道癌细胞全基因组范围的DNA甲基化中间产物5-甲基胞嘧啶(5-methylcytosine,5-mC)明显降低[3]。现阶段研究者对表观遗传学作用机制的了解仍然远远少于传统遗传学,但DNA甲基化在癌症发生发展中的重要性是毋庸置疑的。
DNA甲基化是DNA甲基转移酶将S-腺苷甲硫氨酸上的甲基可逆地添加到DNA序列中胞嘧啶的第五号位置的碳原子上面,形成5-甲基胞嘧啶的过程。见图1。
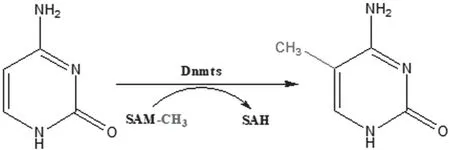
图1 DNA甲基化
人类基因组中近80%的CpG序列二核苷酸中可以检测到DNA甲基化。癌症中DNA甲基化异常指的是DNA过甲基化或低甲基化。DNA过甲基化指的是甲基的获得,总是抑制转录和降低抑癌基因表达。而DNA低甲基化指的是DNA缺乏甲基化,影响基因组整体稳定性或激活原癌基因。与DNA甲基化相关的酶有三类,分别具有建立、去除和识别DNA甲基化的功能,它们被形象地称作“书写者”“擦除者”和“读取器”。“书写者”是DNA甲基转移酶,催化甲基添加到胞嘧啶残基上,包括DNMT1/2、DNMT3A/B和DNMT3L等。“擦除者”是DNA 去甲基化酶,修饰并除去甲基,包括TET1/2/3等。“读取器”是甲基识别相关的酶,识别并结合甲基最终影响基因表达,包括MeCP2、MBD1/2/4、UHRF蛋白,锌指蛋白等。
2 DNA甲基化的建立与癌症的关系
目前已知人类基因组DNA甲基转移酶家族包 括DNMT1、DNMT2、DNMT3A、DNMT3B、DNMT3C和DNMT3L[4]。DNMT1、 DNMT3A和DNMT3B能够直接催化甲基加成到DNA上。DNMT1优先甲基化半甲基化DNA,在DNA复制过程中定位于亲代 DNA 链中的甲基化CpG 位点,与新合成的DNA链结合并使其甲基化,以精确模拟DNA复制前存在的原始甲基化模式[5]。此外,还具有修复脱氧核糖核酸甲基化的能力。因此,DNMT1被称为“维持DNA甲基化酶”。DNMT3A和DNMT3B在结构与功能上极为相似,与DNMT1不同,DNMT3A和DNMT3B不偏好半甲基化DNA,可以对未修饰的DNA建立新的甲基化,将非甲基化CpG转化为甲基化的CpG,因此被称为“从头甲基化转移酶”[6]。DNMT2和DNMT3L是非典型家族成员,不具有胞嘧啶甲基转移酶的功能。DNMT2是一种RNA甲基转移酶,它能特异性甲基化天冬氨酸38位胞嘧啶[7]。DNMT3L可作为 Dnmt3A重新启动甲基化的一般刺激因子,与DNMT3A结合形成异四聚体促进DNA从头甲基化,并通过与组蛋白去乙酰化酶1相互作用介导转录抑制[8]。DNMT3C是一个新的DNA甲基化酶,通过在啮齿动物基因组中复制 Dnmt3B进化而来,在雄性生殖系中特异性地促进年轻反转座子启动子的甲基化,这种特殊的活性是小鼠生育所必需的[4]。
DNA甲基化建立和维持过程中DNMTs的参与是必不可少的,也因此成为癌症治疗和抗癌新药物研发的重要靶点。多项研究发现前列腺癌细胞和组织中DNMT1表达过量。DNMT1的表达与前列腺癌前体病变以及预后复发标志物GSTP1和APC的表达呈负相关,GSTP1和APC在前列腺癌中高度甲基化[9]。这表明DNMT1在前列腺癌进展过程中的关键基因甲基化和抑制中起作用。大约25%的人类髓系或淋巴系统恶性肿瘤包括急性髓细胞白血病和T细胞急性淋巴性白血病[10],存在DNMT3A突变。Yang L等[11]建立了一个DNMT3A损失模型,发现DNMT3A 缺失导致 DNA 甲基化降低,主要发生在小鼠和人类样本的造血增强子区域。这些证据表明 DNMT3A 在血液疾病发展中起着重要作用。
3 DNA去甲基化与癌症
“擦除者”是指能够移除和修改DNA甲基化的酶,是将甲基化胞嘧啶通过不同途径或方式转化还原成未修饰胞嘧啶的过程。该过程目前存在主动和被动两种方式。被动去甲基化发生于DNA复制过程中,DNMT1功能被阻断或者活性降低,甲基化维持功能减弱,5mC含量稀释从而实现DNA被动去甲基化。在DNA复制过程中,核因子首先粘附半甲基化DNA,阻断了DNMT1功能,被粘附的DNA不能被完全甲基化,从而导致5mC减少[12]。另一方面,DNMT1及其辅助因子UHRF1组成的复合物无法识别含有5-羟基甲基胞嘧啶(5-hydroxymethylcytosine,5hmc)、5-甲 酰 基 胞嘧啶(5-formylcytosine,5fC)或5-羧基胞嘧啶(5-carboxycytosine,5cac)的半修饰二核苷酸,新合成DNA链上的胞嘧啶不能继续甲基化,最终导致5mC减少[13]。随着DNA多次复制之后5mC的含量逐渐被稀释降低,实现DNA的被动去甲基化。
主动去甲基化可以发生在分裂或非分裂细胞中,需要一系列酶促反应例如通过双加氧酶TETs酶的作用或碱基切除修复(base excision repair,BER)机制将已经甲基化的胞嘧啶还原成未修饰的胞嘧啶。目前已知两条DNA主动去甲基化途径,双加氧TET-糖苷酶TDG途径,胞嘧啶核苷脱氨酶AID或胞嘧啶脱氨酶APOBEC脱氨基作用。TET-TDG途径主要功能酶TET酶双加氧酶家族,家族成员TET1/2/3都能将5mC转化成5-羟甲基胞嘧啶5hmC。TETs继续将5hmC一步步氧化成5-甲酰胞嘧啶5fC和5-羧基胞嘧啶5caC,最后在胸腺嘧啶DNA糖苷酶TDG的作用下碱基切除修复最终将5mC转化为胞嘧啶[14]。AID/APOBEC作用于氨基,可以将5mC脱氨基转化成胸腺嘧啶,经过G/T错配修复后,诱导碱基切除修复(base excision repair,BER)通路并在TDG作用下将胸腺嘧啶转化为胞嘧啶。或者5mC在TET作用下转化为5hmC后,AID/APOBEC作用于5hmC脱氨基形成5-羟甲基尿嘧啶5hmU[15],最后在TDG作用下碱基切除修复,将5hmU转化成胞嘧啶。有研究提出5hmC上没有AID/ APOBEC脱氨酶的作用靶点,APOBEC不能作用于已经被TET氧化修饰的胞嘧啶碱基5hmC、5fC、5caC[16]。5mC可以在两个位点进行化学修饰:胺基和甲基。5mC的胺基可以通过AID/APOBEC脱胺,将5mC转化为胸腺嘧啶。5mC的甲基可以通过Tet酶介导的添加羟基来修饰,生成5hmC。5hmC也可以在两个位置进行化学修饰:胺基和羟甲基。AID/APOBEC可以脱氨5hmC,产生5hmU。5hmC的另一个化学途径是Tet可以进一步氧化5hmC形成5fC和5caC。最终,每个途径的产物-Thy、5hmU、5fC和5caC-被识别并裂解,替换为由TDG或SMUG1介导的裸胞嘧啶。见图2。
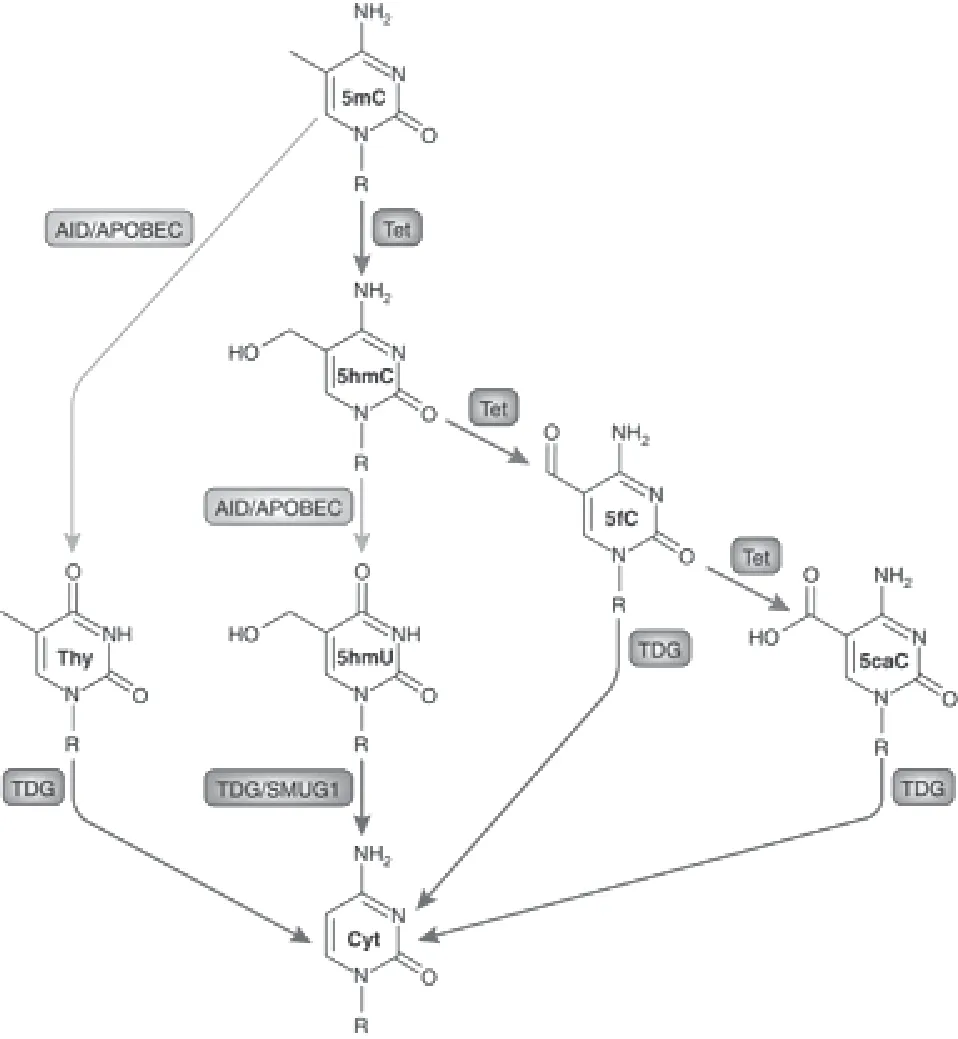
图2 DNA去甲基化途径
癌症发生的标志性事件之一是肿瘤抑制基因启动子处整体低甲基化和局部高甲基化。DNA甲基化可能会使基因失活,在多种癌细胞株,包括乳腺癌、鼻咽、食管癌、肺癌、宫颈癌和肾癌,以及淋巴瘤,都显示出高频率的TET1启动子甲基化和沉默。TET1催化结构域的异位表达重新激活了沉默的肿瘤抑制基因(DLit2,ZNF382,HOXA9和DKK1),并显着抑制了癌细胞的增殖[17]。另一项报道支持TET抑制肿瘤作用的研究是通过抑制α酮戊二酸脱氢酶增加氧化反应中TET酶的辅助因子-酮戊二酸水平,在该研究中,α酮戊二酸增加了体内高侵袭性转移性乳腺癌模型和细胞系中TET的活性,下游抗转移微RNA(mir-200)家族表达的增加。而mir-200的升高导致上皮间质转化和肺转移下调,抑制肿瘤转移从而达到抑癌作用[18]。这些发现佐证了TET1的肿瘤抑制作用。同时也有多方面的研究报道过TET 的致癌活性,包括TET1的表达促进大肠癌细胞的转移,激活TNBC 中的 PI3K 致癌信号,影响卵巢上皮癌和三阴性乳腺癌中的细胞迁移、肿瘤干细胞致瘤性等[19]。TETs调控基因表达是多途径多层次的,TETs是肿瘤抑制因子还是致癌基因取决于细胞环境、调节模式、不同的相互作用伙伴以及上游和下游信号通路。
4 DNA甲基化的识别与癌症
“读取器”是指能够识别DNA甲基化的酶,主要有3个蛋白家族:MBD蛋白家族,UHRF蛋白,锌指蛋白家族。MBD蛋白家族包括第一个确定的甲基结合蛋白MeCP2以及MBD1,MBD2,MBD3和MBD4[20]。家族成员都包含一个甲基-CpG结合结构域,该结构域对单一或多个对称甲基化CpG位点具有更高的亲和力[21]。MeCP2含有一个转录抑制结构域TRD,通过TRD与Dnmt1结合,并将Dnmt1招募到半甲基化DNA中进行维持性甲基化[22]。MeCP2、MBD1、MBD2大部分是与组蛋白去乙酰化酶复合物相互作用从而达到转录抑制的功能[23]。MBD3由于MBD结构域的突变而不能直接与DNA结合[20]。MBD4正常情况下能够与DNA结合,但它结构域上含有T-G错配糖苷酶,优先识别鸟嘌呤与尿嘧啶、胸腺嘧啶或5-氟尿嘧啶的错配,并结合参与错配修复的蛋白质[24]。UHRF家族包括UHRF1和UHRF2,UHRF蛋白家族除了结合DNA而抑制转录以外,更重要的是,它们可以与DNMT1结合并靶向半甲基化的DNA链,尤其是在DNA的复制过程中起着维持DNA甲基化的作用[25]。最后是锌指蛋白,包括Kaiso,ZBTB4和ZBTB38。Kaiso用3个锌指基序来结合两个连续甲基化的CpG,而ZBTB4和ZBTB38则可以结合单个甲基化的CpG位点[26]。与MDB蛋白家族类似,锌指蛋白也可以抑制转录。比如,在人和老鼠的结肠癌中,Kaiso就是一个转录抑制因子,它与甲基化的CpG簇结合并抑制甲基化的抑癌基因的表达[27]。
5 中药的抗肿瘤与去甲基化作用
以中医药理论为基础的中药因其疗效好且无严重副作用的优点越来越多地被应用于肿瘤治疗中,作为辅助或者替代疗法,有效地提高了患者生存率,改善了患者的生活质量[28-29]。许多中药植物化学物质参与5-hmC 的形成和失活的DNA甲基化过程。广泛存在于水果蔬菜等各种植物中的维生素C已被证明参与DNA羟甲基化过程,发挥抗肿瘤作用[30]。因此,推测中药在癌症治疗中的一个重要功能是调控TET依赖的DNA去甲基化。逆转肿瘤相关基因异常高甲基化,去甲基化恢复肿瘤抑制基因的表达成为抗肿瘤研究和新药开发的热点。迄今为止,中药与 DNA 去甲基化关系的研究还很有限。
在一项关于乳腺癌的研究中,经薯蓣皂苷处理后的乳腺癌细胞TET2和TET3表达上调,TET1表达下调,并且对细胞的增殖、侵袭和迁移有抑制作用[31]。天花粉为清热泻火类药物,主要用于治疗热病口渴、黄疸、肺燥咳血、痈肿等,近年来发现它的有效成分天花粉蛋白对人乳腺癌细胞MDA-MB-231的脾酪氨酸激酶基因有明显的去甲基化作用[32],对人宫颈癌细胞HeLa和Caski的APC基因也有去甲基化作用[33]。丹参具有抗氧化、抗病毒、抗肿瘤等活性,在临床上用于治疗心脑血管疾病、癌症以及各种炎症,丹参酮ⅡA可通过下调肝癌细胞DNMT1,DNMT3a,DNMT3b的表达来逆转抑癌基因的甲基化状态,其抑制肝癌细胞生长和促进细胞凋亡的机制与激活NF-E2相关因子2(Nrf2)的信号转导通路、诱导Nrf2基因CpG岛的去甲基化有关[34]。葡萄科、豆科、百合科、桃金娘科、蓼科等多种植物中的白藜芦醇上调前列腺癌细胞LNCap、PC3和DU145中5hmC和TET1水平,下调5mC水平从而去甲基化TIMP2、TIMP3[35]基因,抑制肿瘤的迁移和侵袭。黄连中的小檗碱通过抑制DNMT1和DNMT3B表达逆转甲基化基因TP53的甲基化状态并增加表达,诱导多发性骨髓瘤细胞系U266凋亡[36]。另一项研究发现小檗碱能增加tet3的表达并去甲基化mir-145,mir-145靶向HK2并抑制它的表达,从而拮抗卵巢癌细胞的瓦尔堡效应[37]。当归主要功效是补血活血、调经止痛、润肠通便,研究发现,当归主要活性成分Z-蒿本内酯能使前列腺肿瘤中Nrf2启动子CpG岛去甲基化,从而再激活Nrf2基因和Nrf2目的基因表达[38]。当归对肝癌细胞、白血病KG-1细胞系等癌细胞都有抑制增殖活性的作用[39-40],但是否跟去甲基化有关还有待进一步研究。
6 结语
中药作为DNA去甲基化药物治疗肿瘤优势巨大,同时也有很多难点。中药成分复杂,肿瘤细胞不容易对中药产生耐药性,同时也很难确定其抗肿瘤有效成分,从而限制了中药在临床抗肿瘤治疗中的应用。中药去甲基化的研究大部分是单一的化学成分,有关中药复方的DNA去甲基化研究鲜有报道。中药与DNA去甲基化关系的研究还很有限,主要是单一成分对肿瘤某一高甲基化抑癌基因,去甲基化重新激活该基因,从而达到抑癌作用或者干预DNA转移酶的表达从而调控基因甲基化状态。
癌症是一类极其复杂的疑难杂症,中药作为DNA去甲基化药物,应进一步研究中药复方的抗肿瘤活性成分及活性组群,筛选出具有去甲基化作用的靶向成分,阐明其作用机制,提高其生物学效应,扩大其在临床抗肿瘤治疗中的应用。

