酵母β-葡聚糖与肌球蛋白互作及对蛋白质风味吸附特性的影响
徐永霞,赫雪丽,尹一鸣,赵洪雷,李学鹏,王明丽,周小敏,励建荣*
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心国家鱼糜及鱼糜制品加工技术研发分中心 辽宁锦州 121013 2 蓬莱京鲁渔业有限公司 山东烟台 265600 3 浙江兴业集团有限公司 浙江舟山 316120)
鱼糜制品具有高蛋白、低脂肪、高营养、食用方便等特点,深受消费者的喜爱,已成为我国水产加工食品中不可或缺的一部分。近年来,我国鱼糜加工业发展迅速,2019年,鱼糜制品产量达到139.4 万t[1]。鲅鱼又名蓝点马鲛,是我国重要的海洋经济鱼类之一,主要分布于我国渤海、东海和黄海等地。目前鲅鱼以鲜销和冻品为主,为提升其经济价值,常将鲅鱼制成冷冻鱼糜,然而,其肌肉中红肉含量较高,制成的鱼糜色泽较暗,且存在腥味重、凝胶性差等问题,严重影响其凝胶品质[2]。诸多研究表明,在鱼糜制品中添加外源添加剂,如多糖(淀粉、食用胶体)、外源蛋白和酚类物质等,可以有效改善鱼糜制品的凝胶特性[3-5]。
随着人们生活水平的提高和饮食观念的改变,对鱼糜制品的品质也提出更高的要求,低盐、低糖和高膳食纤维的鱼糜制品逐渐成为研究热点。酵母β-葡聚糖是从酵母细胞壁中得到的一种天然功能性多糖,可作为膳食纤维食用,具有增强免疫力,调节血脂,降低血糖,改善肠道菌群等多种功能活性,其中以β-1,3/-1,6 结合的β-葡聚糖具有最高的生物活性[6]。目前,酵母β-葡聚糖在食品中主要应用于保健食品、乳制品、功能性饮料、烘焙等行业[7]。酵母β-葡聚糖常被用来改善食品的质地,近年来有研究表明,酵母β-葡聚糖应用在鱼糜制品中能够增强其凝胶特性,且具有一定的去腥作用[8-10]。Zhang 等[10]报道酵母β-葡聚糖不仅能够改善白鲢鱼鱼糜凝胶特性和感官品质,还能够吸附并减少鱼体产生的异味化合物的释放。酵母β-葡聚糖作为一种天然多糖,与蛋白质相互作用后蛋白分子构象发生改变,进而影响蛋白质的功能特性。肌球蛋白约占鱼肉总蛋白含量的30%,是形成鱼糜凝胶网络结构的关键蛋白,对鱼糜制品的凝胶品质起至关重要的作用。然而,目前关于酵母β-葡聚糖与鱼肌球蛋白分子间的互作机制及其对蛋白质风味吸附能力的影响尚不明确。
鉴于此,本文以鲅鱼为研究对象,选取鱼肉中5 种典型腥味化合物(戊醛、己醛、庚醛、辛醛和1-辛烯-3-醇),研究不同酵母β-葡聚糖添加量对肌球蛋白溶解度、Zeta 电位、二级结构、巯基、疏水性等及风味结合能力的影响,从分子水平揭示酵母葡聚糖与肌球蛋白相互作用及对蛋白质风味吸附能力的影响规律,为开发优质、营养健康的鱼糜制品提供理论依据。
1 材料与方法
1.1 材料与试剂
酵母β-葡聚糖(纯度≥85.0%),安琪酵母股份有限公司;冰鲜鲅鱼,锦州市林西路水产市场,平均质量(2 500±50)g。
戊醛、己醛、庚醛、辛醛和1-辛烯-3-醇均为色谱纯,美国Sigma 公司;ATP-Na2为分析纯,北京索莱宝科技有限公司;Tris、乙酸镁等均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
MiniProtean3 凝胶电泳仪,美国Bio-Rad 公司;UV-2550 紫外-可见分光光度计,岛津仪器有限公司;Nano-ZS90 激光粒度分析仪,英国马尔文公司;Trace 1300-ISQ 7000 气质联用仪,赛默飞世尔科技有限公司;50/30 μm DVB/CAR/PDMS 固相微萃取头,美国Supelco 公司;LabRAM HR Evolution 拉曼光谱仪,HORIBA 公司;970CRT 荧光分光光度计,上海精密科学仪器有限公司;BiofugeStratos 高速冷冻离心机,美国Thermo 公司。
1.3 试验方法
1.3.1 肌球蛋白的提取及SDS-PAGE 分析 取鲅鱼背部肌肉,参照Park 等[11]的方法提取肌球蛋白。采用双缩脲法测定肌球蛋白的浓度,利用SDS-PAGE 凝胶电泳对肌球蛋白进行成分分析,并通过Quantity One 软件进行扫描与分析。
1.3.2 肌球蛋白-酵母β-葡聚糖样品的制备 用20 mmol/L Tris-HCl 缓冲液 (含0.5 mol/L NaCl,pH 7.0)将肌球蛋白的质量浓度调至20 mg/mL,然后以溶液中肌球蛋白质量为基准向其中分别添加0,1%,2%,3%,4%的酵母β-葡聚糖,充分混匀后用于各项指标的测定。
1.3.3 风味物质储备液的制备 将戊醛、己醛、庚醛、辛醛和1-辛烯-3-醇溶于适量的20 mmol/L Tris-HCl 缓冲液(含0.5 mol/L NaCl,pH 7.0)中,超声2 min 后,用缓冲液定容,使溶液中各风味物质最终质量浓度为2 000 mg/L,密封后置于4 ℃冰箱储存备用。
1.3.4 Zeta 电位的测定 将样品中蛋白质量浓度稀释至0.1 mg/mL,注入弯曲毛细管样品池,采用Nano-ZS90 激光粒度分析仪进行Zeta 电位的测定。设定参数:溶剂为水,测定温度25 ℃,平衡2 min。
1.3.5 表面疏水性的测定 参考Xu 等[12]的方法,并稍加修改。样品用Tris-HCl 缓冲液稀释,使其蛋白质量浓度分别达到0.2,0.4,0.6,0.8,1.0 mg/mL。取4 mL 样品,加入50 μL ANS 避光反应10 min,然后测定其荧光强度。测定条件激发波长374 nm,狭缝5 nm,荧光扫描范围300~500 nm,表面疏水性为肌球蛋白浓度相对于荧光强度所作曲线的斜率。
1.3.6 活性巯基的测定 将样品中蛋白质量浓度调至4 mg/mL,取0.5 mL 样品,加入4.5 mL 92 mmol/L pH 8.0 的甘氨酸缓冲液 (含1%Tris,4 mmol/L EDTA)混合,充分混匀后加入0.5 mL 10 mmol/L DTNB 缓冲液,置于4 ℃静置1 h,在412 nm 波长下测定其吸光度。蛋白中活性巯基含量的计算公式如下:
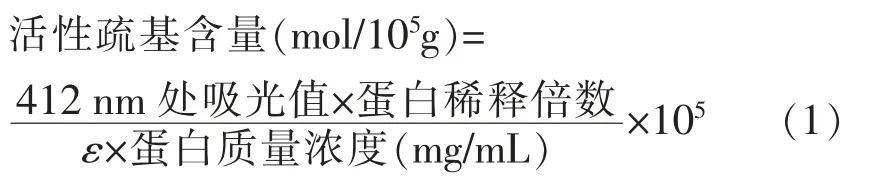
式中,ε——13 600 L/(mol·cm)为巯基摩尔消光系数。
1.3.7 荧光光谱测定 参考Cao 等[13]的方法略加修改。将样品中蛋白浓度稀释至0.1 mg/mL 进行荧光光谱测定。测试条件:EX/EM 缝宽5 nm,激发波长295 nm,发射波长320~460 nm,高速扫描1 min,灵敏度3。
1.3.8 紫外光谱测定 将样品中蛋白质量浓度调至0.5 mg/mL,以Tris-HCl 缓冲液作空白对照,在190~400 nm 波长范围内进行高速扫描,得到紫外光谱图。
1.3.9 拉曼光谱测定 参照Alix 等[14]的方法,将蛋白样品经真空冷冻干燥后进行拉曼光谱的测定。测定参数:激发波长532 nm,狭缝200 μm,功率120 mW,曝光时间60 s,获取功率120 cm-1/min,扫描范围400~3 600 cm-1。以苯丙氨酸(1 003 cm-1)为标准进行归一化。
1.3.10 肌球蛋白与风味物质结合能力的测定 参考徐永霞等[15]的方法,并稍加修改。蛋白液样品用Tris-HCl 缓冲液调到质量浓度为5 mg/mL,取10 mL 样品加入20 mL 顶空瓶中,添加风味物质储备液并调至质量浓度为1 mg/L,密封摇匀后置于30 ℃恒温振荡吸附1 h,然后采用固相微萃取(SPME)-气相色谱-质谱法(GC-MS)测定振荡平衡后试样中各风味化合物的顶空浓度。
SPME 条件:将装有样品的顶空瓶放在40 ℃磁力搅拌器中加热平衡10 min,用已活化好的萃取头顶空吸附20 min 后取出,插入GC 进样口解析5 min。
GC 和MS 参数条件和徐永霞等[15]的一致。肌球蛋白对风味化合物的结合能力用相对百分比表示:

1.4 数据分析
每组试验均重复3 次,运用SPSS 19.0 软件进行方差分析(ANOVA)和Duncan 检验,使用Origin 9.0 软件绘图,GC-MS 数据处理利用NIST11/Wiley 7.0 标准质谱库进行鉴定。若无特殊说明,数据均表示为“平均值±标准差”形式,肩标上不同字母表示为差异显著(P <0.05)。
2 结果与分析
2.1 肌球蛋白SDS-PAGE 分析
肉类肌球蛋白一般由2 条重链和4 条轻链组成,重链分子质量约为200 ku,轻链分子质量约为20 ku[16]。鲅鱼肌球蛋白凝胶电泳结果如图1所示。由图可见,在200 ku 处有1 条明显的条带,为肌球蛋白重链(MHC),在25 ku 和14 ku 处的条带为肌球蛋白轻链,此外在44.3 ku 处有1 条肌动蛋白条带。此结果与Yuan 等[17]提取的花鲢鱼肌球蛋白组成结果相似。

图1 鲅鱼肌球蛋白电泳图Fig.1 The SDS-PAGE patterns of Scomberomorus niphonius myosin
2.2 Zeta 电位的变化
Zeta 电位可以反映蛋白表面电荷的变化,以及蛋白质的热聚集行为,可用来表征蛋白溶液体系的稳定性。当蛋白表面所带电荷较多,分子间相互排斥,难以聚集,系统稳定性增强,此时表现为较大的Zeta 电位绝对值[18]。酵母β-葡聚糖对肌球蛋白溶液Zeta 电位绝对值的影响如图2所示。由图可见,随着酵母β-葡聚糖不断增加,Zeta 电位绝对值呈先上升后下降的趋势,而差异不显著。当酵母β-葡聚糖添加量在0~2%范围内,酵母β-葡聚糖的添加可能使蛋白结构展开,蛋白表面同性电荷增多,使蛋白分子间相互排斥作用增强,减少蛋白分子之间的聚集,从而使蛋白溶液的Zeta 电位绝对值增加[19];随着酵母β-葡聚糖添加量的进一步增大,肌球蛋白表面极性环境发生变化,导致溶液不稳定。肌球蛋白与酵母β-葡聚糖相互作用可能导致蛋白表面所带的负电荷被屏蔽,使蛋白分子间的静电斥力减弱,促进了蛋白分子间的相互聚集,从而使蛋白溶液的Zeta 电位绝对值降低[20]。
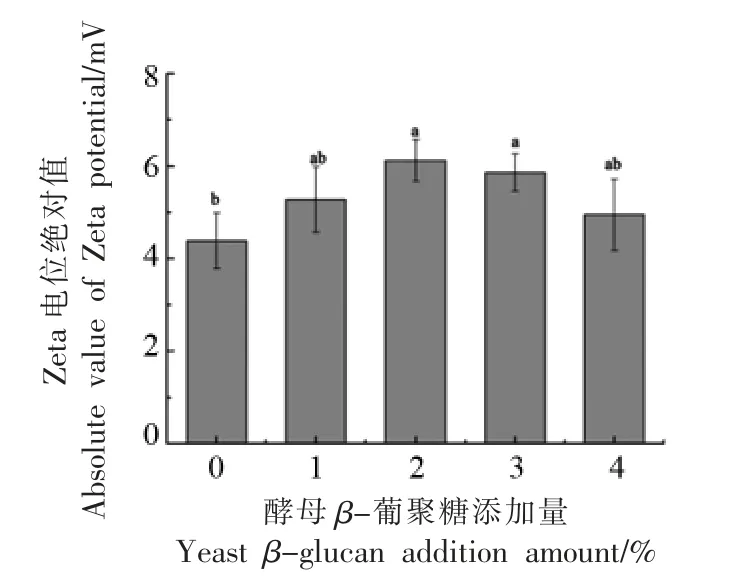
图2 酵母β-葡聚糖添加量对肌球蛋白Zeta 电位的影响Fig.2 Effects of yeast β-glucan addition amount on the Zeta potential of myosin
2.3 表面疏水性的变化
表面疏水性是蛋白质的重要特性之一,与蛋白质的三级结构变化水平密切相关。酵母β-葡聚糖对肌球蛋白表面疏水性的影响如图3所示。可以看出,随着酵母β-葡聚糖添加量的增大,表面疏水性呈先上升后下降的趋势,当酵母β-葡聚糖添加量为2%时,蛋白表面疏水性达到最大。这可能是因为酵母β-葡聚糖的添加诱导肌球蛋白结构伸展,蛋白内部的疏水基团暴露,从而使其表面疏水性增加。然而,当酵母β-葡聚糖添加量超过2%时,混合体系中多糖的浓度进一步升高,两种聚合物分子倾向于互相排斥,导致酵母β-葡聚糖与蛋白质双相混合体系发生相分离,引起蛋白质的聚集;此外随着酵母葡聚糖浓度的升高,混合体系中亲水性羟基增多,可能会阻止ANS 与肌球蛋白疏水基团的结合,从而导致表面疏水性降低[21]。
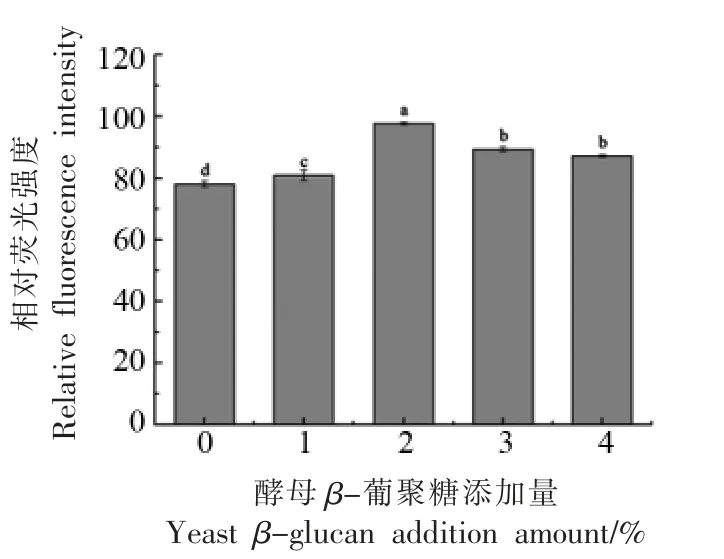
图3 酵母β-葡聚糖添加量对肌球蛋白表面疏水性的影响Fig.3 Effects of yeast β-glucan addition amount on the surface hydrophobicity of myosin
2.4 活性巯基的变化
活性巯基是蛋白结构中活性最强的基团,当蛋白质构象发生改变时,埋藏在内部的巯基会暴露出来,因此活性巯基的含量变化直接影响蛋白质结构的稳定性[22]。由图4可知,当酵母β-葡聚糖的添加量为0~2%时,蛋白溶液中活性巯基含量随其添加量的增加而显著增大(P<0.05),当酵母β-葡聚糖添加量超过2%时,增加不显著(P>0.05)。这一结果与表面疏水性的变化趋势相似。适量的酵母β-葡聚糖可促进肌球蛋白分子结构的展开,暴露出更多的活性巯基;而酵母β-葡聚糖的添加量超过2%时,可能因为酵母β-葡聚糖浓度过高与蛋白质之间发生相分离,促使蛋白质分子之间相互交联、聚集,暴露出的活性巯基重新被包埋于分子内部,导致其含量又降低。
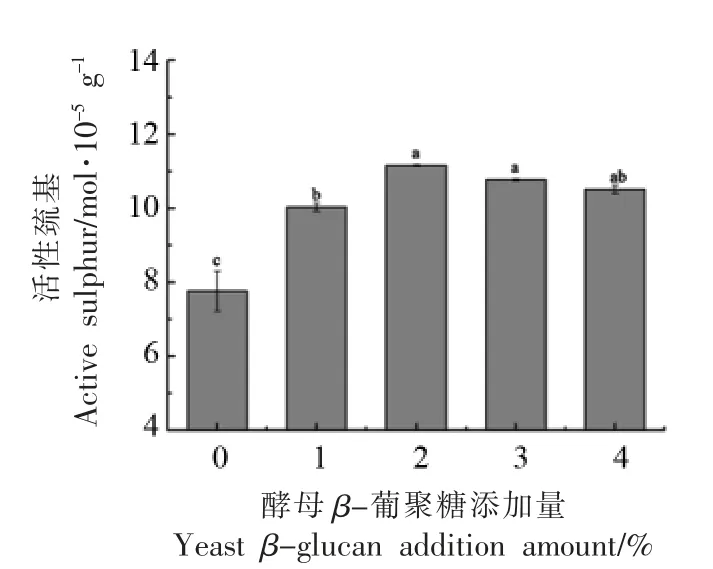
图4 酵母β-葡聚糖添加量对肌球蛋白活性巯基的影响Fig.4 Effects of yeast β-glucan addition amount on active sulfhydryl groups of myosin
2.5 荧光光谱分析
肌球蛋白的球状头部和棒状尾部含有大量的色氨酸残基,其内源荧光强度的变化可以反映色氨酸等芳香族氨基酸残基的暴露情况,进而能够表征蛋白质分子三级结构的变化[23]。图5显示了不同添加量的酵母β-葡聚糖对肌球蛋白的内源荧光光谱图的影响。由图可知,与天然肌球蛋白相比,酵母β-葡聚糖的添加使肌球蛋白的内源荧光强度下降,且发射波长发生一定的红移。肌球蛋白处于天然状态时,其色氨酸残基通常包埋在蛋白质的内部,因此具有较高的荧光强度。酵母β-葡聚糖的添加诱导肌球蛋白结构展开,内部的色氨酸残基暴露出来,导致肌球蛋白所处微环境极性增强,产生荧光猝灭作用,使荧光强度下降。此外,随着酵母β-葡聚糖添加量的增加,肌球蛋白荧光强度逐渐降低,且发生明显的红移现象。这是由于含有多羟基的酵母β-葡聚糖的加入,可能使色氨酸微环境的极性增强,导致荧光强度进一步降低[24]。

图5 酵母β-葡聚糖添加量对肌球蛋白内源荧光的影响Fig.5 Effects of yeast β-glucan addition amount on the intrinsic fluorescence of myosin
2.6 紫外光谱分析
紫外吸收光谱可以反映蛋白质分子中芳香族氨基酸侧链所处微环境的变化情况,是表征蛋白质三级结构的常用方法之一。在一定的波长范围内,色氨酸、酪氨酸等芳香族氨基酸所带显色基团吸收光子后能够发生电子能级跃迁,产生紫外吸收光谱[25]。不同添加量的酵母β-葡聚糖对肌球蛋白紫外光谱的影响如图6所示。从图中可以看出,天然肌球蛋白在274 nm 波长附近存在较强的吸收峰,通常认为是由肽链上酪氨酸和色氨酸等芳香杂环的π-π*跃迁引起的[26],且当酵母β-葡聚糖添加量不断增加时,该吸收峰强度明显增强。这可能是由于酵母β-葡聚糖与肌球蛋白相互作用导致蛋白构象发生改变,使内部的色氨酸和酪氨酸等基团暴露于蛋白分子表面,从而增强了紫外吸收强度。这一结果与内源荧光光谱结果相一致。

图6 酵母β-葡聚糖添加量对肌球蛋白紫外吸收光谱的影响Fig.6 Effects of yeast β-glucan addition amount on the UV absorption spectra of myosin
2.7 拉曼光谱分析
拉曼光谱可以用于监测蛋白质肽链的骨架振动、氨基酸侧链周围微环境的变化情况,其中酰胺I 区(1 600~1 700 cm-1)的谱带信息与蛋白质主链的构象及其二级结构的含量密切相关[27]。不同添加量的酵母β-葡聚糖对肌球蛋白二级结构相对含量的影响如表1所示。由表可知,天然的鲅鱼肌球蛋白中α-螺旋结构的相对含量最高,达到68.32%,它们之间通过分子内的羰基氧和氨基氢之间形成的氢键来维持蛋白质的结构,表明鲅鱼肌球蛋白分子具有良好的致密性。随着酵母β-葡聚糖添加量的增加,α-螺旋含量呈先下降后上升的趋势,当酵母β-葡聚糖添加量增至2%时,α-螺旋含量显著下降至57.77%,而β-折叠、β-转角和无规则卷曲的含量变化则与之相反,这是由于酵母β-葡聚糖能够促进肌球蛋白结构展开,使α-螺旋向β-折叠和β-转角转变。据研究报道,β-折叠结构因具有较大的表面积而有利于形成氢键[28],因此,β-折叠含量的增加可能会增强酵母β-葡聚糖与蛋白间的相互作用。然而,当酵母β-葡聚糖添加量大于2%时,可能由于酵母β-葡聚糖浓度过高,导致多糖和蛋白质两相混合体系发生相分离,使蛋白质逐渐聚合,重新形成α-螺旋结构,从而使其含量上升。
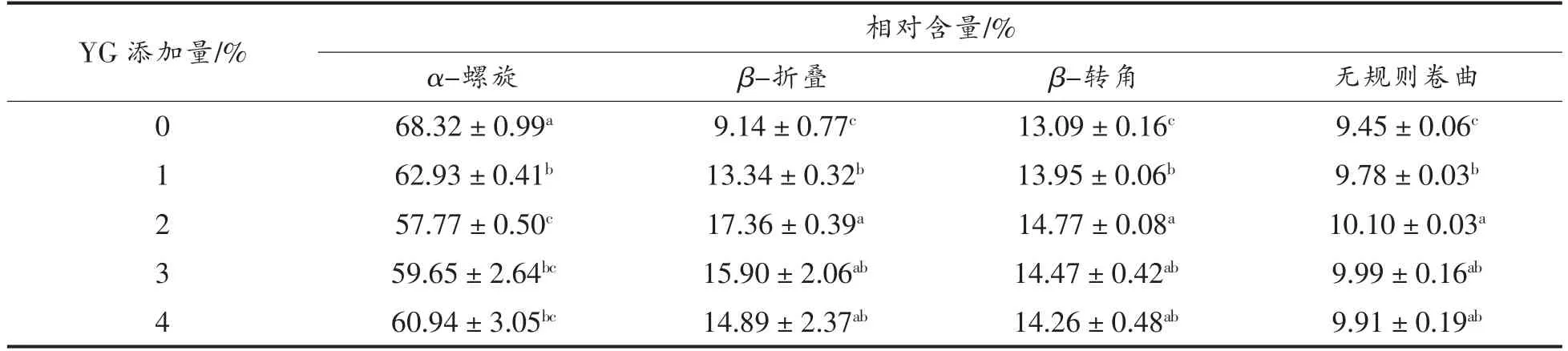
表1 酵母β-葡聚糖添加量对肌球蛋白二级结构的影响Table 1 Effects of yeast β-glucan addition amount on the secondary structures of myosin
2.8 结合能力的变化
蛋白质的构象决定其风味结合能力,蛋白质与多糖相互作用会使蛋白质的构象发生改变,从而影响其风味结合能力。如图7所示,1-辛烯-3-醇、戊醛、己醛、庚醛和辛醛与天然鲅鱼肌球蛋白的结合能力分别为14.90%,16.98%,18.71%,20.14%,20.91%。随着醛类化合物碳链长度的增加,其结合能力随之增大(P<0.05),这是由于碳链越长,分子疏水性增大,拥有更多的风味结合位点,从而与蛋白质的结合能力增强[29]。此外,1-辛烯-3-醇与蛋白的结合作用要弱于醛类物质,这是由于醇类物质具有较强的极性,主要通过氢键作用与蛋白质相结合,而与蛋白质间产生的疏水相互作用较弱,因此结合能力较差[30]。
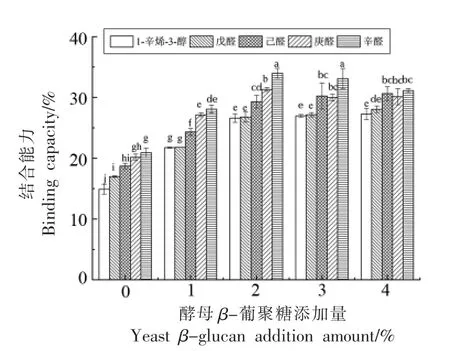
图7 酵母β-葡聚糖添加量对肌球蛋白与风味物质结合能力的影响Fig.7 Effects of yeast β-glucan addition amount on the binding capacity of myosin to flavor compounds
随着酵母β-葡聚糖添加量的增加,肌球蛋白与5 种风味物质的结合能力均有不同程度的上升,当酵母β-葡聚糖添加量为2%时,肌球蛋白对1-辛烯-3-醇、戊醛、己醛、庚醛和辛醛的吸附能力分别提高了11.70%,9.78%,10.60%,11.15%,13.08%。当添加量超过2%时,结合能力增加不显著(P<0.05)。酵母β-葡聚糖的适量添加诱导蛋白质结构展开,埋藏于内部的疏水基团和巯基暴露出来,使蛋白质拥有更多的疏水性结合位点,从而使其风味结合能力增强;而添加过量的酵母β-葡聚糖可能促使蛋白质聚集,使暴露的疏水性结合位点被重新包埋,导致蛋白质的风味结合能力降低。此外,酵母β-葡聚糖具有的羟基结构可能增强与风味物质间的氢键相互作用,同时其具有的多孔海绵状结构对风味吸附也具有促进作用[11]。
3 结论
本试验研究了酵母β-葡聚糖与鲅鱼肌球蛋白的相互作用及其对蛋白质与特征腥味物质结合能力的影响。结果表明,随着酵母β-葡聚糖添加量的增加,肌球蛋白的溶解度、Zeta 电位绝对值、表面疏水性和活性巯基含量均呈先增加后降低的趋势,肌球蛋白的紫外吸收峰强度逐渐增强,内源荧光强度逐渐下降;当酵母β-葡聚糖添加量为0~2%时,α-螺旋含量显著下降,而β-折叠、β-转角和无规卷曲含量显著增加,当添加量超过2%时,α-螺旋含量又升高,β-折叠等二级结构含量降低,然而都不显著;肌球蛋白对5 种腥味物质的结合能力随酵母β-葡聚糖添加量的增加呈先增强后减弱的趋势,当酵母β-葡聚糖添加量超过2%时,结合能力增加不显著。

