甲鱼蛋蛋白水解物的体外消化及对抗氧化和α-葡萄糖苷酶抑制活性的影响
赵才冬,漆姚姚,雷楚文,裘乐芸,邓泽元,郑溜丰
(南昌大学 食品科学与技术国家重点实验室 南昌 330047)
慢性病严重危害人类健康,其中糖尿病已成为全球疾病死亡的主要原因。据最新统计数据显示,全世界糖尿病的患者数超过4.63 亿,其中我国的糖尿病患者超过1.164 亿,成为糖尿病第一大国[1]。糖尿病可能引起各种并发症,主要是对眼、肾、心脏、血管及神经的慢性损害[2]。防治糖尿病刻不容缓。传统的降血糖药物多为人工合成的化合物,如α-葡萄糖苷酶抑制剂(阿卡波糖、米格列醇、伏格列波糖),被认为是治疗糖尿病的一线药物[3]。然而,现有的治疗药物有许多局限性,会产生包括胃肠和肝脏疾病等各种副作用[4]。近年来,膳食来源的天然化学物在防治糖尿病中具有重要作用[5]。迫切需要从膳食来源的天然产物库中探寻高效、低毒,具有降血糖功效的活性分子。
膳食中添加蛋白水解物能够以不依赖于胰岛素的方式,显著降低餐后血糖水平及改善胰岛素敏感性,提示蛋白酶解物中的活性肽具有很好的降血糖作用[6]。除了通过抑制α-葡萄糖苷酶来干扰碳水化合物消化外,减少小肠对葡萄糖的吸收也是治疗糖尿病的有效途径。氧化应激被认为是糖尿病发生、发展的重要诱因之一[7]。现有研究表明,活性氧可通过影响葡萄糖转运载体的表达,促进小肠摄取葡萄糖,而植物化学物,如白杨素和绿原酸可通过清除活性氧来减少葡萄糖摄取[8-9]。使用抗氧化天然化合物等,被认为是糖尿病治疗的新方法。
本课题组前期通过木瓜蛋白酶水解甲鱼蛋蛋白制备分子质量<2.5 ku 组分,其具有较强的抗氧化及α-葡萄糖苷酶抑制活性,是潜在的降血糖组分[10]。此外,了解活性肽在胃肠道消化后的活性功效,对于评估其生物活性及生物利用度至关重要[11]。甲鱼蛋<2.5 ku 组分的胃肠消化特性及其消化后是否仍具有活性功效等问题亟待研究。本研究通过体外模拟胃及胃肠道消化模型,探究甲鱼蛋<2.5 ku 组分的胃肠消化特性、消化前后抗氧化及α-葡萄糖苷酶抑制活性的变化,为糖尿病的防治提供新方法。
1 材料与方法
1.1 材料
甲鱼蛋冻干粉,木瓜蛋白酶、胃蛋白酶、胰蛋白酶、谷胱甘肽,Sigma 公司。
1.2 试验仪器与设备
Cr-103 型nh 色差仪,厦门海达仪器有限公司;XW-80A 型涡旋仪,上海沪西分析仪器厂;SHZ-A 型水浴恒温振荡器,上海博迅实业有限公司;Agilent 1100 系列高效液相色谱仪,安捷伦科技有限公司 (液相色谱柱为Waters XBridg BEH SEC 柱);FD-1 型冷冻干燥机,北京德天佑科技发展有限公司;pHs-2 酸度计,上海精密科学仪器有限公司;Varioskan Flash 型全自动酶标仪、LEGEND MACH 1.6R 型离心机,美国Thermo 公司;Millipore 超滤离心管,上海登宁科技有限公司。
1.3 试验方法
1.3.1 甲鱼蛋蛋白水解物<2.5 ku 降糖组分的制备 甲鱼蛋蛋白酶解:用95%乙醇在超声波水浴下对甲鱼蛋冻干粉进行醇沉,离心获取蛋白质[10]。将甲鱼蛋蛋白粉配制成质量分数为5%的蛋白溶液,选取木瓜蛋白酶(5 000 U/g 蛋白粉)进行酶解,酶解条件是:50 ℃,pH 6.5。用1 mol/L NaOH 或HCl 保持酸碱度恒定。酶解6 h 后在90 ℃下对酶进行20 min 灭活,8 000×g 离心15 min 除沉淀,将上清液冷冻干燥并在-20 ℃下储存。
超滤:用分子质量为10 ku 和2.5 ku 的超滤膜对甲鱼蛋蛋白木瓜酶解液超滤分级,得到3 个组分>10 ku,10~2.5 ku 和<2.5 ku,并将<2.5 ku 的组分冻干,用于后续试验。
1.3.2 色泽的测定 使用色差仪测定甲鱼蛋冻干粉、<2.5 ku 降糖肽组分的颜色。首先将样品放在标准白板上(L0*=94.46,a0*=-0.61,b0*=4.64),记录明亮度L*值、红绿色调a*值及蓝黄色调b*值。L*表示颜色变化范围从黑(0)到白(100),+ΔL*=明亮,-ΔL*=较暗;a*表示颜色变化范围从红(+)到绿(-),+Δa*=较红,-Δa*=较绿;b*表示颜色变化范围从黄(+)到蓝(-)的变化,+Δb*=较黄,-Δb*=较蓝。总色差(ΔE*)计算公式:
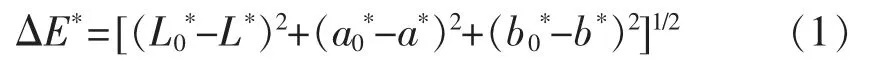
1.3.3 体外模拟胃肠消化 将<2.5 ku 组分用去离子水配成1 mg/mL 的溶液。取1 mL 该溶液、1 mL 胃蛋白酶溶液(酶活4 000 U/mL),用1 mol/L盐酸调节pH 值至1.8,用涡旋仪充分混匀,置于37 ℃100 r/min 的水浴摇床中避光反应2 h,收集胃消化液,90 ℃水浴10 min 灭酶。在上述经胃消化的体系中继续加入2 mL 胰蛋白酶溶液 (酶活200 U/mL),用1 mol/L 氢氧化钠调节pH 值至7,涡旋仪充分混匀后,置于37 ℃100 r/min 的水浴摇床中避光反应2 h,收集肠消化液,90 ℃水浴10 min 灭酶。
1.3.4 多肽含量的测定 将<2.5 ku 组分及其胃肠消化后的样品配制成质量浓度为5 mg/mL 的溶液,取2.5 mL 该溶液,加入2.5 mL 10%(质量分数)三氯乙酸水溶液,于漩涡混合仪上混合均匀,静置20 min,然后在4 200 r/min 下离心10 min。取1.0 mL 上述溶液,加入双缩脲试剂3.0 mL(V样液∶V双缩脲试剂=3∶2),混合均匀后于60 ℃水浴显色5 min,4 200 r/min 离心10 min。取上清液于波长310 nm 处测定吸光度,对照标准曲线求得样品溶液中多肽质量浓度(mg/mL),进而求得样品中多肽含量。通过谷胱甘肽绘制标准曲线。
1.3.5 反相高效液相色谱(RP-HPLC)法检测甲鱼蛋蛋白水解物的消化特性 甲鱼蛋蛋白水解物、不同分子质量组分及<2.5 ku 组分经胃肠消化后的分子质量分布采用Agilent 1100 系列高效液相色谱仪测定。其分析条件为:反向液相色谱柱Waters XBridg BEH SEC 柱(3.5 μm,7.8 mm×300 mm),流动相为水∶乙腈=40%∶60%(体积比),柱温箱温度30 ℃,DAD 检测波长214 nm,进样量10 μL,流速0.8 mL/min,时间20 min。
1.3.6 DPPH 自由基清除能力的测定 将DPPH粉末加入甲醇中制得0.26 mmol/L DPPH 溶液。取100 μL DPPH 溶液与20 μL 样品加入96 孔板中,室温避光条件中反应30 min,在波长517 nm 处用全自动酶标仪测定其吸光度,平行测定3 次。DPPH 自由基清除率计算公式:
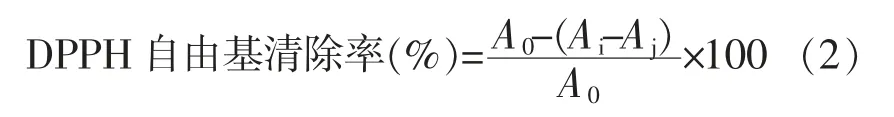
式中,A0——不加样品,加入DPPH 时的吸光度;Ai——加入样品和DPPH 的吸光度;Aj——加入样品,不加DPPH 的吸光度。
1.3.7 ABTS 自由基清除能力的测定 将5 mL 7.4 mmol/L ABTS 储备液与88 μL 2.6 mmol/L K2S2O8溶液混匀,暗处静置12~16 h,配成ABTS工作液。ABTS 工作液用80%乙醇稀释,使混合溶液在734 nm 波长处的吸光值为0.7。将200 μL ABTS 工作液与20 μL 样品加入96 孔板中,常温避光混合6 min,在波长734 nm 处测定吸光度,平行测定3 次。ABTS 自由基清除率计算公式:
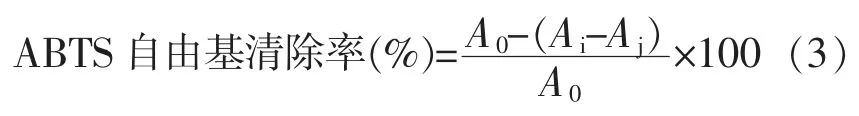
式中,A0——不加样品,加入ABTS 时的吸光度;Ai——加入样品和ABTS 的吸光度;Aj——加入样品,不加ABTS 的吸光度。
1.3.8 α-葡萄糖苷酶抑制活性的测定 将100 μL 样品与50 μL α-葡萄糖苷酶溶液(0.35 U/mL)混合均匀,在37 ℃孵育20 min。然后,向混合物中加入100 μL 1 mmol/L 对硝基苯基吡喃葡萄糖苷(底物),在37 ℃孵育30 min,然后,加入1 mol/L Na2CO3终止反应。在410 nm 波长处测定吸光度。α-葡糖苷酶抑制活性计算公式:

式中,Acontrol——对照组的吸光度值;Asample——加入样品的吸光度值。
2 结果与分析
2.1 甲鱼蛋冻干粉及<2.5 ku 降糖肽组分的色泽
色泽是影响活性成分在食品中应用的关键因素之一,消费者的第一视觉感受影响消费者的选择[12],未经过处理的原料甲鱼蛋冻干粉呈黄色,制备的<2.5 ku 降糖肽组分的粉末颜色呈黄绿色,粉末较其水溶液为无色透明。如表1所示,制备的<2.5 ku 降糖肽组分相比于未经处理的原料甲鱼蛋粉的L*、a*及b*值均有降低,其主要原因可能与蛋白酶的酶解作用有关,蛋白酶作用于蛋白质大分子被切割成小分子肽和氨基酸等,而生成的有色物质会使酶解液颜色变深,亮度降低[13]。

表1 甲鱼蛋冻干粉及<2.5 ku 降糖肽组分的色泽Table 1 Colour readings of soft-shelled turtle egg powder and its <2.5 ku hypoglycemic peptide fraction
2.2 消化前、后多肽含量的变化
以谷胱甘肽为标准品绘制标准曲线,其吸光值与浓度有较强的线性关系(图1),线性方程为y=0.0533x+0.0015,相关系数为0.9931。可根据此标准曲线计算样品溶液中多肽含量。
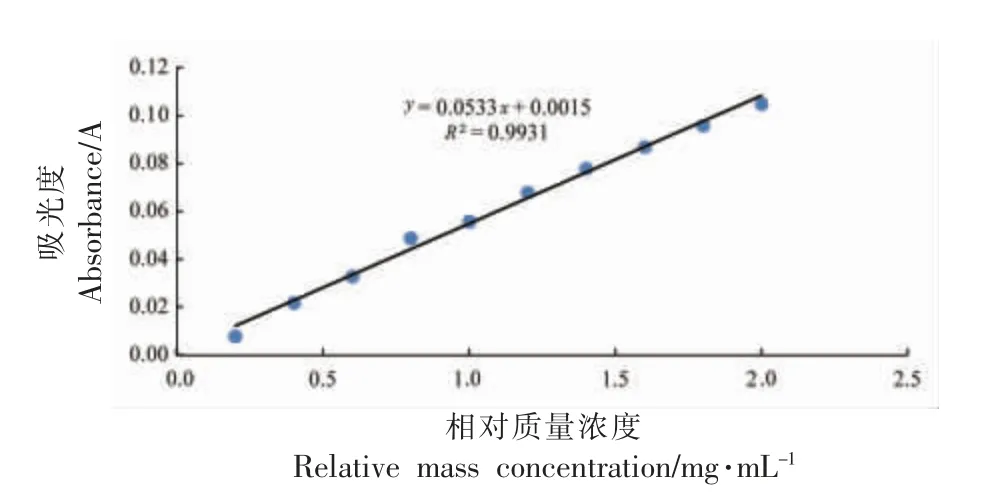
图1 多肽含量测定的标准曲线Fig.1 Standard curve for determination of peptide content
前期研究表明,甲鱼蛋蛋白经木瓜蛋白酶水解后<2.5 ku 组分具有潜在的降糖功效[10]。活性肽在胃肠道中易被蛋白酶降解,是决定其体内功效发挥的关键[14]。研究表明,胃肠道消化影响肽的生物活性存在双重性,即增强或降低其活性[15-16]。采用体外模拟胃肠道消化模型,探究甲鱼蛋<2.5 ku降糖肽组分的胃肠消化特性及经消化后是否仍有潜在的降糖活性。如图2所示,经胃及胃肠道消化后,<2.5 ku 组分所产生的肽含量显著增多(图2),提示该组分在胃肠道中不稳定,可进一步被胃及肠道中的蛋白酶降解产生更短的肽。
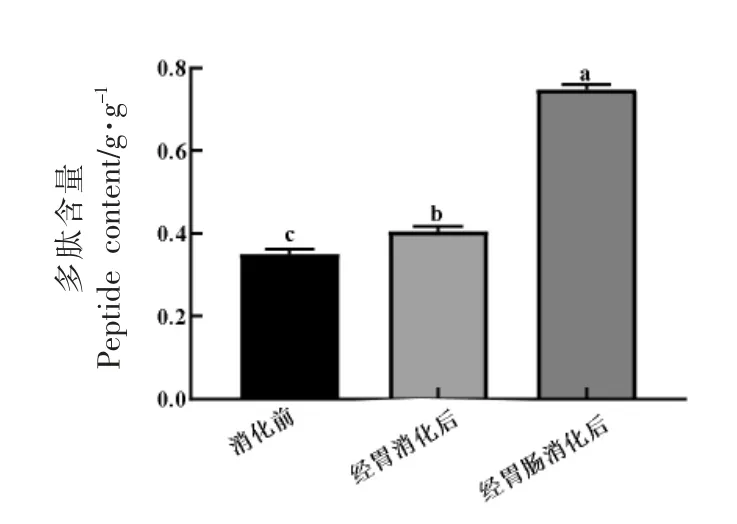
图2 胃及胃肠消化前、后<2.5 ku 组分的肽含量Fig.2 Peptide contents of <2.5 ku fraction before and after gastric and gastrointestinal digestions
2.3 消化前、后的酶解原液及不同分子质量组分的液相色谱图
尺寸排阻色谱是常用的蛋白质及肽分子质量测定方法。出峰时间越早,肽分子质量越大;出峰时间越晚,肽分子质量越小[17]。甲鱼蛋蛋白水解物、不同分子质量组分及<2.5 ku 组分经胃及胃肠消化后产物的分子质量分布见图3。未消化的甲鱼蛋蛋白水解原液中肽的分子质量较大,出峰时间集中在7~10 min;而<2.5 ku 组分中小分子质量肽的含量增加,12~17 min 的色谱峰明显增加,表明采用超滤法制备的<2.5 ku 组分中肽的分子质量符合预期,主要含小分子质量的低聚肽。
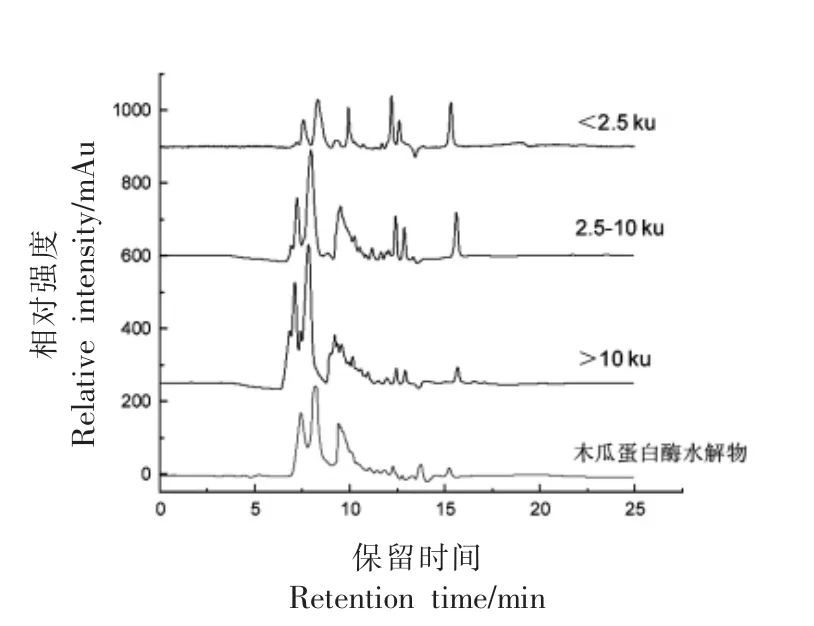
图3 酶解原液及不同分子质量组分的液相图Fig.3 Liquid phase diagram of enzymatic hydrolysate and different molecular weight components
生物活性肽的胃肠道消化特性部分取决于其分子质量,通常小分子质量的低聚肽不易被消化降解,而大分子质量多肽易被消化降解生成更短的肽[18-19]。甲鱼蛋<2.5 ku 组分经胃消化后,产物色谱峰的数量及峰面积变化不大,只在10.38 min 处出现一个新峰(图4),提示该组分在体外模拟胃消化中未被明显消化,在胃中的稳定性较好。此外,如图5所示,<2.5 ku 组分经胃肠道消化后,小分子质量低聚肽(12~17 min)的色谱峰变化不大,只在13 min 左右出现一个新峰。然而,大分子质量多肽(6~10.5 min)的色谱峰降低,甚至10 min左右色谱峰完全消失,相应地在11.46 min 左右出现一个新色谱峰,且响应值最高。以上结果表明,<2.5 ku 组分中大分子质量多肽不耐胃肠道消化,可被蛋白酶降解生成更短的肽,而小分子质量低聚肽耐胃肠道消化,几乎不被降解。
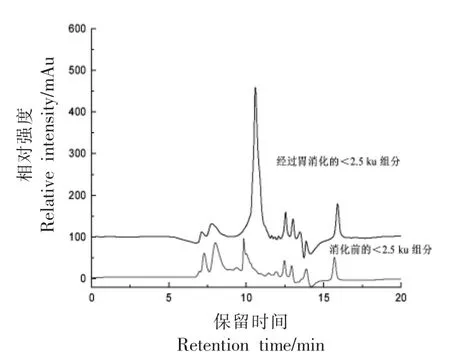
图4 胃消化前、后<2.5 ku 组分的液相色谱图Fig.4 HPLC chromatograms of <2.5 ku fraction before and after gastric digestions
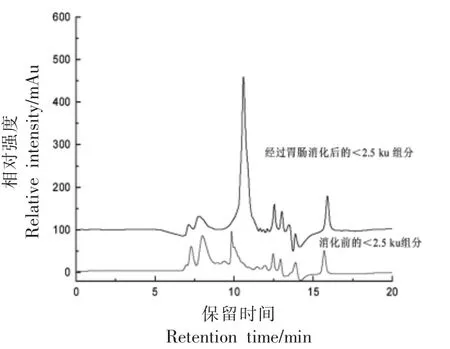
图5 胃肠消化前、后<2.5 ku 组分的液相色谱图Fig.5 HPLC chromatograms of <2.5 ku fraction before and after gastrointestinal digestions
2.4 消化前、后DPPH 自由基清除活性的变化
研究发现天然抗氧化剂用来治疗糖尿病具有较少副作用,对糖尿病的治疗具有重要意义。DPPH 法是一种快速、易于测定的抗氧化活性评估方法,其表示抗氧化能力的参数是DPPH 自由基清除率[20]。DPPH 是一种具有单电子的较为稳定自由基,其甲醇溶液呈紫色,在波长517 nm 处有强吸收。在DPPH 溶液中加入抗氧化剂可使其褪色,从而减小吸光度值,因此DPPH 清除率可通过测定OD 值的变化进行分析[21]。将甲鱼蛋<2.5 ku组分及其胃和胃肠消化产物分别做DPPH 分析,结果如图6所示。
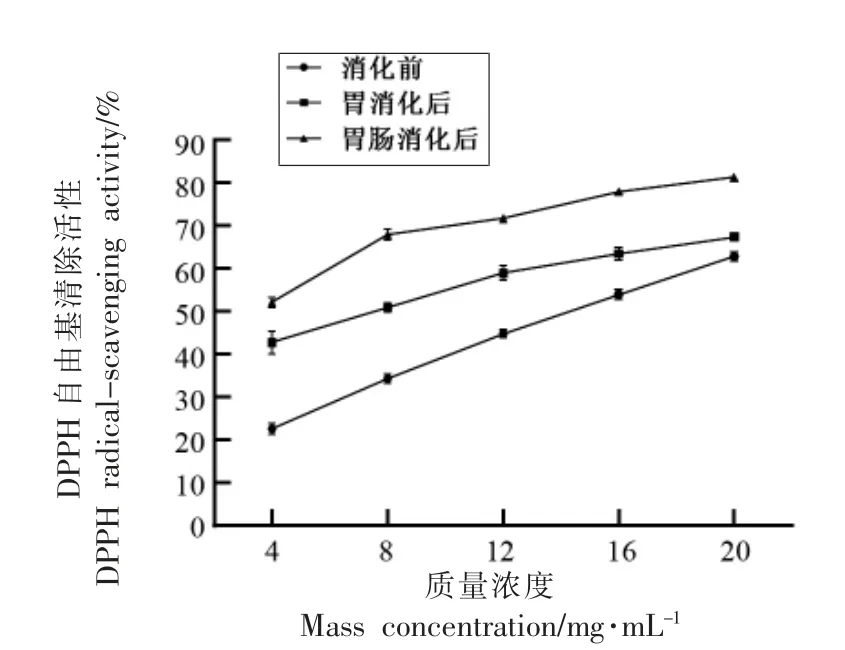
图6 胃及胃肠消化前、后<2.5 ku 组分的DPPH 自由基清除活性Fig.6 DPPH radical-scavenging activities of <2.5 ku fraction before and after gastric and gastrointestinal digestions
甲鱼蛋<2.5 ku 组分及其胃和胃肠消化产物均具有显著的DPPH 自由基清除活性,且随浓度的增加而线性增加。在相同浓度下,<2.5 ku 组分经胃及胃肠消化后DPPH 自由基清除活性提高了,其中以胃肠消化产物的活性最强。结合上述,<2.5 ku 组分具有良好的胃肠道消化特性,其经胃肠道消化产生的新肽具有更好的DPPH 自由基清除活性。研究表明,抗氧化肽的自由基清除能力归因于其含有酪氨酸、苏氨酸和丝氨酸等含羟基氨基酸以及蛋氨酸和半胱氨酸等含巯基氨基酸[22-23]。本研究中,<2.5 ku 组分经胃肠道消化后产生更多的含羟基及巯基氨基酸的抗氧化肽,从而呈现更好的DPPH 自由基清除活性。
2.5 消化前、后ABTS 自由基清除活性的变化
ABTS 是一种水溶性自由基,清除ABTS试验是体外抗氧化试验的经典之一,该试验具有一定的代表性,ABTS 阳离子自由基清除能力比DPPH 自由基清除能力更加灵敏[24],主要根据待测化合物清除ABTS+所引起的吸光度变化进行分析,将甲鱼蛋<2.5 ku 组分及其胃和胃肠消化产物分别做ABTS 分析,结果如图7所示,与DPPH 自由基清除活性相反,<2.5 ku 组分在消化前具有最高的ABTS 自由基清除活性,经胃及胃肠消化后活性均降低。
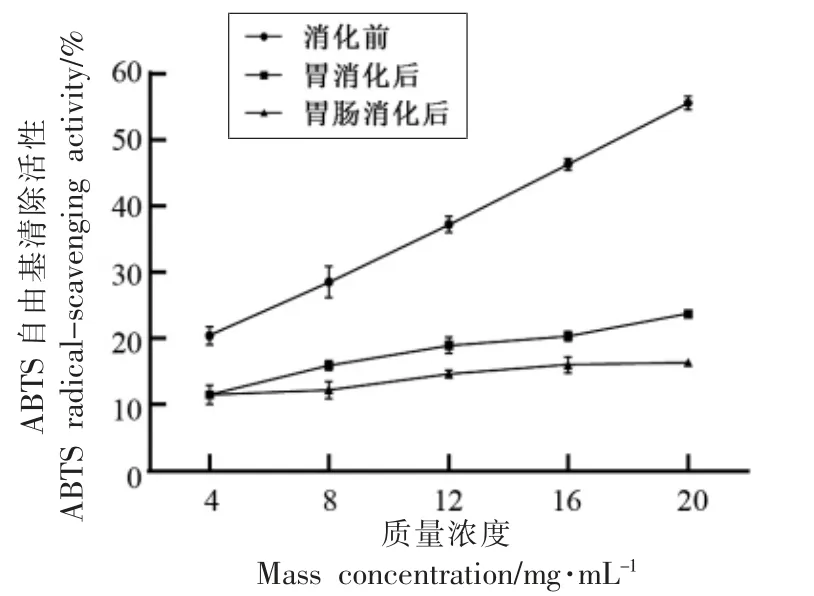
图7 胃及胃肠消化前、后<2.5 ku 组分的ABTS 自由基清除活性Fig.7 ABTS radical-scavenging activities of <2.5 ku fraction before and after gastric and gastrointestinal digestions
2.6 消化前、后α-葡萄糖苷酶抑制活性的变化
α-葡萄糖苷酶是催化碳水化合物最后一步消化的关键酶,其活性与餐后高血糖的发生密切相关[25]。α-葡萄糖苷酶水解低聚糖或二糖为可吸收的单糖,促进碳水化合物的吸收。当其活性被抑制时,能有效降低碳水化合物的消化达到降低糖的目的。因此,α-葡萄糖苷酶抑制剂可通过延缓膳食中碳水化合物的消化来有效降低餐后高血糖,实现对餐后葡萄糖的控制,是糖尿病防治的一线药物[26]。因此,可以通过测定α-葡萄糖苷酶抑制活性评价甲鱼蛋<2.5 ku 组分及其胃和胃肠消化产物的降糖作用。如图8所示,<2.5 ku组分具有明显的α-葡萄糖苷酶抑制活性;胃及胃肠道消化均可显著提高其抑制活性,其中胃肠道消化后产物在低质量浓度(4 mg/mL)下表现很高的抑制活性(80%左右)。
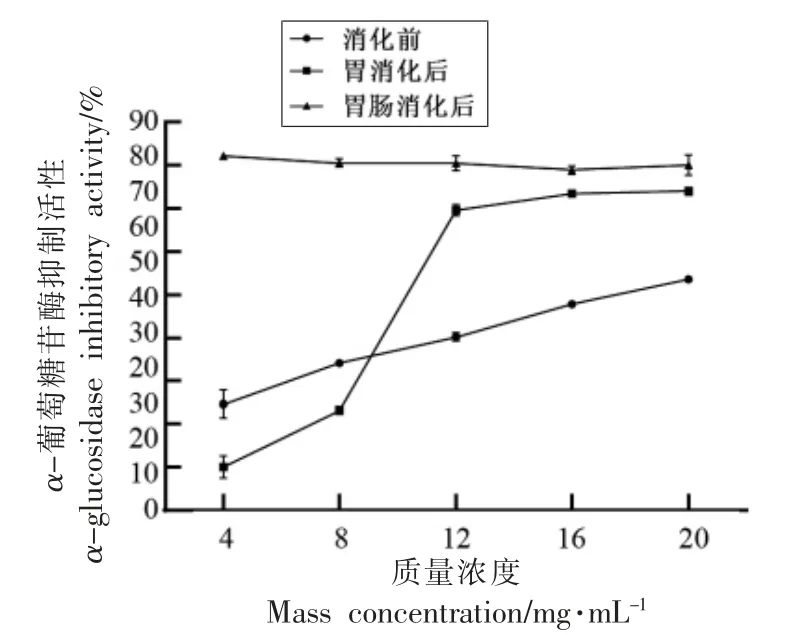
图8 胃及胃肠消化前、后<2.5 ku 组分的α-葡萄糖苷酶抑制活性Fig.8 α-Glucosidase inhibitory activities of <2.5 ku fraction before and after gastric and gastrointestinal digestions
计算自由基清除及α-葡萄糖苷酶抑制的IC50,其值越小活性越强,结果见表2。与消化前相比,胃及胃肠道消化可显著提高<2.5 ku 组分的DPPH 自由基清除及α-葡萄糖苷酶抑制活性,然而,降低了ABTS 自由基清除活性,其中,胃肠消化产物具有出色的DPPH 自由基清除及α-葡萄糖苷酶抑制活性,其IC50值较低,低于文献报道的α-葡萄糖苷酶抑制肽 (RVPSLM,来自鸡蛋清蛋白)[27]。此外,植物化学物(比如黄酮类化合物)被认为是安全、有效的α-葡萄糖苷酶抑制剂[28]。对比文献报道的来源于天然植物化学库中的α-葡萄糖苷酶抑制剂,如虾青素、花青素、儿茶素等[29-31],本研究中<2.5 ku 组分的胃肠道消化产物呈现极为显著的α-葡萄糖苷酶抑制活性,其α-葡萄糖苷酶抑制率达80%左右。
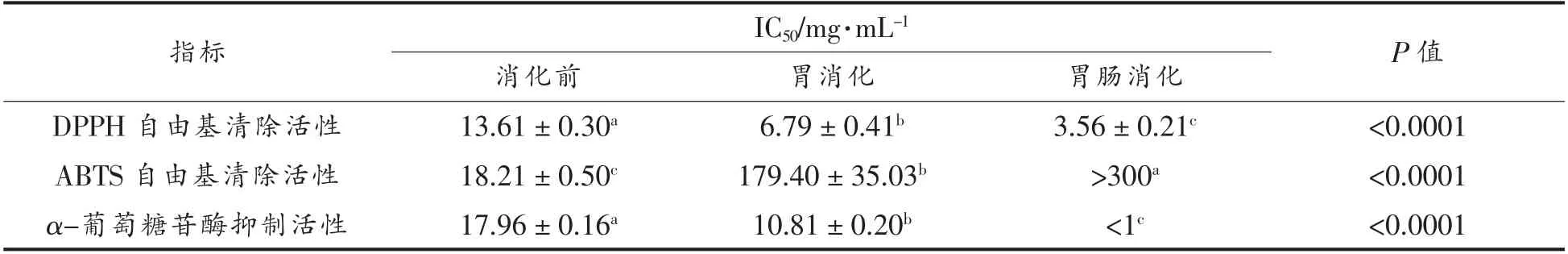
表2 DPPH、ABTS 自由基清除及α-葡萄糖苷酶抑制的IC50 值Table 2 IC50 values of activities for DPPH,ABTS radical-scavenging and α-glucosidase inhibition
3 结论
木瓜蛋白酶可有效水解甲鱼蛋蛋白,通过超滤法可明显富集分子质量<2.5 ku 的降糖组分。此方法制备的甲鱼蛋<2.5 ku 组分具有良好的色泽(黄绿色),在胃中稳定,然而,不耐胃肠消化,在胃肠道中被消化产生更短的肽。胃肠道消化显著提高了<2.5 ku 降糖组分的DPPH 自由基清除及α-葡萄糖苷酶抑制活性。消化产物仍具有较强甚至更好的降血糖潜力。

