黑木耳醇提物对高脂肥胖小鼠肝脏和肠道菌群的调节作用
刘培培,武少兰,吴敏文,杨成龙,江玉姬,4,陈炳智,4*
(1 福建农林大学食品科学学院 福州 350002 2 福建省福州市农业局 福州 350000 3 福建省农业科学院农业工程技术研究所 福州 350001 4 福建农林大学菌物研究中心 福州 350002)
我国黑木耳产量丰富,占全世界总产量的90%以上[1]。作为一种食用真菌,黑木耳(Auricularia heimuer)因味道鲜美、营养价值和药用价值高而受到消费者的青睐,其富含蛋白质、氨基酸、黑色素、黄酮、多酚等多种营养成分[2],具有抗氧化、抑菌、降血糖、抗凝血等多种功能[3-4],在食品和功能产品的研发方面具有实际的应用价值。
肥胖(Obesity)是一种慢性的非传染性疾病,当机体获得的能量大于消耗的能量时,过量的脂肪就会在体内堆积,引发脂质代谢紊乱等问题,从而对机体健康产生不良影响[5]。肝脏为调节糖代谢、脂质代谢的重要器官,与肥胖有着密切的联系,肥胖会使过量的肝脏脂质在体内沉积,从而导致肝细胞发生脂质过氧化,影响肝脏的正常功能[6-7]。肠道微生物在促进人体消化吸收、新陈代谢、抑制病原菌等生命活动中有重要作用,已有实验证明,肠道菌群与人类肥胖有着一定的联系[8]。高脂饮食会降低小鼠体内肠道菌群的丰富度和多样性,改变菌群结构组成,从而引发宿主代谢的失调,最终诱导肥胖的发生[9-10]。
某些天然提取物具有抑制肥胖的功效,黑木耳子实体中富含活性物质,在预防和治疗肥胖方面有一定的潜力。本研究采用高脂饲料喂养小鼠,建立小鼠高脂模型,研究黑木耳醇提物对高脂肥胖小鼠体质量、肝脏功能以及肠道菌群的影响,以期为开发黑木耳功能食品提供实验依据。
1 材料与方法
1.1 材料与仪器
黑木耳子实体 (Auricularia heimuer fruiting body)由北大荒营销股份有限公司提供,新鲜黑木耳经清洗、晒干,未经化学处理。
奥利司他胶囊,鲁南制药集团。
无水乙醇(分析纯),西陇科学股份有限公司;福尔马林,北京兰杰柯科技有限公司;血清葡萄糖(GLU)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、甘油三酯(TG)试剂盒,南京建成生物工程研究所。
BSA224S 电子分析天平,北京赛多利斯科学仪器有限公司;LGJ-12 真空冷冻干燥机,北京松源有限公司;BA210T 显微镜,Motic 麦克奥迪实业集团有限公司;M199 切片刀,德国莱卡公司;YD-315 切片,机浙江金华益迪试验器材。
1.2 实验动物
5 周龄雄性ICR 小鼠由上海斯莱克实验动物有限责任公司提供,体质量(15±2)g,动物合格证为SCXK(沪)2017-0005。
1.3 实验方法
1.3.1 黑木耳醇提物以及饲料的制备 黑木耳醇提物参照黄琳翔等[11]研究的工艺流程进行提取。动物饲料(基础饲料和高脂饲料),闽侯县吴氏实验动物贸易有限责任公司。
1.3.2 动物实验设计 72 只5 周龄健康雄性ICR小鼠同室分笼饲养,第1 周使用基础饲料饲喂,使小鼠适应实验环境。1 周后,小鼠随机分为正常对照组(CK)、高脂组(HFD)、阳性药物对照组(PD)、AHA 低剂量组 (LC)、AHA 中剂量组(MC)、AHA高剂量组(HC),共6 组,每组12 只小鼠。
CK 组用基础饲料饲养,HFD、PD、LC、MC、HC组用高脂饲料饲养,待高脂组小鼠的体质量显著高于空白组小鼠体质量时,即造模成功[12]。所有动物实验均遵照“实验动物护理和使用指南”进行。
待小鼠体质量升至(20±2)g 时,灌胃,固定每天的灌胃时间,灌胃剂量为0.1 mL/10 g,CK 组和HFD 组每日灌蒸馏水;阳性药物对照组灌胃奥利司他,浓度为50 mg/kg bw;AHA 低剂量组灌胃浓度为150 mg/kg bw;AHA 中剂量组灌胃浓度300 mg/kg bw;AHA 高剂量组灌胃浓度为600 mg/kg bw。
1.3.3 小鼠样品的收集 第9 周实验结束,小鼠不断水,但禁食12 h,眼球采血后进行脱颈处死,收集血液后进行解剖,取下小鼠肝脏、脾、肾脏组织、皮下脂肪、附睾脂肪,用0.9%生理盐水清洗干净后称重;用于组织切片分析的肝脏储存在10%福尔马林中;小鼠盲肠样本收集后于-80 ℃冰箱保存备用。
1.3.4 小鼠生理生化指标的检测
1.3.4.1 小鼠体质量和Lee's 指数 每天对小鼠定时称重,每周进行体长测量(鼻尖至肛门距离),Lee's 指数按公式(1)计算[13]。
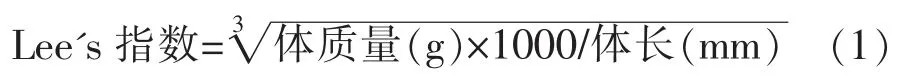
1.3.4.2 小鼠脏器指数 肝脏、脾、肾脏、附睾脂肪、皮下脂肪称重后,按公式(2)计算脏器指数[14]。

1.3.4.3 小鼠血清葡萄糖含量的测定 将1.3.3节采集的小鼠血液室温静置0.5 h 后,4 ℃,5000 r/min 离心10 min,吸取上清液,根据南京建成试剂盒的操作步骤,测定小鼠血清中GLU 的含量。
1.3.4.4 小鼠肝脏指标的测定 用生理盐水将部分肝脏清洗后,按9 mL/g 加入无水乙醇,在冰浴下进行充分匀浆后离心10 min (4 ℃,5 000 r/min),取上清液为待测样品,采用试剂盒测定小鼠肝脏中TC、TG、HDL-C、LDL-C 的浓度。
1.3.4.5 小鼠肝脏切片分析 将处理好的小鼠肝脏样品委托生工生物工程股份有限公司进行制片、染色和显微观察。
1.3.5 小鼠肠道菌群分析测定 将1.3.3 节采集的盲肠待测样品交派迈特维尔生物科技有限公司进行菌群鉴定分析。
1.4 统计方法
所有数据统计分析和比较用SPSS 16.0 软件,以P<0.05 为显著差异,以P<0.01 为极显著差异。
2 结果与分析
2.1 AHA 对小鼠体质量和Lee's 指数的影响
整个实验过程中,小鼠生长和精神状况良好,无异常死亡。图1显示了不同组别小鼠的体质量变化情况。从图1中可以得出,经过1 周适应期后,各组小鼠体质量无显著性差异(P>0.05)。灌胃1 周后,与CK 组相比,HFD 组小鼠的体质量增加了3.16 g,二者之间有显著差异(P<0.05),说明长期高脂饮食使得小鼠体质量增加和脂肪堆积[15],从而造模成功;灌胃3 周后,HFD 组、PD 组、LC组、MC 组、HC 组与CK 组体质量分别相差5.11,2.44,2.40,3.00,0.29 g,HFD 组与CK、HC 组之间呈极显著差异(P<0.01),与MC 组、PD 组之间有显著差异(P<0.05);实验结束时,与CK 组相比,HFD 组、PD 组、LC 组、MC 组、HC 组的体质量分别增加了9.43,3.17,3.78,4.15,1.57 g,HFD 组体质量极显著高于CK 组(P<0.01),与HFD 组相比,3 个剂量处理组和PD 组均有效抑制了小鼠体质量的增加(P<0.01),表明AHA 提取物和药物干预均有预防小鼠营养性肥胖的功效。
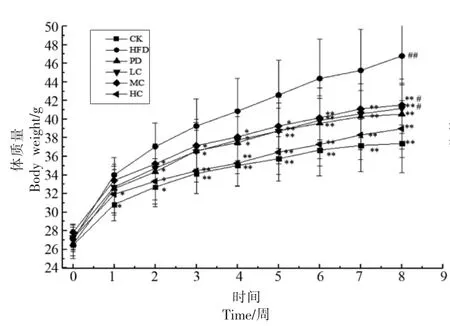
图1 不同组小鼠体质量变化情况Fig.1 Changes of body weight in different groups of mice
图2为不同组小鼠Lee's 指数变化情况。从图2可知,Lee's 指数的变化趋势呈逐渐增加,这与体质量变化趋势一致。灌胃初始各组小鼠Lee's 没有明显的差异(P>0.05);随着灌胃时间的延长,CK组与HFD 组差异开始达到显著水平(P<0.05),第2 周,二者差异极显著(P<0.01);灌胃6 周后,AHA处理后的小鼠Lee's 指数极显著低于HFD 组(P<0.01),说明AHA 有抑制小鼠体长增加的效果。上述结果表明AHA 干预可降低小鼠体质量的增量,且呈剂量依赖性,高剂量组的效果最好。
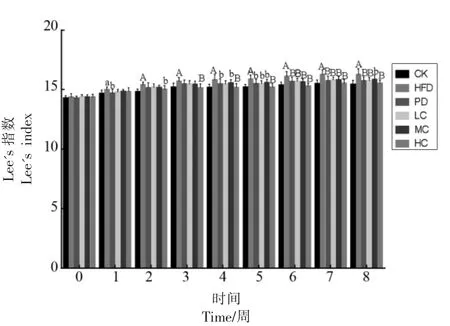
图2 小鼠LEE'S 指数变化Fig.2 Changes of Lee's index in mice
2.2 AHA 对小鼠脏器指数的影响
图3显示不同组小鼠的脏器指数变化。由图3a 可知,HFD 组小鼠附睾脂肪指数极显著高于CK 组(P<0.01),表明高脂饮食增加了小鼠附睾脂肪指数;PD 组和AHA 处理组小鼠附睾脂肪指数显著低于HFD 组(P<0.05),且AHA 降低效果呈现剂量依赖性。由图3b 可知,HFD 组的皮下脂肪指数显著高于CK 组(P<0.01),而PD 组、LC 组、MC 组和HC 组均能降低皮下脂肪指数,其中MC组、PC 组与HFD 组有显著性差异(P<0.05)。小鼠肝脏指数可以反映肝脏的损伤程度[16]。由图3c 可知,HFD 组的肝脏指数明显高于CK 组(P<0.01),表明高脂饮食会导致脂肪积累,加重肝脏负担和病变;而PD 组、AHA 处理的肝脏指数显著低于HFD 组(P<0.01),表明阳性药物处理和AHA 处理均能够降低营养型肥胖小鼠的肝脏指数,改善肝损伤,保护肝脏组织。由图3d 和图3e 可知,HFD小鼠肾脏和脾脏指数增加不显著 (P>0.05),PD组、AHA 处理组也无显著变化,与文献报道一致[17]。
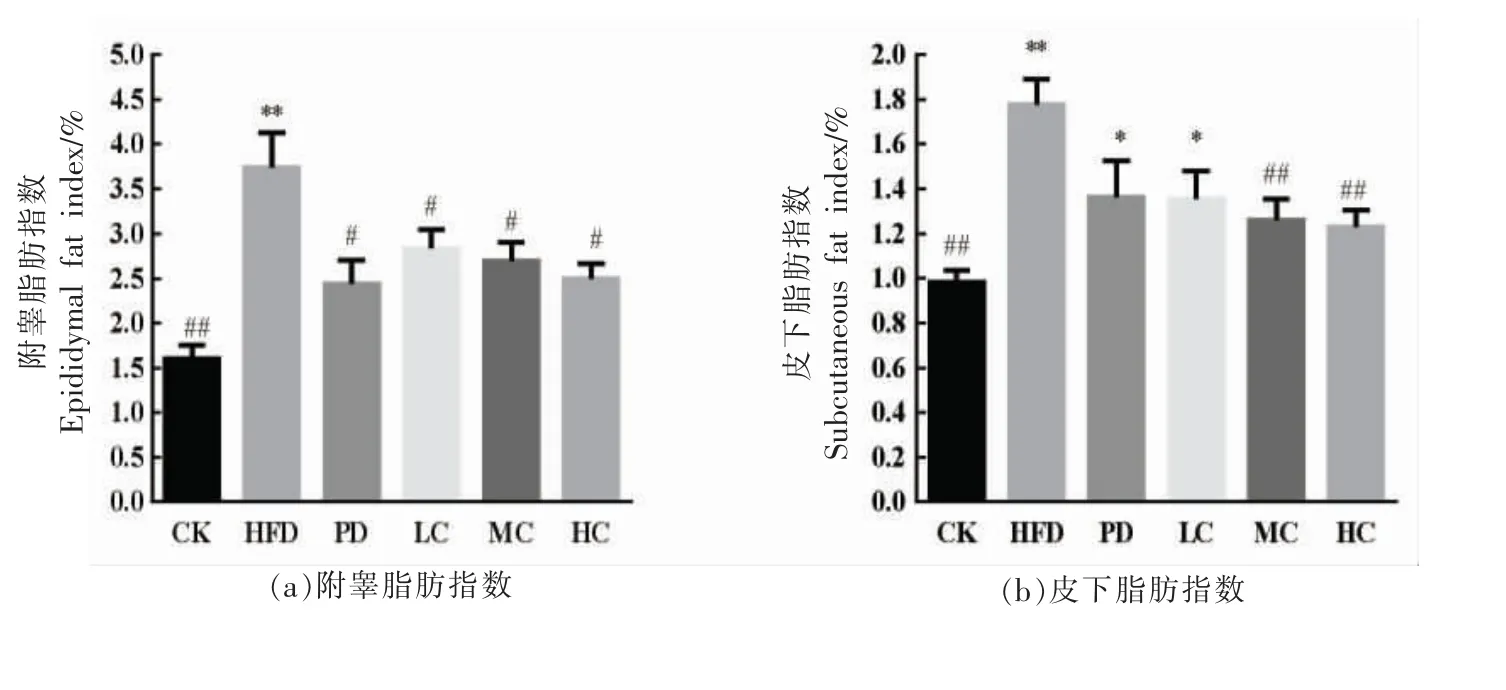
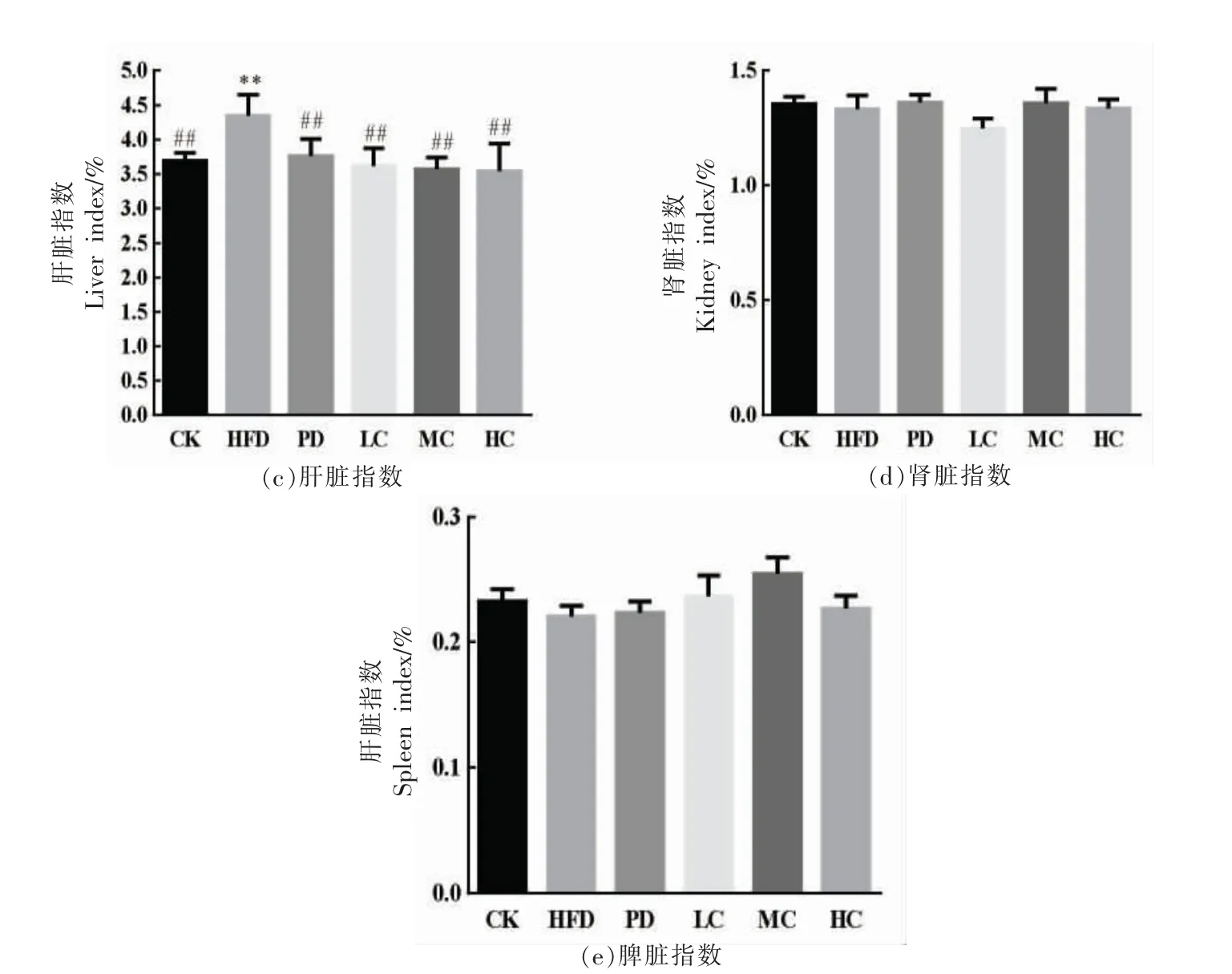
图3 不同组的小鼠脏器指数Fig.3 Organ index of mice in different groups
以上数据表明,与CK 组相比,HFD 组对肝脏产生明显的损害作用,而AHA 处理能有效降低营养型肥胖,改善肝脏组织,降低肝脏的损伤程度,对肝脏具有一定的保护作用。
2.3 AHA 对小鼠血清葡萄糖含量的影响
肝脏是维持全身葡萄糖(GLU)稳定的重要器官,肥胖症患者往往伴随着GLU 含量的升高,引起血脂异常,因此测定血清中葡萄糖含量对判断机体健康具有十分重要的意义[18]。由图4可知,HFD 组血清GLU 含量极显著高于其余各组 (P<0.01),表明高脂饮食会显著提高小鼠的血糖水平;而AHA 处理组均能够显著降低血清GLU 浓度,且降低效果与AHA 有剂量依赖性,其中HC组降血糖效果与PD 组接近,说明AHA 具有降血糖功效。
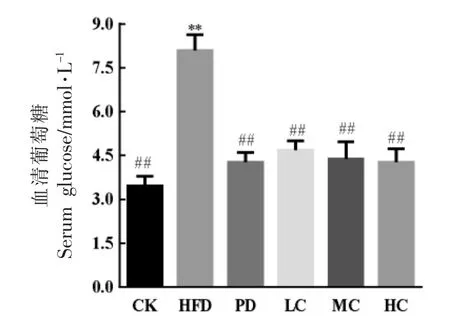
图4 不同组小鼠血清中的葡萄糖含量Fig.4 Contents of GLU in serum of different groups of mice
2.4 AHA 对小鼠肝脏指标的影响
由图5a 可知,与CK 组相比,HFD 显著增加了小鼠肝脏中TC 含量(P<0.05),表明高脂饮食会增加小鼠肝脏中TC 含量,与HFD 组相比,HC 高剂量组能够显著降低肝脏中TC 的含量(P<0.01)。由图5b、图5c 可知,HFD 组小鼠肝脏中的TG 含量、LDL-C 含量明显高于CK 组(P<0.01),而AHA组小鼠肝脏内的TG 含量、LDL-C 含量均比HFD组低,说明AHA 能够显著降低肥胖小鼠肝脏内的TG 含量、LDL-C 含量 (P<0.01)。由图5d 可知,HFD 组中的HDL-C 含量显著低于CK 组 (P<0.01),表明高脂会导致小鼠肝脏内HDL-C 含量的降低,与HFD 组相比,LC 组、MC 组无差异(P>0.05),而HC 组能够显著提高肝脏中HDL-C 含量(P<0.05)。
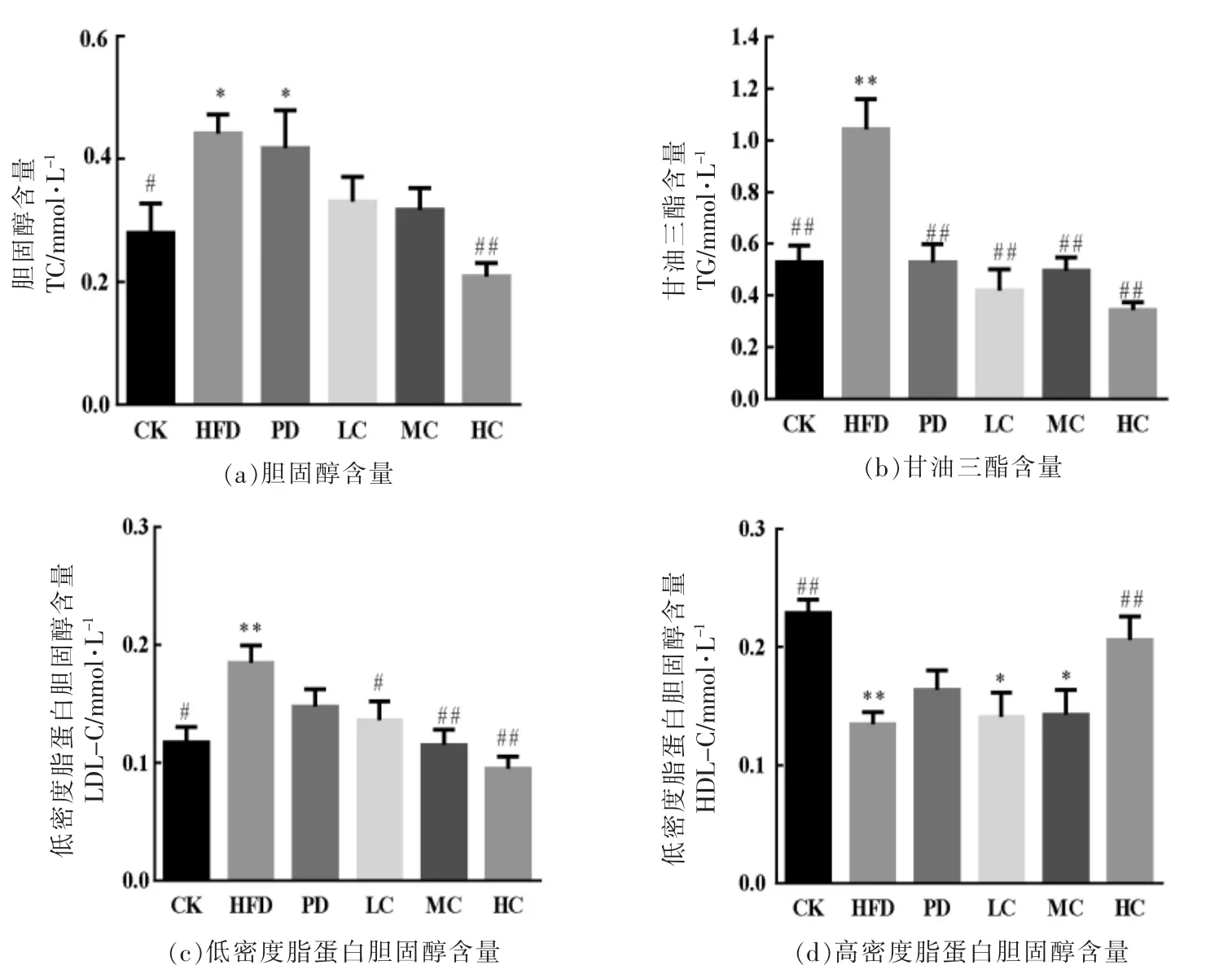
图5 不同组小鼠肝脏4 项的含量Fig.5 Contents of four items in liver of different groups of mice
以上数据表明,高脂饮食会增加小鼠肝脏中TC、TG 和LDL-C 的含量,而AHA 则能够降低这些物质的含量,且HC 组能够提高肝脏中HDL-C的含量,对防止脂肪代谢紊乱有一定功效。
2.5 AHA 对小鼠肝脏细胞形态的影响
HE 染色结果如图6所示,CK 组小鼠肝脏细胞大小基本一致且结构完整,细胞核清晰、可见并位于细胞中央;HFD 组小鼠肝脏细胞核模糊,细胞明显增大,肝脏组织中积累大量脂滴,且有脂肪空泡,这表明高脂饮食会破坏小鼠肝脏脂质代谢,从而造成大量脂肪在肝脏中积累。在AHA 组中,可以看到随着剂量的增大,小鼠细胞核逐渐清晰,脂肪细胞变小,脂滴减小,脂肪空泡也明显减少,其中AHA 高剂量组的脂肪细胞与CK 组相近,表明AHA 处理组能够抑制小鼠脂肪肝形成。综上,通过动物肝脏细胞病理切片可知,AHA 处理组的脂肪空泡明显减少,细胞排列较整齐,在抑制脂肪肝和肝脏脂肪积累方面有明显效果,能有效改善肝脏组织,减轻病变程度,对高脂饮食小鼠的肝脏具有明显的保护作用。
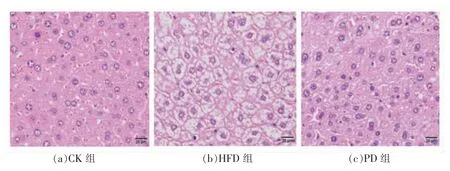
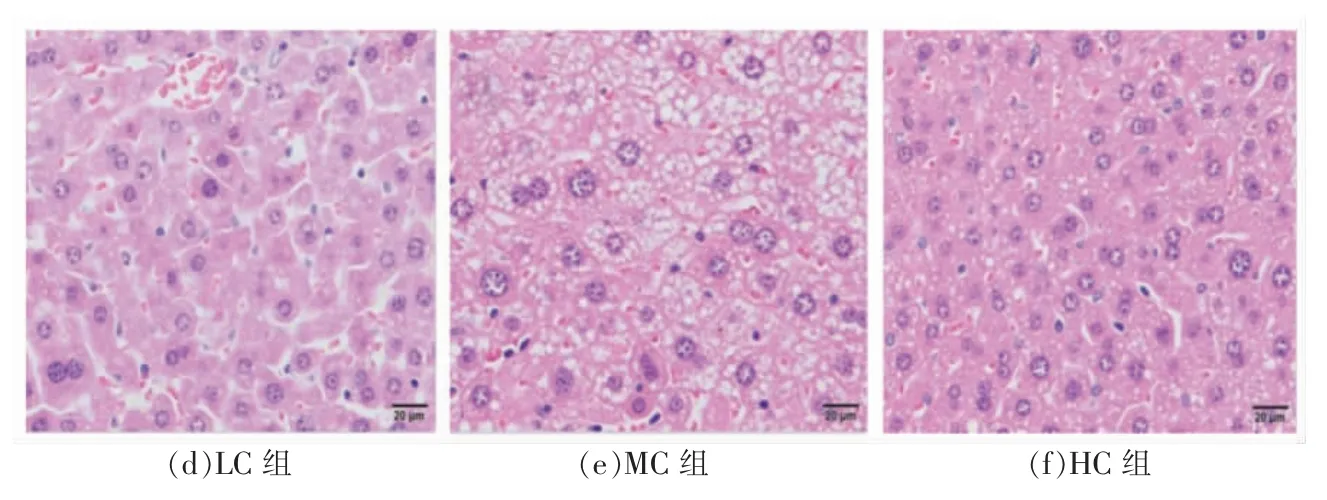
图6 黑木耳醇提物对小鼠肝脏组织形态的影响(HE 染色400×)Fig.6 Effect of AHA on histomorphological of the live of mice (HE staining 400×)
2.6 AHA 对小鼠肠道菌群的影响
2.6.1 OTU Venn 图分析 对样本的Effective Tags 在97%的一致上进行OTUs 聚类和物种注释,结果见图7,CK 组与HFD 组共有的OTU 数量为1 558,与HC 组共有的OTU 为153;HFD 组与HC 组共有的OTU 数量为1 850,说明HFD 组和HC 组的OTU 相似性和重叠性更高,高脂饮食在一定程度上改变了小鼠肠道菌群的组成。
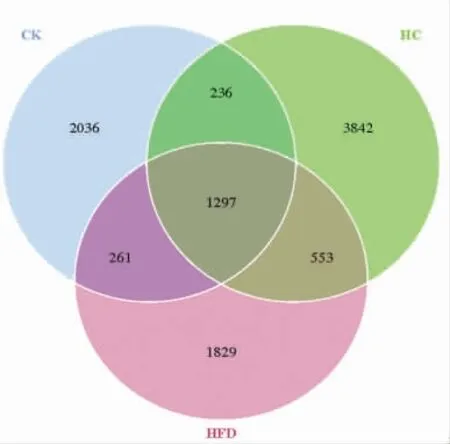
图7 3 组样本的韦恩图Fig.7 Venn diagram in three samples
2.6.2 Alpha 多样性分析 小鼠肠道菌群变化情况可用Shannon、Simpson、Chao1 指数分析。从表1可以看出,CK 组、HFD 组、HC 组的Coverage 指数分别是0.996,0.995,0.992,说明该测序结果真实可靠[19]。HFD 组的Simpson 和Shannon 指数较CK组略有降低,而Chao1 指数有所增加,表明高脂饮食在一定程度上降低了小鼠肠道菌群多样性,与魏建敏等[20]研究结果相似;经AHA 处理后,与CK组、HFD 组相比,HC 组肠道微生物多样性最高,说明AHA 干预可调节高脂饮食小鼠肠道微生物的多样性。
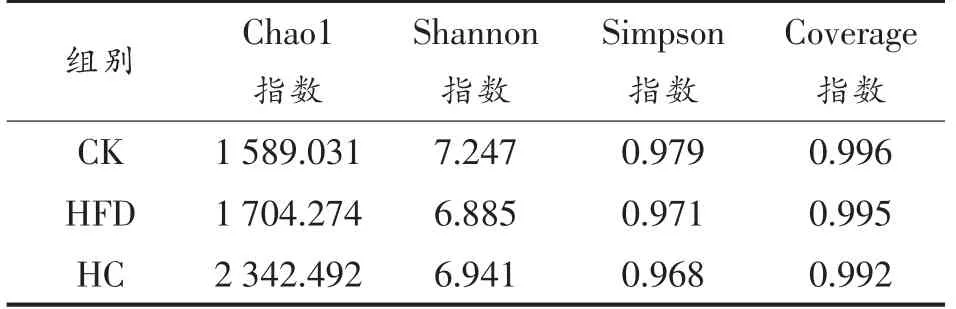
表1 各组小鼠样本中α 多样性指数Table 1 Alpha diversity index of each group
2.6.3 菌群结构分析 由图8可知,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria) 是3 组小鼠样本在门水平上的主要优势菌群。厚壁菌门和拟杆菌门是人体肠道内的优势有益菌,与CK 组相比,高脂饮食降低了小鼠肠道菌群厚壁菌门和拟杆菌门的相对丰度,经过AHA 干预,厚壁菌门和拟杆菌门有所增加,而差异不显著 (P>0.05),推测是AHA 添加量的原因,后续将做进一步研究;与CK 组相比,HFD 显著增加了小鼠肠道菌群变形菌门的相对丰度(P<0.05),变形菌门多数属于致病菌,表明高脂饮食会损害正常小鼠肠道菌群,而经HC 处理后该菌群涨幅不大,与模型对照组无显著差异(P>0.05),说明AHA 对高脂饮食小鼠的肠道菌群有调节作用,并能抑制部分有害菌的生长。
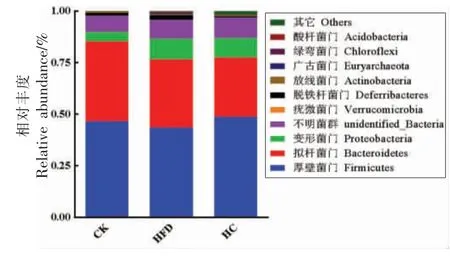
图8 样本群落结构在门水平分布图Fig.8 Community structure distribution of sample in phylum level
根据类群注释结果,在属层面分析了各类群的丰度。属水平上的物种相对丰度柱形图如图9所示。3 组小鼠样本的优势菌属主要有螺杆菌属(Helicobacter)、拟杆菌属(Bacteroides)、毛螺旋杆菌属(Lachnospiraceae_NK4A136_group)、另枝菌属(Alistipes)。与CK 组相比,HFD 组拟杆菌属的相对丰度极显著增加(P<0.01),而经AHA 干预,小鼠肠道菌群中拟杆菌属的相对丰度显著降低(P <0.01);Lachnospiraceae_NK4A136_group 属是有益菌属,与CK 组相比,高脂饮食降低了小鼠Lachnospiraceae_NK4A136_group 的相对丰度,而经过AHA 处理,Lachnospiraceae_NK4A136_group的相对丰度有所增加,以上结果说明AHA 对高脂饮食引起的小鼠肠道菌群结构组成紊乱具有积极的调节作用。
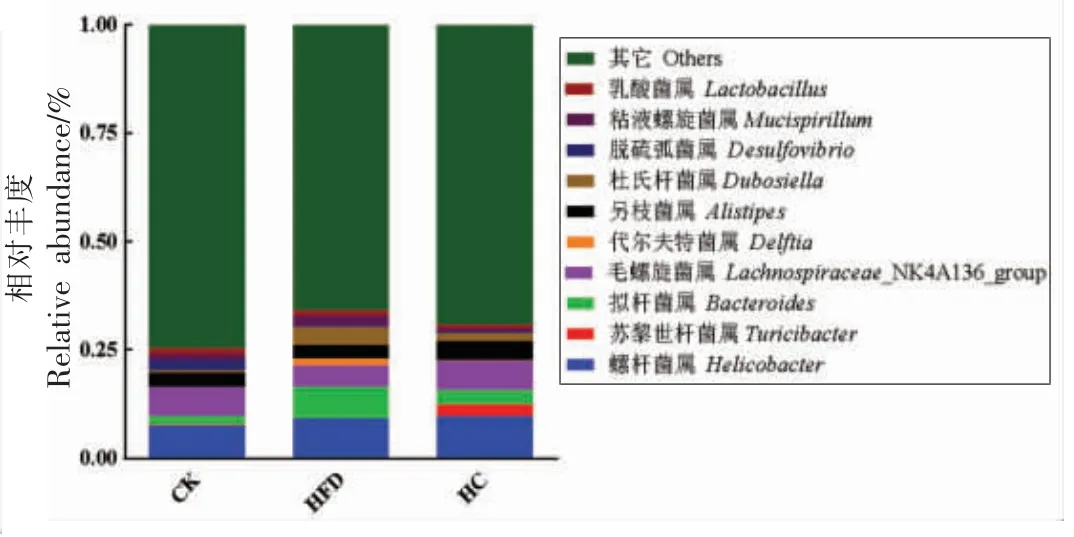
图9 样本群落结构在属水平分布图Fig.9 Community structure distribution of sample in genus level
3 结论
黑木耳具有多种活性物质,其醇提物的主要活性成分是黄酮和多酚类物质[21-22]。本研究通过高脂膳食建立高脂小鼠模型,研究了黑木耳醇提物对小鼠肥胖的抑制作用,肝脏功能以及肠道菌群的影响,主要结论如下:
高脂肥胖小鼠经AHA 干预后,小鼠体质量和体长的增加得到抑制,说明黑木耳醇提物具有抑制肥胖的功效,这与郭彤彤等[23]对乌龙茶中多酚的研究结果相似。对小鼠肝脏指标的观察发现:AHA 处理显著降低了小鼠附睾脂肪指数、皮下脂肪指数和肝脏指数,肝脏中的TG、TC 和LDL-C含量也显著降低,且高剂量处理能显著增加肝脏中HDL-C 的浓度。经AHA 处理,高脂肥胖小鼠血清中GLU 含量显著降低,说明黑木耳醇提物具有较显著的降血糖功效。刘天一等[24]的研究也发现黑木耳醇提物在体外具有抗氧化和抑制α-淀粉酶活性的效果,这与前期体外试验结果一致[11]。王方杰等[25]发现胡柚黄酮对减轻高脂饮食引起的肝脏病变等问题有一定改善作用,本实验对肝脏细胞染色观察发现:AHA 处理能够减少脂肪积累,抑制脂肪肝的形成,具有改善肝脏组织,减轻肝脏病变程度的作用,与上述王方杰等[25]的研究结果一致,由此推测AHA 中的黄酮物质对于肝脏损伤具有缓解作用,可进一步深入研究。
高脂膳食会影响人体肠道菌群的结构与功能,而肠道菌群对人体的脂代谢平衡具有重要作用,与肥胖的发生具有密切关系[26]。本实验中,高脂饮食改变了小鼠肠道菌群的丰度及结构组成,这与彭买姣等[27]研究高脂饮食对肠道微生物影响的结果是一致的,多酚和黄酮能够改善肠道的生态平衡[28-29],而AHA 干预对高脂肥胖小鼠肠道菌群的丰度和结构具有积极的调节作用,并能抑制部分有害菌的生长,推测可能是黄酮和多酚共同作用的结果。由于机体肠道菌群结构十分复杂,本文只分析了门和属水平上相对丰度较高的优势菌种,还有大部分肠道菌群有待分析,需要进一步深入研究。
综上所述,黑木耳醇提物在抑制高脂肥胖,改善肝损伤,维持肝脏功能以及调节肠道菌群结构组成方面,具有积极作用,后续将对黑木耳醇提物改善肝损伤的机制进行深入研究,为黑木耳深加工提供理论依据。

