甜瓣子中生物胺产生菌株和降解菌株的筛选
李 恒,王泽亮,邓维琴,范智义,李雄波,王钰潞,李洁芝,张其圣,2*
(1 四川省食品发酵工业研究设计院有限公司 成都 611130 2 四川东坡中国泡菜产业技术研究院 四川眉山 620030 3 江南大学 江苏无锡 214000)
甜瓣子发酵将为豆瓣酱提供丰富的游离氨基酸、有机酸、挥发性风味物质及多种发酵微生物,是郫县豆瓣生产的重要阶段之一。目前,甜瓣子多采用高盐度发酵,发酵的盐度通常为12%~17%,成品豆瓣酱的盐度高达16%~20%[1]。研究表明摄入过量的盐分,可能会引起心脑血管、高血压等疾病[2]。目前我国每人每天平均膳食盐摄入量为(14.53 ± 11.04)g[3],远超过世界卫生组织(WHO)推荐摄入量5 g/d。豆瓣酱等高盐调味品为我国膳食盐分摄入的主要来源,低盐化已成为其发展的必然趋势。对甜瓣子发酵低盐化的研究具有重要意义。
低盐发酵甜瓣子因体系盐度较低,其游离氨基酸种类及含量相对较多,且发酵体系pH 值相对较低,故极易造成生物胺等有害物质积累[4]。生物胺是氨基酸在氨基酸脱羧酶的作用下脱羧生成的一类碱性次生代谢产物,过量摄入将造成一定的安全风险[5-6]。使用生物技术控制发酵食品中生物胺含量已有较广泛的研究,如Kung 等[7]、OH 等[8]、Guo 等[9]均对发酵食品中降解生物胺微生物进行筛选,并研究相关菌株的降解生物胺能力。然而,针对低盐发酵甜瓣子体系中产生物胺的菌株及降解菌株的研究相对较少。本研究采用荧光检测定性分析和高效液相色谱法定量分析,筛选甜瓣子中产生物胺和降解生物胺的菌株,并进行回接验证,分析含盐量和降胺菌株对甜瓣子产品安全性的影响,以期为低盐甜瓣子生物胺含量的控制提供参考。
1 试验材料
1.1 试剂与仪器
丹磺酰氯、1,7-二氨基庚烷、脯氨酸、鸟氨酸、精氨酸、赖氨酸、酪氨酸、苯丙氨酸、色氨酸、组氨酸、5-磷酸吡哆醛、硫胺素均为化学纯,上海源叶生物科技集团股份有限公司;腐胺、尸胺、酪胺、苯乙胺、组胺、色胺、精胺、亚精胺均为色谱纯,上海源叶生物科技集团股份有限公司;氯化钠、乙腈、乙醚、七水合硫酸镁、硫酸锰、硫酸亚铁、磷酸氢二钾均为分析纯,成都科隆化工有限公司;Ezup 柱式真(细)菌基因组DNA 抽提试剂盒,生工生物工程股份有限公司。
126-Ⅱ高效液相色谱,安捷伦科技有限公司;凝胶成像仪,君意电泳有限公司;H2050R-1 离心机,长沙高新技术产业开发区湘仪离心机仪器有限公司;DZKW-4 恒温水浴锅,北京中兴伟业仪器有限公司;ESJ200-4A 型分析天平,沈阳龙腾电子有限公司;SPX-150B-4 生化培养箱,上海博讯实业有限公司医疗设备厂;THZ-82 水浴恒温振荡器,常州市中贝仪器有限公司;GeneAmpR9700 型PCR 仪,美国ABI 公司。
1.2 试验所用培养基
生物胺显色培养基:参考Sara 等[10]方法略作修改后配制;以生物胺为唯一氮源培养基(BAs):参考赵佳迪[11]的方法,略作修改后配制。
6%/9%/12%盐度甜瓣子模拟体系(以100 mL计):霉瓣子25 g+盐4.5,9.4,13 g+5-磷酸吡哆醛0.005 g+碳酸钙0.01 g+70 g 水,混匀121 ℃,15 min 灭菌。
6%盐度含生物胺的甜瓣子模拟体系(以100 mL 计):霉瓣子25 g+盐4.5 g+4 mL 生物胺100 mg/L (8 种)+5-磷酸吡哆醛0.005 g+碳酸钙0.01 g+70 g 水,混匀121 ℃,15 min 灭菌。
2 试验方法
2.1 甜瓣子中产生物胺菌株筛选及其不同盐度下产胺能力研究
2.1.1 产胺菌株筛选 称取200 g 霉瓣子,加入200 g 饮用水,称取16 g 食用盐,整个甜瓣子发酵体系的盐度为4%,37 ℃发酵30 d。称取10 g 4%盐度甜瓣子,用生理盐水逐级稀释。选取适宜梯度的稀释液100 μL 分别涂布于含有溴甲酚紫的固体显色培养基上,37 ℃培养12 h。挑取培养后使培养基变紫的菌株至LB 培养基上分离、纯化即为初筛菌株。将初筛菌株接种至液体显色培养基进行复筛,以不接种菌株的显色培养基为空白对照。37 ℃过夜培养,挑选培养后培养液明显变紫的菌株初步判定为产生物胺的菌株。采用生工生物工程股份有限公司基因组DNA 提取试剂盒提取DNA 后,分别利用PCR 扩增16S rDNA、18S rDNA 和ITS 序列,送至北京擎科新业生物技术有限公司进行测序,通过BLAST 比对序列,构建系统发育树。
2.1.2 高效液相色谱法测定生物胺含量 参考陈功等[12]建立的HPLC 测定不同样品生物胺含量的方法,略作修改,洗脱程序如表1所示。
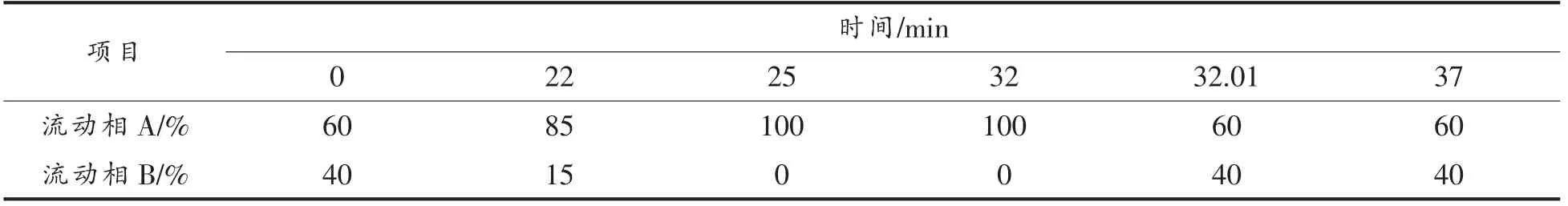
表1 生物胺检测的洗脱程序Table 1 Elution procedure for biogenic amine detection
采用HPLC 测定样品生物胺含量,建立标准曲线,根据标准曲线计算试样中生物胺的含量,所得含量明显高于空白组的菌株即确定为产生物胺菌株。
2.1.3 高产生物胺菌株回接至不同盐度甜瓣子体系产生物胺能力研究 将筛选得到高产生物胺的菌株回接于液体培养基(1 L)中,扩大培养24 h,8 000 r/min,4 ℃低温离心10 min 得到菌体,以108CFU/g 回接至不同盐度甜瓣子(6%,9%,12%)模拟体系中;以接种等量无菌水的灭菌甜瓣子模拟体系为空白对照,以该盐度未灭菌甜瓣子接种等量无菌水为正常发酵甜瓣子对照,30 ℃恒温发酵16 d 后,测定甜瓣子中生物胺含量。
2.2 生物胺降解菌株筛选及降解能力研究
2.2.1 不产生物胺菌株筛选 选取46 株课题组前期从甜瓣子中筛出的不同菌属菌株为研究对象,分别活化后接种至生物胺液体显色培养基中,以接种等量无菌水为空白对照。恒温培养48 h后,挑选显色培养基不变紫的菌株初步判定为不产生物胺菌株。
2.2.2 降解生物胺菌株筛选及其降解能力测定根据生物胺在荧光条件发色,生物胺含量与特定波长下荧光强度呈正相关原理,参考Judite 等[13]方法略作调整后,建立荧光定性分析样品中生物胺含量的方法,初步筛选提取液荧光强度弱于空白对照的菌株为可能降解生物胺的菌株。将初筛得到的降解生物胺菌株接种到BAs 培养液中,以接种等量无菌水的BAs 培养液为空白对照,37 ℃振荡培养12 h 后,观察其菌株生长情况并于620 nm 波长下测定其OD 值,测定菌株在以生物胺为唯一氮源的培养基中的生长情况。按上述方法对BAs 培养液提取衍生后,再次测定荧光强度,选取荧光强度弱于空白对照组的菌株为降解生物胺菌株。高效液相色谱测定降胺菌株培养液中生物胺含量,并用公式(1)计算其生物胺降解率。

式中,X——生物胺降解率(%);C1——空白组中生物胺浓度 (mg/kg);C2——接种菌株培养后培养液中生物胺浓度(mg/kg)。
2.2.3 降解生物胺菌株回接甜瓣子模拟体系 将筛选菌株回接到6%盐度甜瓣子模拟体系中,以接种等量无菌水发酵体系为空白对照,30 ℃发酵30 d。根据表2甜瓣子感官评价标准对甜瓣子进行感官评分并采用高效液相色谱测定甜瓣子模拟体系中生物胺含量。
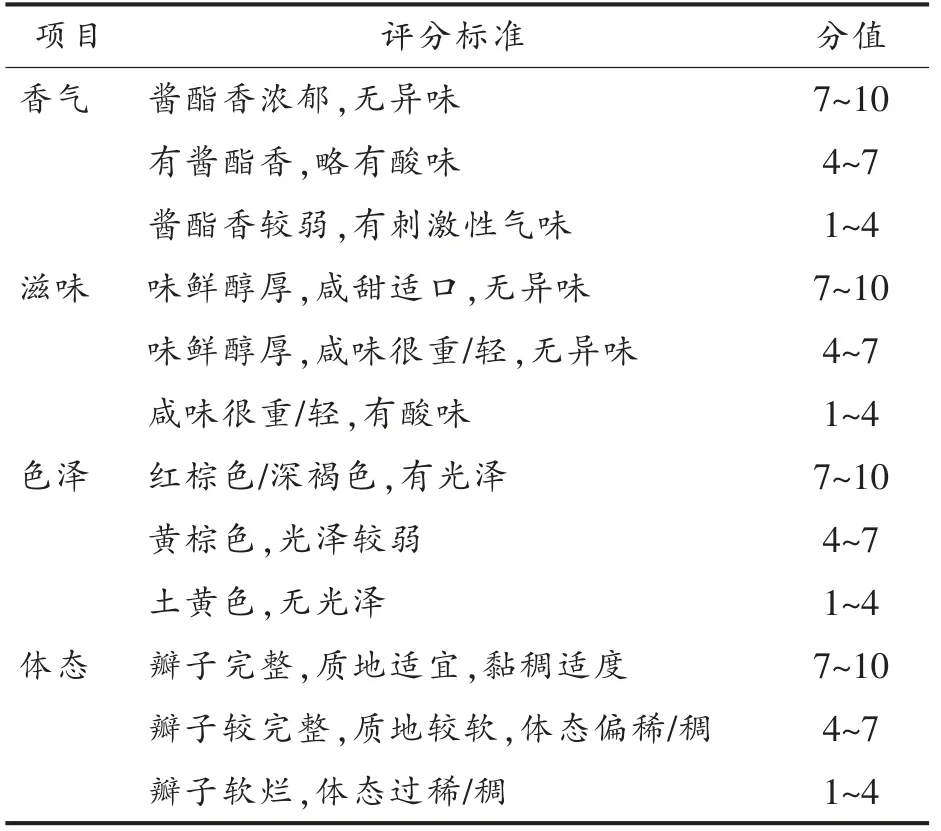
表2 甜瓣子感官评价标准[14]Table 2 Sensory evaluation criteria of sweet petals[14]
2.3 数据分析
以上数据均做3 个重复样品,采用Excel、Origin、MEGA7 对数据统计处理及作图。
3 结果与分析
3.1 标准曲线
生物胺标准曲线如表3所示,其回归系数R2均≥0.998,可满足检测要求。

表3 生物胺标准曲线Table 3 Standard curve of biogenic amines
3.2 产胺菌株筛选结果
3.2.1 产胺菌株初筛结果 由于生物胺显碱性,产胺菌株在显色培养基中呈现紫色,不产生物胺或降解生物胺菌株在显色培养基上不变色。过夜培养后得到培养基变紫的初筛菌株如图1a 所示,挑取这些菌株进行分离、纯化,如图1b 所示,得到产胺菌株46 株。
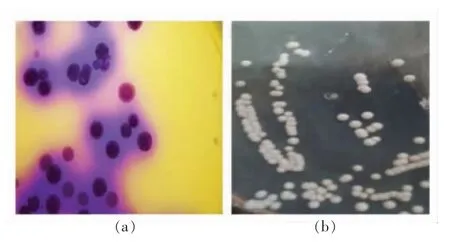
图1 产胺菌株显色培养基显色形态(a)及LB 平板培养形态(b)Fig.1 Colorimetric morphology of amine-producing strains in colorimetric medium (a)and LB plate culture (b)
3.2.2 产胺菌株复筛结果 将初筛菌株接种至生物胺液体显色培养基中,37 ℃培养12 h,筛选培养后培养液为紫色的菌株为产胺菌株,如图2所示,筛选得到32 株产胺菌。
通过固体显色培养基初筛,液体显色培养基复筛,再经过16S rDNA、18S rDNA 和ITS 测序,通过BLAST 比对序列,采用MEGA 7.0 构建系统发育树(图2)。
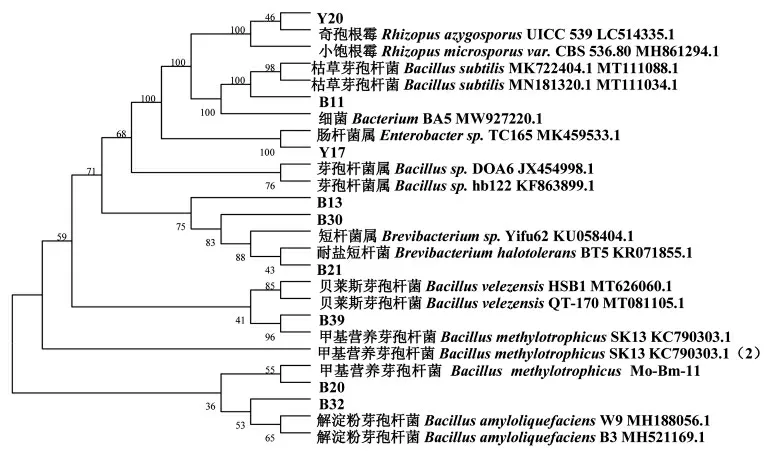
图2 产胺菌株的系统发育树Fig.2 Phylogenetic tree of amine-producing strains
结果显示甜瓣子中所筛选出代谢生物胺的菌株主要为芽孢杆菌属、短杆菌属、肠杆菌属及少量小孢根霉,这与Jeon 等[15]发现韩国传统豆酱Cheonggukjang 中,主要由肠球菌属和芽孢杆菌属生成生物胺的研究结果一致。
3.2.3 高效液相色谱测定培养液中生物胺含量经高效液相色谱测定,得到复筛的产胺菌株培养液中生物胺含量如图3所示。
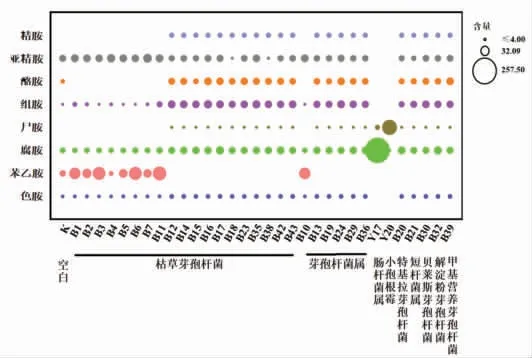
图3 产胺菌株培养液中生物胺含量(mg/mL)Fig.3 Bioamine content in culture medium of amine-producing strain (mg/mL)
结合空白组进行分析可以得出,所筛出菌株培养液中生物胺总量均远高于空白组中生物胺总量,不同菌株之间产生物胺能力存在较大差异,与空白组相比芽孢杆菌属产组胺、酪胺的能力相对较强。其中,B11 菌株产苯乙胺能力相对较强,含量达78.4 mg/kg;B16 菌株产酪胺能力相对较强,含量达25.3 mg/kg。Y17 菌株和Y20 菌株具备较强的产腐胺、尸胺能力,其培养液中含量分别达257.5 mg/kg 和92.8 mg/kg,挑选这4 株菌株回接至甜瓣子发酵体系验证产胺能力。
3.3 高产胺菌株回接至不同盐度甜瓣子模拟体系中产生物胺的能力
高产生物胺菌株回接结果如图4所示。可看出,6%盐度体系中生物胺含量远高于9%和12%盐度体系,且8 种生物胺均有检出,生物胺总量最高达4 207.6 mg/kg。对照组发酵过程主要产酪胺、腐胺、组胺和色胺,有少量尸胺检出。该盐度下,除B11 号菌株外其余各菌株体系中生物胺总量均高于食品中生物胺建议总量1 000 mg/kg[16]。其中,B16 回接体系中酪胺含量相对较高,含量为1 194.4 mg/kg,高于Ten 等[17]、Nout 等[18]提出的食品中酪胺为100~800 mg/kg 的限量标准;Y17 体系中腐胺含量较高,含量为3 363.9 mg/kg;Y20 回接体系中高产尸胺,为1 160.4 mg/kg,表明6%盐度发酵甜瓣子可能存在较大安全风险。
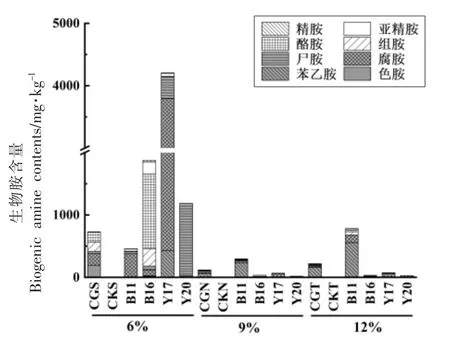
图4 高产胺菌株回接6%、9%、12%盐度甜瓣子模拟体系后产胺能力Fig.4 The amine-producing capacity of the amineproducing strain after back connecting with the simulated system of sweet petal with 6%,9% and 12% salinity
在9%和12%含盐量甜瓣子样品中,生物胺总量最高分别为233.9,781.2 mg/kg,其生物胺组成相似。9%盐度下B11 高产苯乙胺220.06 mg/kg;12%盐度下B11 高产腐胺119.4 mg/kg、苯乙胺546.5 mg/kg,远高于30 mg/kg 的推荐量[17]。B16、Y17、Y20 菌株在9%、12%盐度回接体系中不产色胺,产生物胺种类和含量随盐度增加而减少,与对照组生物胺变化趋势较为一致,可能是盐对其生长起到了一定程度的抑制作用所致。精胺和亚精胺在不同含盐量甜瓣子样品中含量均较低。因此,实现甜瓣子低盐化发酵不能一味的追求降低盐的含量。
3.4 生物胺降解菌株筛选结果
3.4.1 不产胺菌株筛选结果 挑选46 株课题组前期从甜瓣子中筛选出的不同种属菌株,活化后接种至生物胺液体显色培养基中,筛选得到39 株不产生物胺的菌株,主要为酵母菌、乳酸菌(表4)。

表4 不产胺菌株筛选结果Table 4 Screening results of non-amine-producing strains
3.4.2 生物胺降解菌株初筛结果 将上述不产胺菌株未变紫培养液衍生后于300 nm 波长下检测其荧光强度,初筛出降胺菌株。荧光检测筛选结果如图5所示。
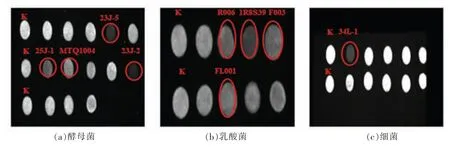
图5 降胺菌株初筛荧光检测结果Fig.5 Fluorescence detection results of the initial screening of the aniline strain
选取荧光强度弱于空白组的菌株,初步断定为降解生物胺菌株(图5),共筛选出降解生物胺菌株9 株,其中酵母菌4 株,乳酸菌4 株,细菌1 株。
3.4.3 生物胺降解菌株复筛结果 将上述菌株回接至生物胺质量浓度为100 mg/L 的BAs 培养液,30 ℃培养12 h 后,空白组未观察到菌株的生长,其余组菌株均有生长,于620 nm 波长下测定其吸光度值,从而判定其在以生物胺为唯一氮源的培养基下的生长状况,结果如图6所示。
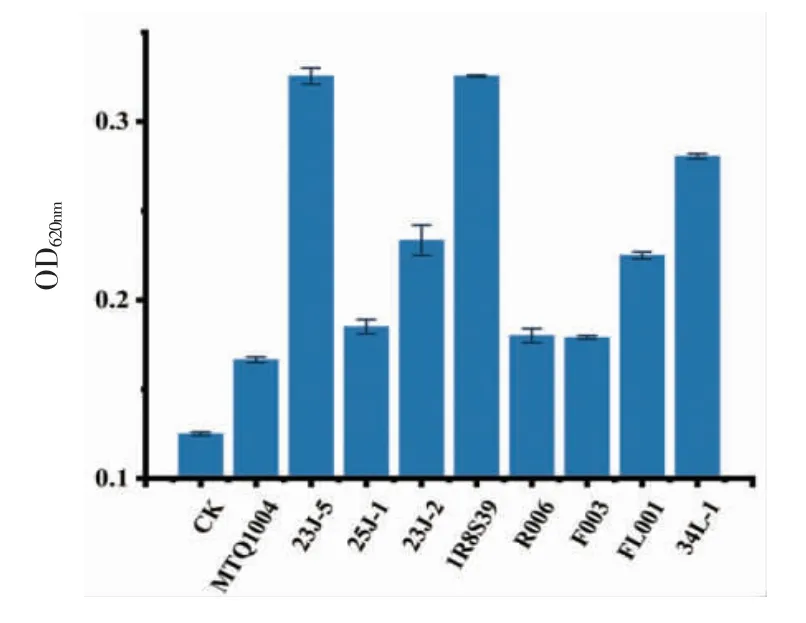
图6 降解生物胺菌株BAs 培养液OD 值Fig.6 OD value of BAS culture medium of bioamine-degrading strain
研究结果表明,初步筛选的9 株菌均具备降解生物胺的能力。其中,美极梅奇酵母23J-5、食窦魏斯氏菌1R8S39 在BAs 培养基下生长状况较好,表明其降解生物胺的能力可能较高。荧光检测结果显示,9 株菌株荧光强度均弱于空白组的菌株(图7),表明其均为生物胺降解菌。

图7 生物胺降解菌株荧光检测结果Fig.7 Fluorescence detection results of biogenic amine degrading strains
3.4.4 降胺菌株BAs 培养液降解能力测定 使用高效液相色谱测定各菌株BAs 培养液生物胺含量并计算其降解率,结果如图8所示。所筛选菌株都具有一定生物胺降解能力,然而均无法降解亚精胺,不同菌株降解不同种类生物胺的能力差异较大。9 株菌株对色胺的降解率在14.10%~21.37%之间;苯乙胺的降解率在5.94%~20.09%之间;腐胺的降解率在14.46%~24.94%之间;尸胺的降解率在23.52%~30.82%之间;组胺的降解率在5.65%~33.43%之间;酪胺的降解率在4.75%~15.10%之间;精胺的降解率在34.67%~65.58%之间;其中,扣囊复膜酵母MTQ1004 具备较强的降解腐胺、组胺、精胺能力,其降解率分别为24.94%,33.43%,65.58%;美极酶奇酵母23J-5 具备较强的降解尸胺、酪胺能力,降解率分别为30.82%,15.10%;香肠乳杆菌F003 具备较强的降解苯乙胺和色胺能力,降解率分别为20.09%,21.37%,且能降解除亚精胺外的其余7 种生物胺。通过比较分析可知,扣囊复膜酵母(MTQ1004)和香肠乳杆菌(F003)的生物胺降解率相对较高,与杨利昆等[19]、赵佳迪[11]研究结果较为一致。
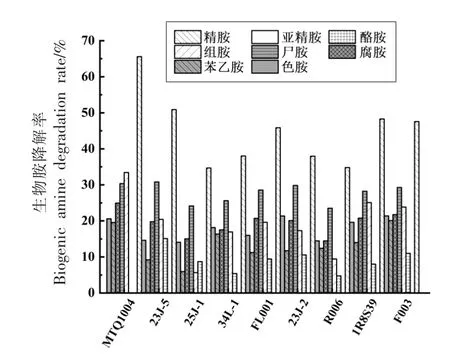
图8 降胺菌株BAs 培养液的生物胺降解率(%)Fig.8 Degradation rate of biogenic amines in culture medium of BAS by amine-lowering strain (%)
3.5 降胺菌株回接甜瓣子模拟体系验证结果
3.5.1 降胺菌株回接甜瓣子模拟体系的降解能力测定 将上述降胺菌株回接至含100 mg/L 生物胺的甜瓣子模拟体系中培养16 d,提取衍生后,通过高效液相色谱法测定生物胺含量,结果如图9所示。由于尖包念珠菌为有害菌,因此不考虑回接应用。其中,降胺能力最强的是香肠乳杆菌F003,与前期筛选结果一致,其对苯乙胺的降解率高达100%,对危害较大的组胺、酪胺和精胺的降解率分别可达57.61%,25.52%,45.99%;扣囊复膜酵母MTQ1004 对苯乙胺和腐胺的降解率达100%,对组胺降解率为37.78%;其余菌株对各种生物胺均有一定的降解能力。
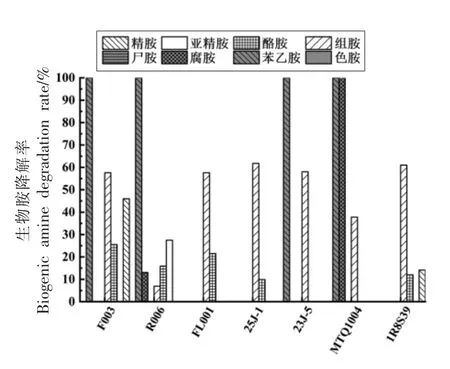
图9 甜瓣子模拟体系中的生物胺降解率(%)Fig.9 Degradation rate of biogenic amines in the sweet petal simulation system (%)
在甜瓣子模拟体系下,菌株降解率与对应菌株降解生物胺能力强弱较为一致。而降解生物胺种类数量减少,这与该菌株降解生物胺能力特性有所不同,可能是因为甜瓣子正常发酵时,环境因素对菌株降解生物胺能力造成影响所致[20]。
3.5.2 降胺菌株回接甜瓣子模拟体系的感官评价 由图10可以看出,在回接纯种发酵体系中,所筛选出降胺菌株发酵的甜瓣子感官评价结果存在一定差异。其中,生物胺降解能力较强的扣囊复膜酵母MTQ1004 具有生物胺降解能力,而强化发酵的甜瓣子霉味较重,以腐臭味、氨味为主,感官品质相对较差;生物胺降解菌株香肠乳杆菌F003 强化发酵所得的甜瓣子同正常发酵的甜瓣子相比,其酯香、酱香味较浓,所得甜瓣子样品感官品质最佳,可以考虑用作低盐化甜瓣子中的降胺发酵菌株。

图10 降胺菌株回接甜瓣子模拟体系的感官评价Fig.10 Sensory evaluation of aniline strain tieback sweet petal simulation system
4 结论
本研究从4%盐度甜瓣子中筛出产生物胺菌株32 株,其中肠杆菌属Y17、小孢根霉Y20、枯草芽孢杆菌B11 和B16 产生物胺能力最强,主要产酪胺、尸胺、腐胺、苯乙胺。盐度对菌株产生物胺能力有明显抑制作用,将4 株菌株回接至甜瓣子发酵体系中,其中6%发酵体系含有大量生物胺,9%和12%发酵体系中产生物胺明显得到抑制。
筛选出降解生物胺菌株9 株;筛选出1 株可用于甜瓣子低盐化发酵的降胺菌株香肠乳杆菌F003,它能有效降解苯乙胺、组胺、酪胺和精胺等生物胺,在生物胺含量为100 mg/L 时,降解率分别为100%,57.61%,25.52%,45.99%,且回接体系中感官品质最佳,具有较好的生长能力,可考虑为甜瓣子低盐发酵时的降胺菌株。

