SiO2颗粒在CaO-SiO2-FeO-MgO-Al2O3转炉渣体系中的熔解机理
李金豹,刘训良,温治,楼国锋,豆瑞锋,苏福永,李永谦
(1.北京科技大学大学 能源与环境工程学院,北京,100083;2.宝钢股份中央研究院 能源与环境研究所,上海,201900)
2020年,我国粗钢产量达10.53亿t[1],占世界粗钢产量的56.49%,粗钢产量中转炉炼钢占比约90%[2],随着粗钢产量不断增长,转炉钢渣堆存量日益增加。转炉钢渣中CaO,SiO2,FeO,MgO等氧化物含量可达总量90%以上[3],目前对转炉渣的资源化利用主要包括:作为筑路材料、硅酸盐水泥混合料、废水去磷剂、转炉原料、烧结溶剂等[4]。
影响转炉渣再利用的关键问题主要是渣的稳定性、易磨性和胶凝活性,通过在高温下加入酸性氧化物对炉渣进行改性,利用高温下良好的热力学条件,实现对炉渣矿相成分结构改质,这被认为是解决炉渣利用率问题的重要途径。德国钢厂用氧气做载体将石英砂加入液态炉渣中,利用铁及铁化合物氧化时释放的热量将石英砂完全熔融,使f-CaO 含量降至合理水平,增强炉渣的稳定性[5]。
转炉渣的高温调质过程可分为调质剂的均质化和熔解两个过程,为了提高调质剂的熔解速率,研究调质剂在高温熔渣中的熔解动力学机理以及确定熔解速率控制因素至关重要。目前国内外许多学者通过利用高温原位观察技术对颗粒(CaO,Al2O3和MgO 等)在不同渣系中的熔解动力学行为进行研究[6-10]。颗粒在熔渣中熔解是一个复杂的过程,取决于界面反应速率、传质条件和炉渣性质。为了解释颗粒的熔解机理,通过解析收缩核模型的研究方法已被广泛应用[11-14],该模型假设固体颗粒的熔解速率与颗粒和熔渣之间界面的化学反应或颗粒炉渣边界层中物质的扩散有关。通过将高温原位观察技术和解析收缩核模型两种方法结合,MONAGHAN 等[15]研究了温度在1 477~1 577 ℃之间时,Al2O3颗粒在三元渣系CaO-SiO2-Al2O3中的熔解反应行为,认为颗粒在高温液态炉渣中熔解时边界层传质是控速环节。LIU等[16]采用收缩核模型对球形氧化铝颗粒在CaO-Al2O3-SiO2渣中熔解进行原位观察研究,得出在各个温度下的传质扩散系数。VALDEZ 等[17]认为在CaO-Al2O3-SiO2渣中,Al2O3颗粒熔解由反应控制变为边界层扩散控制,MgO 颗粒为边界层扩散控制。TANG 等[18]研究了CaCO3颗粒在FeOx-SiO2-V2O3-TiO2渣中的熔解过程,认为颗粒熔解速率受熔渣边界层中的传质控制。YI 等[19]对合成CaO-Al2O3-MgO 渣中Al2O3和MgO 颗粒的熔解行为进行观察并采用解析收缩核模型阐明熔解机理,Al2O3颗粒的熔解速率受边界层扩散的限制,MgO的熔解受到表面反应的限制。田铁磊等[20]研究表明,SiO2颗粒在CaO-SiO2-MgOAl2O3渣系的熔解过程分为两个阶段,反应前期为界面反应控制,表观活化能为330.52 kJ/mol;反应后期扩散控制,表观活化能为480.28 kJ/mol,控制环节的转变是由熔体黏度的变化造成。目前对CaO,Al2O3和MgO颗粒在各渣中的研究较多,而对SiO2颗粒在多元转炉渣体系中的熔解行为却鲜有报道。
本文作者采用超高温共焦显微镜(HT-CSLM)观察SiO2颗粒在CaO-SiO2-FeO-MgO-Al2O3转炉渣体系的熔解反应过程,借助ImagePro-plus 对图像数据处理,通过采用收缩核模型对实验数据拟合,揭示SiO2在转炉渣中的熔解反应机理;并结合高温黏度测试仪、X 射线衍射(XRD)分析温度、粒径、熔渣成分和黏度等因素对SiO2颗粒在高温熔融转炉渣中熔解速率的影响,为转炉渣高温调质提供理论指导。
1 实验
1.1 颗粒及炉渣的制备
根据某公司提供的转炉渣样本,通过X 射线衍射分析各氧化物的质量分数,结果如表1 所示,按照比例混合CaO,SiO2,MgO,FeO 和Al2O3各氧化物的纯化学试剂粉末,并通过平铺直取的方法将各氧化物混合均匀,且各氧化物在混合之前均置于马弗炉内在300 ℃条件下干燥24 h以确保组分干燥。之后将混匀的原料装入钼坩埚内,然后放入高温电阻炉内,按照预设程序将电阻炉升温进行化渣实验,以10 ℃/min 加热到1 600 ℃并保温2 h,确保氧化物之间充分熔解反应,随后将熔融物取出放置在漂浮于水面的不锈钢板上淬火,得到调配的转炉渣,如图1所示,并利用磁力研磨机研磨成粉末,用于HT-CSLM下观察。

表1 实验中配置的转炉渣样本成分(质量分数)Table 1 Composition of converter slag sample configured in experiment %

图1 高温淬火后的调配转炉渣Fig.1 Blending of converter slag after high temperature quenching
实验选用的调质剂SiO2颗粒纯度为99.99%,为减小后续数据处理实验误差,尽可能选择半径为0.5 mm的均匀球状颗粒,如图2所示,并在实验前将SiO2颗粒置于管式炉中1 000 ℃条件下干燥2 h。考虑到某公司的转炉渣成分相对稳定,所以本文实验研究温度和SiO2粒径对熔解反应的影响,仅定性分析成分对熔解反应的影响。实验工况设置如表2所示,其中工况7 选取粒径较大的颗粒便于观察,以探究SiO2颗粒熔解的反应界面特性。

图2 烘干处理后的SiO2颗粒Fig.2 Dried SiO2 particles

表2 实验工况设置Table 2 Working condition settings in experiment
1.2 超高温共聚焦显微镜
实验中使用VL2000DX-SVF17SP 超高温共聚焦显微镜(HT-CSLM)观察SiO2颗粒在高温熔渣中的熔解反应行为。HT-CSLM 允许在超高温度下对样本进行连续地原位观察,在标准配置下最高工作温度可达1 700 ℃,且可实现超过1 000 ℃/min的高速加热和氦气紧速冷却速率。
本文中使用的HT-CSLM 装置附在高温台上,高温台由镀金椭圆形炉、铂坩埚(内径为7 mm,高为5 mm)、测试样品架、卤素灯、激光装置、气氛控制系统、温度测量/控制系统和一个与视频记录系统相连的显微镜组成,如图3所示。样品位于椭球的上焦点,卤素灯的辐射聚焦集中在样品上。温度由放置在样品表面附近的热电偶测量,为了确保温度测量的准确性,使用已知熔点的纯金属铜、银和镍颗粒,放在氧化铝坩埚上进行一系列校准实验,且测量重复3次。

图3 HT-CSLM装置示意图Fig.3 Schematic diagram of HT-CSLM
坩埚装置示意图如图4所示。将氧化铝坩埚放在位于HT-CSLM 炉室中激光焦点的铂样品架上,以卤素灯作为热源;同时将1 mm 厚的Al2O3粉末放在氧化铝坩埚和铂金坩埚架之间以避免粘连,将B型热电偶连接到铂样品架的底部,用于测量和控制坩埚温度。使用波长低于观察样品热辐射光谱的激光作为光源,确保用于形成图像的激光辐射比来自样品的热辐射强得多,使显微镜的分辨率更高,可获得坩埚内部的清晰图像。

图4 坩埚装置示意图Fig.4 Schematic diagram of crucible device
1.3 熔解实验
对于SiO2熔解实验,首先将调配的转炉渣粉末填充并压实到铂坩埚中,然后将HT-CSLM炉腔抽真空再通入超纯氩气10 min,以确保炉室内的中性气氛。实验期间的控温过程非常重要,在开始熔解过程之前应使转炉渣尽快完全熔化且保证SiO2未发生熔化,而HT-CSLM 炉中高达1 000 ℃/min的加热速率可确保在达到实验目标温度之前颗粒几乎不熔解。
通过观察陶瓷氧传感器测得的入口和出口气流中的氧势确保没有氧泄漏,在超纯氩气保护气氛下将炉渣在HT-CSLM 炉室中加热熔化(200 ℃/min),以避免后续在观察颗粒熔化反应时熔渣起泡妨碍视线。将温度调节到1 600 ℃保温20 min使熔渣充分熔化,随后通入氦气对炉渣快速冷却,以制备均质的固化渣块,再将单个SiO2颗粒放置在铂金坩埚中的固化渣块表面上,在高纯氩气气氛下将实验样品迅速加热(1 000 ℃/min)至所需的目标温度,且在比实验温度低50 ℃时加热速率降至100 ℃/min以避免超温,具体全程控温曲线如图5所示。温度稳定保持在所设实验温度,直到在聚焦呈现于视野中颗粒完全熔解,同时在录像机中以30帧/s的速度连续记录样品的图像。

图5 实验过程控温曲线Fig.5 Temperature curve in process of experiment
1.4 数据处理
使用软件Virtual Dub 将HT-CSLM 保存的视频转换成图片,然后利用图像分析软件ImageProplus对图片进行处理,在熔解颗粒周围手动绘制边界,并假设颗粒在整个熔解过程中保持球形,在规定的时间间隔内得出颗粒的面积计算等效颗粒直径。
实验中时间零点定义为达到实验温度的时间,在本文中求解收缩核模型方程的数值解,对比实验过程转化率X与t/tf的关系(其中t为颗粒熔解时间,tf为颗粒完全熔解时间),阐明颗粒的熔解反应机理。

式中:r为颗粒在t时刻的半径,m;r0为颗粒的原始半径,m。
2 熔融转炉渣中SiO2颗粒熔解动力学模型
为了研究SiO2熔解的机理,利用经典的未反应收缩核模型以及局部浓度平衡的假设,即认为熔渣和SiO2颗粒之间的界面处物质处于饱和状态,界面上的SiO2浓度为SiO2在熔渣中的饱和浓度。
当颗粒与界面反应速度Jr远小于边界层扩散速率JD时,此时化学反应为主要的控速环节。SiO2颗粒与熔融转炉渣中的CaO,FeO,MgO 和Al2O3均可发生复杂的化学反应生成各类硅酸盐化合物,但在超高温的实验环境下真实的界面化学反应在技术上难以测得,所以简化SiO2熔解反应为一级不可逆反应,其中(SiO2)l代表SiO2颗粒熔解于转炉渣中形成的硅酸盐氧化物[15]:

球形颗粒的反应速率方程[16]:

式中:nSiO2为SiO2的物质的量,mol;krea为反应速率常数,m/s;c*为SiO2颗粒在熔渣界面处的浓度,即SiO2在熔渣中的饱和浓度,通过FactSage 热力学软件计算获得,mol/m3;cb为SiO2在熔渣体相中的浓度,mol/m3;ρSiO2为SiO2密度,kg/m3;MSiO2为SiO2摩尔质量,kg/mol。
对式(3)右侧两相分离变量积分可得:

反应速率常数krea由阿仑尼乌斯公式给出:

式中:Ea为活化能,J/mol;R为气体常数,8.314 5 J/(mol·K);Ar为指数前因子;T为热力学温度,K。
当颗粒完全熔解反应时,r=0,此时颗粒完全熔解时间tf有:

此时t/tf与转化率X之间存在如下关系:

当界面反应速度Jr远大于边界层扩散速率JD时,颗粒熔解反应速率为边界层扩散控速[17]:
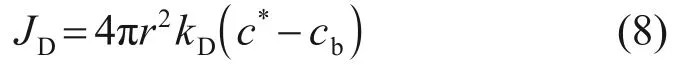
式中:kD为传质系数,m/s。
假设颗粒相对于液态熔渣处于滞留区内时,传质系数kD、扩散系数D与颗粒半径r的关系如下[6]:

扩散系数D与炉渣黏度和温度的关系可由Eyring公式表达[18]:

式中:kb为玻尔兹曼常数;η为熔渣黏度,Pa·s;λ为熔解物质的跳跃距离,常取为半径,m。
同样的,可得当边界层扩散为控速因素时的反应时间:

颗粒完全熔解时间tf以及t/tf与转化率的关系如下:

同理,若SiO2颗粒在熔融转炉渣中的熔解反应速率受产物层扩散控制,利用收缩核模型并结合产物层扩散速率积分公式,颗粒完全熔解时间tf以及t/tf与转化率的关系[6],分别如式(14)和(15)所示。

式中:Deff为有效扩散系数,m2/s;c0为SiO2在颗粒表面处的浓度,mol/m3。
通过产物层的内扩散不同于外扩散过程,需要考虑产物层的孔隙率εp和扩散路径的迂曲度s。假设不同熔渣熔解过程中穿过产物层的空间结构相同,则有效扩散系数[6]为

3 实验结果
3.1 SiO2颗粒在转炉渣中的熔解过程
以实验1为例,在显微镜下SiO2颗粒初始形状并不规则,部分呈角状突起,经过一段时间熔解反应后,熔解粒子的表面变得圆润如图6所示。这是由于在颗粒熔解反应过程中相邻熔融转炉渣的成分在颗粒局部浓度发生变化,致使SiO2中最先熔解的位置是具有小曲率半径和角状突起的部分,因为其具有更高的比表面积,故具有较快的熔解速率,熔解中粒子的角状突起会逐渐圆角化。

图6 熔解导致SiO2颗粒角状颗粒变圆示意图Fig.6 Schematic diagram of rounding of angular particles of SiO2 due to melting
此外在熔解过程中,熔解的颗粒会出现轻微旋转现象,数据处理时颗粒等效粒径也随之出现明显的上下波动。SiO2颗粒在熔解过程中等效粒径的振荡可能是由于颗粒的非完美球形特性导致。在熔解过程中,由于颗粒不是标准球形的,局部半径可能会发生变化,从而导致局部质量通量不均推动颗粒运动。粒子的旋转会引入误差,并阻碍熔解机理的确定,但由于旋转现象轻微,在多数研究中都未考虑颗粒旋转对实验的影响。
3.2 温度对SiO2颗粒熔解的影响
图7所示为温度分别在1 430,1 450,1 480和1 510 ℃时,粒径为0.48~0.54 mm的SiO2颗粒在转炉渣熔解时转化率X随时间的变化。为分析简化采用SiO2平均熔解速率作为衡量温度和粒径对SiO2熔解影响的指标。平均熔解速率(r0/tf)定义为初始粒径除以总熔解时间,平均熔解速率越大意味着速度越快,实验中,1 430,1 450,1 480 和1 510 ℃时温度下炉渣中SiO2颗粒的平均熔解速率分别为3.967,4.503,6.066 和8.044 μm/s,表明SiO2平均熔解速率随着温度升高而增加。图8所示为不同温度下不同颗粒熔解的总时间对比曲线。从图8 可知:平均温度每升高10 ℃颗粒的总熔解时间就减小7.63 s,平均熔解速率提高12.7%。

图7 不同温度下颗粒转化率对比Fig.7 Comparison of particle conversion rate at different temperatures
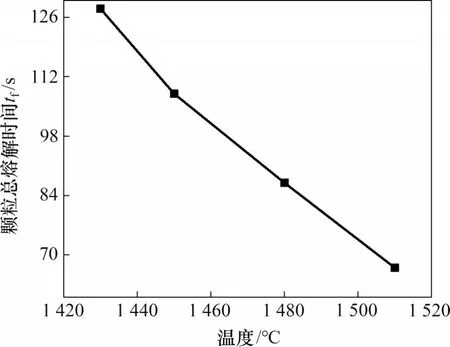
图8 不同温度条件下颗粒的总熔解时间对比Fig.8 Comparison of total melting time of particles under different temperature conditions
图9 和图10 所示分别为对于不同粒径下SiO2颗粒的熔解实验转化率和总熔解时间的对比。可见,在1 430 ℃时,r0为0.5,0.7 和0.8 mm 的颗粒平均熔解速率分别为3.967,3.800 和3.720 μm/s,且粒径平均每增加0.1 mm,颗粒的总熔解时间对应增加27.67 s,平均熔解速率降低2.15%。

图9 不同粒径下颗粒转化率对比Fig.9 Comparison of particle conversion rate at different particle sizes

图10 不同粒径条件下颗粒的总熔解时间对比Fig.10 Comparison of total melting time of particles under different particle size conditions
3.3 反应界面形态
图11 所示为SiO2颗粒与熔渣界面的高倍显微镜下图像。由图11 可以看出:在SiO2颗粒熔化过程中,颗粒周围清晰可见并未有固态产物层,此外在反应过程中,SiO2颗粒和液态熔融炉渣之间的界面非常光滑,意味着在SiO2熔解过程中没有形成固态产物层。这一现象与FEICHTINGER等[11]在CaO-Al2O3-SiO2渣中熔解SiO2颗粒的结果一致。对于在颗粒周围没有固态产物层形成的颗粒熔解过程,由于SiO2颗粒表面结构紧密规整,熔解反应仅发生在表面,内部的未反应核是致密无孔的,此时影响颗粒熔解的主要控速环节包括以下步骤[6]:1) 颗粒与熔渣界面上的化学反应(反应控速);2) 反应物从熔渣通过边界层扩散到固体SiO2表面(边界层扩散控速);3) 反应产物通过边界层从界面扩散到熔渣中(产物层扩散控速)。

图11 高倍显微镜放大的反应界面图像Fig.11 Reaction interface image magnified by a highpower microscope
4 结果讨论
4.1 熔解机理分析
图12 所示为不同温度下实验结果与理论计算数值曲线对比。从图12 可以看出:SiO2颗粒的实验熔解数据在前期与产物层扩散曲线几乎不会吻合,仅在颗粒临近熔解完毕时实验结果才与产物层扩散控制曲线有部分重合,即产物层扩散只在反应后期对SiO2颗粒的熔解速率有略微影响,说明其并非SiO2颗粒在转炉渣中熔解反应的限制环节。产物层扩散无法完全表征SiO2颗粒的熔解机理主要是由于SiO2颗粒表面致密,且在转炉熔渣的熔解反应过程中生成低熔点的产物,直接变成液相进入熔渣中,而在熔解后期由于反应产物的积聚又对SiO2颗粒熔解产生了轻微影响,因而在后期实验数据与产物层扩散控速曲线略有重合,但综合对比全部数据可知,产物层扩散对SiO2熔解总速率的影响较小,这一结论与TIAN等[10-11]的研究结论一致。
图13 所示为不同粒径下实验结果与理论控速曲线拟合对比。综合对比图12和13可得出:尽管颗粒的非完美球形和旋转带来数据偏差,造成平均熔解曲线与理论曲线不完全重合,但可以表明在该实验中化学反应控制SiO2颗粒的熔解速率。由图13 可知:在温度较低时,颗粒的熔解机理发生轻微转变,该变化可能由于温度较低熔渣的黏度变大导致。

图12 不同温度下实验结果与理论控速曲线拟合对比Fig.12 Comparison of experimental results and theoretical curve fitting at different temperatures

图13 不同粒径下实验结果与理论控速曲线拟合对比Fig.13 Comparison of experimental results and theoretical curve fitting at different particle sizes
可见,在熔解开始时,颗粒熔解速率由快到慢,这是因为熔解初期颗粒周围陡峭的浓度梯度导致快速的熔解速率,但随着熔解的进行,颗粒周围浓度梯度变得不再陡峭,因此,熔解速率降低。
除温度和粒径外,颗粒熔解速率还受理化性质和炉渣成分的影响,下面系统地讨论不同因素对熔解的影响。
4.2 影响因素讨论
收缩核模型中颗粒在整个过程任何时刻的熔解速率J都可表示为[6]
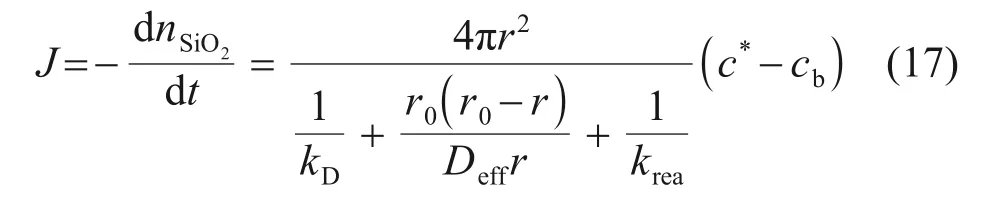
分别定义颗粒熔解反应过程中的总阻力1/kt和反应的驱动力ΔcSiO2如下,其中ΔcSiO2取决于渣矿中相的演变和炉渣的组分。


式(18)中SiO2的熔解反应中阻力项包括边界层扩散、产物层扩散和化学反应,且由kD,Deff和krea的定量描述式(9),(10),(7)和(17)以及式(5)分析可知,SiO2在熔渣中的熔解反应速率主要与温度、颗粒原始粒径和熔渣成分等因素有关,其中熔渣成分主要影响炉渣黏度以及SiO2的浓度。因而定义函数ΔcSiO2/η,各实验温度下的转炉渣黏度由高温黏度测试仪(SS.HVTS-1600)获得(见图14),通过对比实验数据和表3 数据可得,ΔcSiO2/η越大,熔解速率越快,即可通过ΔcSiO2/η来综合分析同粒径下颗粒的熔解速率。

图14 实验中转炉渣的黏度-温度曲线Fig.14 Viscosity-temperature curve of converter slag in experiment
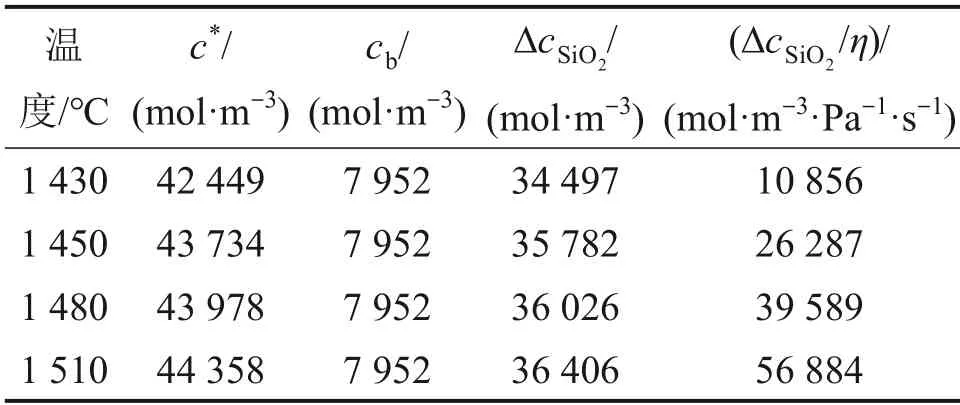
表3 不同温度下熔解驱动力ΔcSiO2/ηTable 3 Melting driving force ΔcSiO2/η at different temperatures
SiO2颗粒的熔解速率随温度升高逐渐增加,其原因是温度升高,颗粒与转炉渣间的反应速率增大,同时,SiO2在渣中的饱和熔解度增加,即颗粒熔解反应ΔcSiO2/η的驱动力提高;再者,熔融炉渣的黏度也随之减小,故而降低扩散传质的阻力,颗粒的熔解速率加快。在相同温度条件下,随着SiO2颗粒的粒径减小,熔解反应率逐渐升高。
本研究中转炉渣成分较为稳定,因而并未从实验角度考虑成分对SiO2颗粒熔解反应速率的影响,现仅定性简单分析各成分对熔解速率的影响。CaO 的含量决定炉渣的碱度,从而影响SiO2颗粒的熔解速率,此外,提高碱度可使炉渣黏度降低[21],而黏度降低可以减小扩散传质的阻力,加快颗粒的熔解速率。炉渣中的MgO 不但可以与SiO2或其他硅酸盐等反应生成低熔点的物质,而且可以破坏渣中硅氧复合阴离子SixOy2-的网状结构,使其复杂的离子团被迫解体,形成单一的四面体结构[22],从而使炉渣的流动性提高,降低扩散传质的阻力,促进SiO2颗粒的熔解,但MgO 含量过高会造成方镁石、尖晶石等高熔点的矿相生成,反而降低熔渣的流动性,使SiO2颗粒熔解速率降低。FeO可与SiO2反应生成低熔点的FeSiO3,从而降低熔渣的黏度,增加SiO2颗粒的熔解速率,但同时也会与CaO 反应生成高熔点的黑钙铁矿弥散在渣中,降低炉渣中自由CaO 的含量,导致颗粒表面的反应速率下降,不利于SiO2颗粒的熔解;Al2O3含量过高时会在渣中形成结构复杂的硅铝聚合物[23],此外还会生成镁铝尖晶石、铝酸一钙等高熔点物质,严重降低炉渣流动性,增加SiO2颗粒的熔解时间。
5 SiO2颗粒熔解反应的动力学参数
SiO2颗粒的熔解速率主要由反应速率控制,根据式(4)可求得不同温度下的反应速率常数krea,如表4所示。根据阿仑尼乌斯公式,将lnkrea对1/T做图(如图15所示),计算可知熔解反应的表观活化能为213.054 kJ/mol,再将结果代入式(7)可得出实验条件下SiO2颗粒在该熔渣体系中熔解动力学方程为


表4 不同温度下的熔解反应速率常数Table 4 Reaction rate constants of melting at different temperatures

图15 SiO2颗粒在该转炉熔渣中lnkrea与1/T的变化曲线Fig.15 Change curves of lnkrea and 1/T for melting of SiO2 particles in converter slag
6 结论
1) 熔解过程中观察到非球形导致颗粒的旋转和有角颗粒的圆角化。
2) 温度和颗粒粒径对熔解过程有明显影响,温度升高、粒径减小可提高熔解速率。温度每升高10 ℃总熔解时间降低7.63 s、平均熔解速率提高12.7%;粒径每增加0.1 mm 总熔解时间增加27.67 s、平均熔解速率降低2.15%。
3) SiO2颗粒熔解时与转炉渣之间无固态产物层形成,综合分析了温度、颗粒粒径以及转炉渣成分、黏度等对SiO2颗粒熔解速率的影响,并定义函数ΔcSiO2/η来衡量颗粒的熔解速率,ΔcSiO2/η越大,同粒径下颗粒的熔解速率越快。
4) SiO2颗粒在五元系CaO-SiO2-FeO-MgOAl2O3转炉渣的熔解主要受化学反应机理控制,其表观活化能约为213.054 kJ/mol,并确定了实验条件下SiO2颗粒在该转熔渣体系中的熔解动力学方程。

