elavl1a对斑马鱼生长发育的调控作用
洪子璞,张文振,陈聪德
温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.创面外科;2.小儿外科
胚胎及出生个体的生长发育是个相当复杂的过程,涉及到多个系统及组织。其中,内分泌系统的多种激素的缺欠可以导致生长发育迟滞。斑马鱼饲养成本低,便于大规模养殖,同时由于体外受精,体外发育,且其发育周期短,透明易观察,与人类相关的84%疾病基因在斑马鱼体内均能表达[1],正日渐成为重要的模式动物[2]。ELAVL1又名HUR,是一种可在细胞核内编码的RNA结合蛋白,在机体内全身性表达,除了对细胞增殖、分化具有重要的作用之外[3],近期还有研究显示它可以影响肠神经系统发育[4],也可能影响甲状腺激素及生长激素的分泌及生理作用[5-6],以上均提示ELAVL1的表达异常将可能引起生长发育障碍。为了探究ELAVL1对个体发育及生长的影响,本文通过运用CRISP-Cas9技术定向敲除斑马鱼5个核苷酸序列,从而提前终止蛋白翻译来影响elavl1a蛋白的表达,来获得斑马鱼敲除elavl1a后生长发育迟滞的模型,并为后续探究其可能的机制做前期工作。
1 材料和方法
1.1 动物及饲养繁育材料 野生AB型斑马鱼品系(D.rerio)从国家斑马鱼资源中心购买,参照斑马鱼手册进行标准化养殖[7]。野生型和突变型胚胎在胚胎培养液(E3:0.5 mmol/L氯化钠,0.17 mmol/L氯化钾,0.33 mmol/L氯化钙,0.33 mmol/L氯化镁)中于28.5 ℃进行培育。按照10 L的水缸放置15条成鱼的标准养殖,在14 h光照、10 h黑暗的周期下,每天进行循环换水。产卵前,提前1 d将鱼按照雌雄1∶1的比例放入一个水槽中并用隔板分开,第2天灯亮后拔出隔板进行交配。2个月以上的斑马鱼通过剪尾鳍提取DNA进行基因型鉴定。
1.2 主要试剂与仪器 Taq DNA聚合酶、T7 RNA Polymerase-PlusTMEnzyme Mix、Nanodrop2000/2000C分光光度计购于美国Thermo Fisher公司,Pyrobest DNA Polymerase、dNTP购于日本TAKARA公司,DR274质粒与MLM3613质粒购于美国Addgene公司。所有引物合成和DNA序列测定均由上海迈浦生物科技有限公司进行。
1.3elavl1agRNA靶点设计 通过gRNA在线设计工具CHOPCHOP(http∶//chopchop.cbu.uib.no/)查找gRNA序列。同时在NCBI(https∶//www.ncbi.nlm.nih.gov/)验证相应序列,并根据靶点设计上下游引物,送上海迈浦生物科技有限公司合成。靶点序列及上下游引物见表1。

表1 斑马鱼elavl1a敲除靶点及引物
1.4 gRNA mRNA与Cas9 mRNA合成 参照DR274质粒2~4 ng,P1 引物(10 μmol/L)1 μL,P4 引物(10 μmol/L)1 μL,pryobest DNAPolymerase缓冲液6 μL,pryobest DNA Polymerase 0.5 μL,加入适量的灭菌水至60 μL,PCR反应按照95 ℃ 30 s;35×(95 ℃ 30 s,50 ℃ 20 s,72 ℃ 20 s);72 ℃ 10 min;16 ℃进行。PCR产物在1%琼脂糖胶电泳30 min,观察PCR结果。
苯酚-氯仿纯合模板DNA后参照NTP(10 mmol/L)1 μL,10×反应缓冲液2 μL,模板DNA 0.2~1 μg,T7 RNA Polymerase-PlusTMEnzyme Mix 2 μL,RNase inhibitor 1 μL,加入DEPC水至20 μL,37 ℃反应3 h。反应完成后沉淀并纯化gRNA,检测浓度后,DECP水稀释后分装存于-80 ℃冰箱。
将MLM3613质粒线性化后,参照合成gRNA mRNA方法合成Cas9 mRNA,检测浓度后,DECP水稀释后分装存于-80 ℃冰箱以备使用。
1.5 显微注射 将转录获得的gRNA与Cas9 mRNA按照100 ng/μL∶150 ng/μL的比例稀释。在斑马鱼胚胎处于单细胞时期进行显微注射,每个胚胎注射体积为2 nL。注射后使用胚胎培养液收集于28.5 ℃培养箱培育,第4天随机挑出10个胚胎使用基因裂解液[在984 μL灭菌水中加入Tris Hcl(pH 8.0)100 μL,EDTA 40 μL,Triton 100% 20 μL混匀]裂解,使用P3与P4引物进行PCR扩增,PCR反应条件按照95 ℃ 30 s;35×(95 ℃ 30 s,55 ℃ 20 s,72 ℃ 20 s);72 ℃ 5 min;4 ℃保存。2%琼脂糖胶电泳30 min,观察PCR结果。送上海迈浦生物科技有限公司测序,以野生AB型斑马鱼为对照组,根据测序峰图分析gRNA工作情况与显微注射结果,并进行相应调整。
1.6 突变体筛选 2个月大小的F0代斑马鱼通过分离鱼鳍裂解基因组DNA,使用P3与P4引物进行PCR扩增后送上海迈浦生物科技有限公司测序。根据峰图选取敲除效果较好的斑马鱼与野生型AB品系斑马鱼进行测交获得F1 代,F1 代同样通过测序或者使用NEBcutter查询酶切位点(http∶//nc2.neb.com/NEBcutter2/)筛选出突变位点相同的斑马鱼进行自交获得F2 代,F2 代同样通过测序或者使用NEBcutter查询酶切位点筛选出纯合突变体。
1.7 Western blot 分离野生型斑马鱼与突变体斑马鱼鱼鳍,加入内含0.1%磷酸酶抑制剂和0.1%蛋白酶抑制剂的RIPA细胞裂解液,通过碾磨裂解蛋白,4 ℃预冷离心机15 000 r/min离心30 min后收取上清。BCA法检测蛋白浓度,加入适量上样缓冲液后95 ℃变性5 min,上样进行电泳。
1.8 统计学处理方法 使用SPSS25.0进行统计学分析,ApE工具进行核苷酸序列和氨基酸对比分析。Image J工具分析Western blot结果。采用Adobe Photoshop CC 2019工具进行图像处理。
2 结果
2.1elavl1a突变体斑马鱼gRNA的设计 通过gRNA在线设计工具CHOPCHOP输入目标基因寻找序列,通过NCBI比对后选择合适的目标位点及引物,最后在第2个外显子上得到目标设计位点(见图1)。
2.2elavl1a突变体斑马鱼繁殖鉴定 将CRISPRCas9技术构建取得的elavl1aF0代突变体斑马鱼与野生型斑马鱼杂交,得到F1代突变体斑马鱼,通过基因型测定和外送测序得到同一型F1代突变体,再通过自交,经基因鉴定和外送测序得到F2代纯合子,elavl1a-/-突变体基因型鉴定没有拖带,测序发现elavl1a-/-I型突变体斑马鱼缺少5 个核苷酸,II型突变体斑马鱼缺少10个核苷酸(见图2)。
2.3elavl1a-/-突变体斑马鱼的鉴定 通过APE软件分析,以I型为例,得到的elavl1a-/-突变体斑马鱼氨基酸提前出现终止密码,且Western blot检测发现蛋白表达减少(见图3)。
2.4elavl1a-/-突变体斑马鱼数量表型统计 统计分析获得的成年F2代斑马鱼数量,发现其中野生型和杂合子与elavl1a-/-纯合子数量之间不符合1∶2∶1的孟德尔遗传规律(见表2),且对同一批产的突变体斑马鱼的进行形态观察后发现,elavl1a-/-纯合子斑马鱼存在明显的发育迟缓(见图4)。
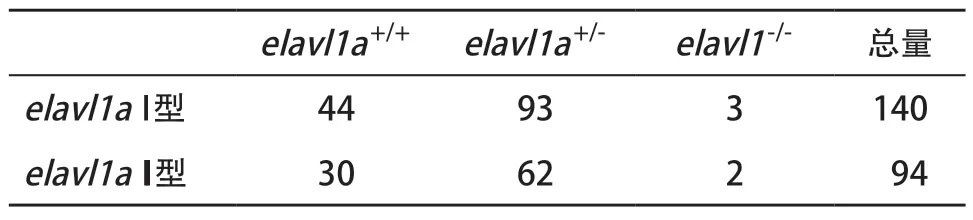
表2 两种elavl1a-/-突变体斑马F2代数量统计图
3 讨论
随着CRISPR-Cas9技术在细胞及发育生物学的应用,大量新的研究方法产生。在动物模型基因敲除突变体的构建中,CRISPR-Cas9同样也适用于同源基因的敲入[8]和F0 代基因序列的筛查[9]。因此我们根据基因数据库查找elavl1a的基因序列,并设计相对应的gRNA序列,通过显微注射入斑马鱼胚胎中。最近研究显示有其他Cas蛋白可用于编辑DNA(Cas12a)[10]和RNA(Cas13)[11],我们所设计的gRNA通过CRISPR-Cas9能够成功地敲除elavl1a第2个外显子部分序列,并通过PCR跑胶和基因测序验证所敲除基因序列的确切位置,PCR跑胶后出现两条的说明为杂合子序列,单个基因条带为敲除纯合子或者野生型斑马鱼,再通过基因测序峰图能清楚验证基因敲除结果。
测序结果表明,该CRISPR-Cas9可以诱导序列的敲除,I型elavl1a-/-突变体成功敲除5 个核苷酸序列,II型elavl1a-/-突变体敲除10个核苷酸,通过与野生型斑马鱼基因组比对分析发现,所敲除核苷酸序列能使终止密码子提前,从而减少elavl1a蛋白的表达,影响elavl1a蛋白在机体内的功能。我们通过Western blot技术验证敲除elavl1a后蛋白的表达情况,其结果如我们前期预测的elavl1a蛋白表达量明显降低。
ELAVL1/HuR是RNA结合蛋白ELAVL1/Hu家族的四个成员之一,其他的家族成员HuB、HuC和HuD主要在神经元中表达,上述三类基因可以诱导神经元分化,继而促进神经元发育与成熟,且HuC和HuD的抗体可以作为神经标记物[12]。本课题组已发表的研究证明,elavl1a是斑马鱼肠神经发育过程中重要基因,通过morpholino特异性敲降elavl1a会减少斑马鱼幼鱼肠神经元细胞数量[4]。肠神经系统通过调节胰岛素、胰高血糖素、多肽等,对调节个体营养发育起到重要作用[13]。因此,敲除elavl1a,可能会影响斑马鱼肠神经系统的发育,从而影响胃肠运动或内分泌代谢与营养吸收,进而导致大量死亡,且少部分发育迟滞。通过培育出的elavl1a缺失的模型,可以进一步进行这一基因对肠神经系统的机制及影响的研究。
既往的研究表明,elavl1a可以通过调节RNA转录后调控网络和发挥免疫活性蛋白等作用,对斑马鱼早期胚胎形成保护起到重要作用[14-15]。elavl1a可以通过gata1和PKC之间的调控调节斑马鱼的红细胞生成[16-17]。本课题组前期研究表明在肿瘤细胞中敲降ELAVL1后会抑制细胞增殖[18]。既往已有多项研究提示ELAVL1在甲状腺恶性肿瘤中高度表达,对细胞增殖存在促进作用,有研究显示ELAVL1表达量与甲状腺滤泡细胞增殖率呈正相关[19],相反的,沉默ELAVL1后可导致非肿瘤的甲状腺细胞系细胞活性减低并凋亡[5]。因此,敲除ELAVL1后,可能会影响斑马鱼甲状腺细胞的发育,从而影响甲状腺激素的合成及分泌,进而导致发育迟滞。有研究报道PAI2聚集能加速人类生长激素mRNA的降解,PAI2 mRNA在机体内极不稳定,半衰期仅为1 h,ELAVL1能与PAI2-3’UTR区域AU富集区域结合,稳定PAI2 mRNA的表达[6],从而我们推测由于敲除了斑马鱼体内的elavl1a基因,导致PAI2在体内自身的不稳定,会不断合成新的PAI2 mRNA,从而能不断促使生长激素mRNA降解,导致缺乏生长激素使得斑马鱼的生长发育受到限制。elavl1a缺失的模型可以对斑马鱼生长发育迟缓原因进行进一步研究。
综上所述,本研究通过CRISPR-Cas9技术构建突变体斑马鱼,测序发现敲除的序列能使蛋白翻译的终止密码提前。通过酶切位点分析及基因序列测序分析筛查转基因斑马鱼,并通过Western blot发现,突变体斑马鱼elavl1a蛋白明显降低,从而成功验证了elavl1a在斑马鱼模型中的基因及蛋白敲除。最后我们通过统计分析成功构建转基因斑马鱼的数目,发现转基因斑马鱼并未遵循孟德尔遗传定律,纯合子数目明显偏少,这可能是因为elavl1a敲除后影响斑马鱼肠神经系统和胚胎发育,从而影响转基因斑马鱼数目。通过存活斑马鱼表型分析发现,纯合子敲除斑马鱼个体明显小于杂合子个体,进一步说明elavl1a对斑马鱼发育起重要作用,且这种作用可能是通过影响包括肠神经系统和甲状腺激素及生长激素在内的激素而达成,但仍需有后续的工作进一步去阐释可能机制。综上,此次研究为我们后续研究elavl1a在斑马鱼内机体功能研究提供了研究基础。

