黑胸散白蚁工蚁与工蚁型补充生殖蚁体内抗氧化酶和解毒酶的活性及基因表达变化
董亚楠,牛 童,吴 佳,王 超,张 贺
(1.西北工业大学生态环境学院,西安 710129;2.西安外事学院医学院,西安 710077;3.郑州大学附属肿瘤医院病理科,郑州 450008)
黑胸散白蚁Reticulitermeschinensis属等翅目(Isoptera)鼻白蚁科(Rhinotermitidae)散白蚁属Reticulitermes(蔡邦华和陈宁生,1964),是我国分布最广泛、危害最严重的白蚁种类之一(尉吉乾等,2010)。其群体小,巢群分散,蚁巢结构简单,无主、副巢之分,适应性强,极易产生补充型生殖蚁,是防治难度较大的原因(严少辉等,2012)。补充生殖蚁包括由若蚁分化来的翅芽型生殖蚁和工蚁分化来的无翅芽型生殖蚁(刘明花等,2014)。成熟巢群中,补充型生殖蚁主要由若蚁分化而来,而在原始生殖蚁生殖力不足的无若蚁巢中,补充型生殖蚁主要由工蚁分化而来(张小晶等,2015)。
近些年国内外学者对于若蚁、若蚁型补充生殖蚁以及原始生殖蚁的产生规律、发育和生理机制等都进行了相关研究报道。原始生殖蚁由若蚁发育而来,在此过程中,若蚁的鲜重会逐渐降低,体内的甘油三酯的滴度会逐渐增加,为分飞提供能量。而在分飞后生殖蚁体内的能量有明显降低,与飞行相关的肌肉有明显的退化现象。建巢后生殖蚁体内的蛋白水平及葡萄糖和甘油三脂滴度会在建巢初降低,但在7.5个月时上升并达到最高水平(Lietal.,2015,2021;Zhangetal.,2021)。张小晶等(2015)阐明了圆唇散白蚁Reticulitermeslabralis的若蚁型生殖蚁发育过程中卵黄蛋白原基因表达呈现先升高后降低的动态变化模式,并记录了若蚁型生殖蚁的产卵量;王怡等(2019)详细介绍了黑胸散白蚁若蚁型补充生殖蚁的分化表型特征,以及群体组成、数量、成熟程度和取食等对其分化的影响;Harrison等(2021)对工蚁、原始生殖蚁和若蚁等进行转录组测序,分析了相应的品级分化基因;张磊等(2021)鉴定了品级分化过程中表皮信息素6,9-二十九二烯烃、6,9-三十一烷、6,9,17-三十二烷和 6,9,17-三十三烷仅蚁王和蚁后体内存在,对工蚁型补充生殖蚁的研究集中于工蚁分化过程中保幼激素和蜕皮激素的含量变化(Elliott and Stay,2007,2008;Oguchietal.,2020;Milaceketal.,2021),而对于其分化完成后关于生殖和衰老的生理生化特征研究甚少。
已有报道证明有效的抗氧化系统是生殖品级长期活跃产卵并且保持长寿的秘诀(Tasakietal.,2017,2021;Krameretal.,2021)。工蚁分化形成补充生殖蚁后能参与生殖(Hayashietal.,2006),其是否与原始生殖蚁具有类似的抗氧化系统?过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)是抗氧化体系中重要的抗氧化剂和自由基清除剂,能够将机体内新陈代谢所产生的有毒过氧化物通过氧化还原作用转化为毒害较低或者无害的物质,有效延缓机体衰老(Arhontakietal.,2002;吴启仙和夏嫱,2014)。酸性磷酸酶(acid phosphatase,ACP)、碱性磷酸酶(alkaline phosphatase,AKP)、羧酸酯酶(carboxylesterase,CarE)和细胞色素P450(cytochrome P450,CYP450)是昆虫体内重要的解毒酶,主要参与外源毒物的初生代谢(水解、氧化、还原等酶促反应)和次级代谢(共轭反应)过程,能够分解代谢农药、植物次生代谢产物等外源毒物,维持昆虫正常生理生化活动(王康等,2017)。此外,ACP参与卵母细胞的退化与吸收(Rajalakshmi and Mohandas,2005;Zhangetal.,2012),AKP参与卵泡细胞中激素的吸收运转保证卵球的成熟(Weietal.,2015)。
工蚁分化成补充生殖蚁后,迅速进入产卵状态,其产卵量远远高于若蚁型生殖蚁(唐国清和刘源智,1990),对巢群发展和稳定具有重要作用。本研究拟通过测定工蚁型补充生殖蚁、工蚁和原始生殖蚁的抗氧化酶、解毒酶的酶活力和基因表达水平,从生理和分子水平上阐明工蚁型补充生殖蚁的生殖潜能和延缓衰老能力,揭示其在巢群发展和扩张中的重要作用,给工蚁转化成生殖蚁提供理论补充,为掌握白蚁群体发展规律及其生物防治和应用开发提供依据。
1 材料与方法
1.1 供试昆虫
供试黑胸散白蚁于2021年4月采自南京市中山陵。将整个蚁巢带回实验室后放入塑料箱(长×宽×高=30 cm×40 cm×50 cm)内饲养,适量添加松木块,定期补充水分,并放置在20~26℃自然光照条件下的实验室中,以用于后续实验。
1.1.1雌雄成虫配对:成虫婚飞当天在实验室收集巢内飞出的黑胸散白蚁成虫,然后立即根据其雌雄腹板的差别(雌性成虫的第7腹板相比于雄性成虫较宽)进行性别鉴定,并分别放在不同的培养皿里饲养,培养皿内放入湿润的滤纸,待人工脱翅后进行雌雄配对。将所配对的婚飞成虫放入直径2.5 cm、高5.5 cm的透明塑料瓶内,瓶内含有灭菌后用蒸馏水湿润的压实的锯末,在靠近瓶口处放一小团脱脂棉,用蒸馏水浸湿,以保持瓶内环境的湿度,并定期补充水分;每个瓶中仅放入一对婚飞蚁饲养;瓶盖轻轻盖上,保持通气。每组配对处理设置60组重复。配对饲养过程中,每天观察各组白蚁的活动与死亡情况,记录各组白蚁的行为特点与产卵时间,待第一波卵完全产生后,随机取出5~10组成虫个体待测。
1.1.2补充生殖蚁培养:待黑胸散白蚁成虫婚飞后,将工蚁从巢内剖出,以200头左右分离培养于90 mm的培养皿中(培养皿中铺有浸湿的滤纸),并使用保鲜膜环绕培养皿1周以保持水分;将处理好的白蚁放置于湿度70%±5%、温度26±2℃的培养箱中,定期补充水分,20~30 d之后,待培养皿中部分工蚁变成补充生殖蚁并产卵后,取出补充生殖蚁及其对应的工蚁待测。
1.2 粗酶液制备及酶活力测定
选取工蚁2头为一组,工蚁型补充生殖蚁1头为一组,原始生殖蚁2头为一组,各6组重复。准确称重后用蒸馏水清洗,再用95%的酒精体表消毒,消毒后将其置于1.5 mL离心管中,根据重量(g)∶体积(mL)=1∶9的比例加入9倍体积的磷酸缓冲液(PBS),冰浴条件下机械匀浆,涡旋混匀,匀浆液在4℃ 12 000 r/min 条件下离心10 min,得离心后取上清液即为粗酶液,保存于-80℃超低温冰箱待测。本实验所用总蛋白含量,CAT,SOD,AKP,ACP,GarE和CYP450试剂盒均由南京建成生物工程研究所提供,所有操作均按照试剂盒说明书严格执行。
1.3 RNA提取和cDNA合成
根据RNeasy Mini Kit(QIAGEN)试剂盒方法提取成年雌雄工蚁、转化完成并产卵的雌雄工蚁型补充生殖蚁和交配产卵的雌雄原始生殖蚁总RNA,用Promega反转录试剂盒 GoScriptTMReverse Transcription Mix,Oligo(dT)分别制备各cDNA样本。
1.4 qRT-PCR
qRF-PCR采用QuantiNovaTMSYBR(Green PCR Kit(QIAGEN)试剂盒。以成年雌雄工蚁、转化完成并产卵的雌雄工蚁型补充生殖蚁和交配产卵的雌雄原始生殖蚁的cDNA为模板,并以β-actin作为内参基因(Zhouetal.,2007)进行qRT-PCR,检测抗氧化酶和解毒酶基因RsCAT,RsSOD,RsACP,RsCYP450和RsCarE的表达量,引物信息见表1。PCR反应体系(20 μL):SYBRGreen PCR Master Mix 10 μL,QN ROX Reference Dye 2 μL,正反向引物(10 μmol/L)各1.4 μL,模板cDNA 2 μL,ddH2O 3.2 μL。扩增程序:95℃预变性2 min;95℃变性5 s,60℃退火10 s,40个循环。

表1 引物信息Table 1 Primer information
1.5 数据分析
采用 Microsoft Excel 2013统计处理试验数据,其中细胞色素P450的数据采用Elisacalc软件拟合标准曲线及数据处理。整理后的数据使用IBM SPSS Statistic 22.0中的单因素方差分析(one-way ANOVA)中的LSD多重比较进行分析,所有实验结果均采用GraphPad Prism7 软件作图。全部数据均为平均值±标准误,以P<0.05作为差异显著性标准。
2 结果
2.1 工蚁、补充生殖蚁和原始生殖蚁中抗氧化酶的活性及基因表达差异
工蚁和原始生殖蚁体内的抗氧化酶酶活性及基因表达量与补充生殖蚁都有显著性差异,如图1和2所示。补充生殖蚁的CAT活性显著高于工蚁的(雌性:P<0.001;雄性:P<0.001)和原始生殖蚁(雌性:P<0.001;雄性:P<0.001)的,是雌性工蚁的5.82倍(图1:A,B)。同时,雌性原始生殖蚁的CAT活性显著高于工蚁的(P=0.05)(图1:A)。补充生殖蚁的SOD活性显著高于工蚁的(雌性:P=0.002;雄性:P<0.001),是雌性工蚁的1.41倍,但与原始生殖蚁的无显著差异(雌性:P=0.076;雄性:P=0.156)(图1:C,D)。然而,雄性原始生殖蚁的SOD活性显著高于雄性工蚁的(P<0.001)(图1:D)。雌性补充生殖蚁的RsCAT表达量显著高于雌性工蚁的(P=0.003)和雌性原始生殖蚁的(P=0.001),是雌性原始生殖蚁的5.68倍(图2:A);雄性补充生殖蚁的RsCAT表达量显著高于雄性工蚁的(P=0.002)和雄性原始生殖蚁的(P=0.005),是雄性原始生殖蚁的3.60倍(图2:B)。雌性补充生殖蚁的RsSOD表达量显著高于雌性工蚁(P=0.001)和雌性原始生殖蚁的(P<0.001)(图2:C);雄性补充生殖蚁的RsSOD表达量与雄性工蚁(P=0.590)和雄性原始生殖蚁的(P=0.422)无显著差异(图2:D)。此外,无论是雌性还是雄性,工蚁和原始生殖蚁的RsCAT和RsSOD表达量均没有显著性差异(P>0.05)(图2)。

图1 黑胸散白蚁工蚁、补充生殖蚁和原始生殖蚁体内抗氧化酶CAT(A,B)和SOD(C,D)的活性Fig.1 Activities of antioxidant enzymes CAT (A,B) and SOD (C,D) in workers,ergatiod reproductives and primary reproductives of Reticulitermes chinensisCAT:过氧化氢酶Catalase;SOD:超氧化物歧化酶Superoxide dismutase;FW:雌性工蚁Female worker;MW:雄性工蚁Male worker:FE:雌性补充生殖蚁Female ergatoid reproductive;ME:雄性补充生殖蚁Male ergatoid reproductive;Q:原始生殖蚁后Queen in primary reproductive;K:原始生殖蚁王King in primary reproductive.图中数据为平均值±标准误;柱上不同小写字母表示差异显著(P<0.05)(one-way ANOVA,LSD检验)。Data in the figure are mean±SE.Different small letters above indicate significant difference measured using one-way ANOVA followed by LSD test (P<0.05).下图同。The same for the following figures.
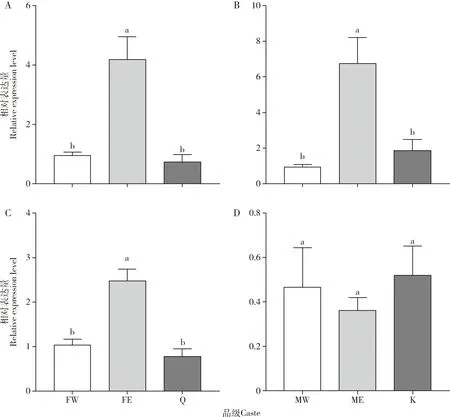
图2 黑胸散白蚁工蚁、补充生殖蚁和原始生殖蚁体内RsCAT(A,B)和RsSOD(C,D)的相对表达量Fig.2 Relative expression levels of RsCAT (A,B) and RsSOD (C,D) in workers,ergatiod reproductives and primary reproductives of Reticulitermes chinensis
2.2 工蚁、补充生殖蚁和原始生殖蚁中解毒酶活性及基因表达差异
补充生殖蚁体内解毒酶活性显著提高。补充生殖蚁的ACP活性显著高于工蚁的(雌性:P=0.001;雄性:P=0.007)和原始生殖蚁的(雌性:P<0.001;雄性:P<0.001),是雌性工蚁的1.39倍(图3:A,B)。工蚁的ACP活性也显著高于原始生殖蚁的(雌性:P=0.001;雄性:P=0.043)(图3:A,B)。补充生殖蚁的AKP活性显著高于工蚁的(雌性:P=0.029;雄性:P=0.016),是雌性工蚁的2.27倍,但与原始生殖蚁的无显著差异(雌性:P=0.143;雄性:P=0.168)(图3:C,D)。雌性补充生殖蚁的RsACP表达量显著高于雌性工蚁的(P<0.001)和雌性原始生殖蚁的(P<0.001),是雌性原始生殖蚁的81.12倍(图4:A);雄性补充生殖蚁的RsACP表达量显著高于雄性工蚁的(P=0.001)和雄性原始生殖蚁的(P=0.001),是雄性原始生殖蚁的46.72倍(图4:B)。工蚁和原始生殖蚁的RsACP表达量没有显著性差异(P>0.05)(图4)。
雌性补充生殖蚁的CarE活性显著高于雌性工蚁的(P<0.001)和雌性原始生殖蚁的(P<0.001),是雌性工蚁的2.70倍(图5:A);雄性补充生殖蚁的CarE活性与雄性工蚁(P=0.988)和雄性原始生殖蚁的(P=0.111)(图5:B)无显著差异。补充生殖蚁的CYP450活性与工蚁的(雌性:P=0.502;雄性:P=0.367)和原始生殖蚁的(雌性:P=0.096;雄性:P=0.833)无显著差异(图5:C,D)。雌性补充生殖蚁的RsCarE表达量显著高于雌性工蚁(P<0.001)和雌性原始生殖蚁的(P<0.001)(图6:A);雄性补充生殖蚁的RsCarE表达量与雄性工蚁(P=0.907)和雄性原始生殖蚁的(P=0.590)无显著差异(图6:B)。雌性补充生殖蚁的RsCYP450表达量显著高于雌性工蚁(P<0.001)和雌性原始生殖蚁的(P<0.001)(图6:C);雄性补充生殖蚁的RsCYP450表达量显著高于雄性工蚁的(P=0.009),但与雄性原始生殖蚁的(P=0.078)没有显著差异(图6:D)。此外,工蚁和原始生殖蚁的RsCarE和RsCYP450表达量也没有显著性差异(P>0.05)(图6)。
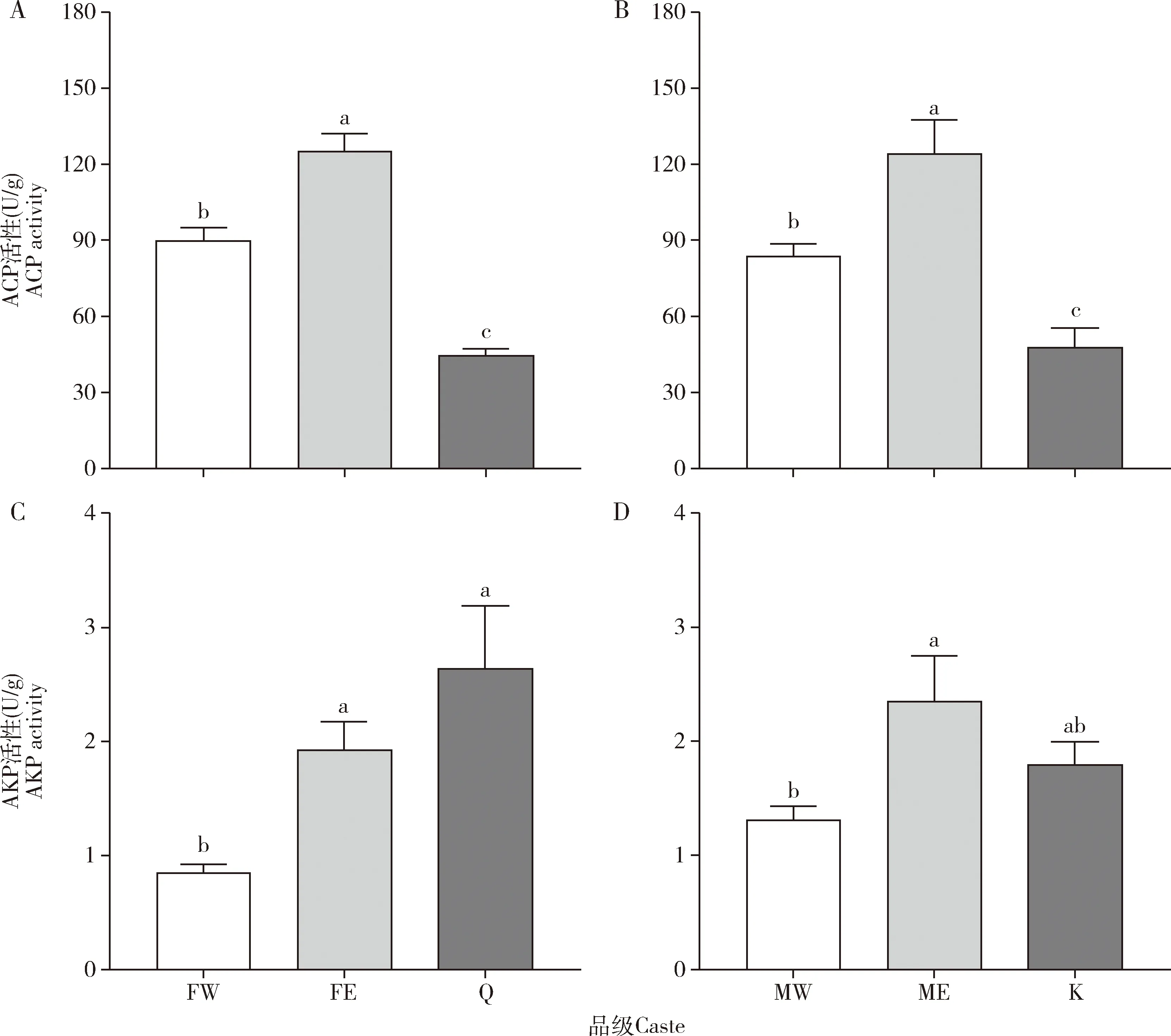
图3 黑胸散白蚁工蚁、补充生殖蚁和原始生殖蚁体内解毒酶ACP(A,B)和AKP(C,D)的活性Fig.3 Activities of detoxification enzymes ACP (A,B) and AKP (C,D) in workers,ergatiod reproductives and primary reproductives of Reticulitermes chinensisACP:酸性磷酸酶Acid phosphatase;碱性磷酸酶Alkaline phosphatase.
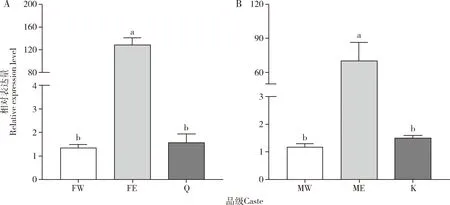
图4 黑胸散白蚁工蚁、补充生殖蚁和原始生殖蚁体内RsACP的相对表达量Fig.4 Relative expression levels of RsACP in workers,ergatiod reproductives and primary reproductives of Reticulitermes chinensis

图5 黑胸散白蚁工蚁、补充生殖蚁和原始生殖蚁体内解毒酶CarE(A,B)和CYP450(C,D)的活性Fig.5 Activities of detoxification enzymes CarE (A,B) and CYP450 (C,D) in workers,ergatiod reproductives and primary reproductives of Reticulitermes chinensisCarE:羧酸酯酶Carboxylesterase;CYP450:细胞色素P450 Cytochrome P450.
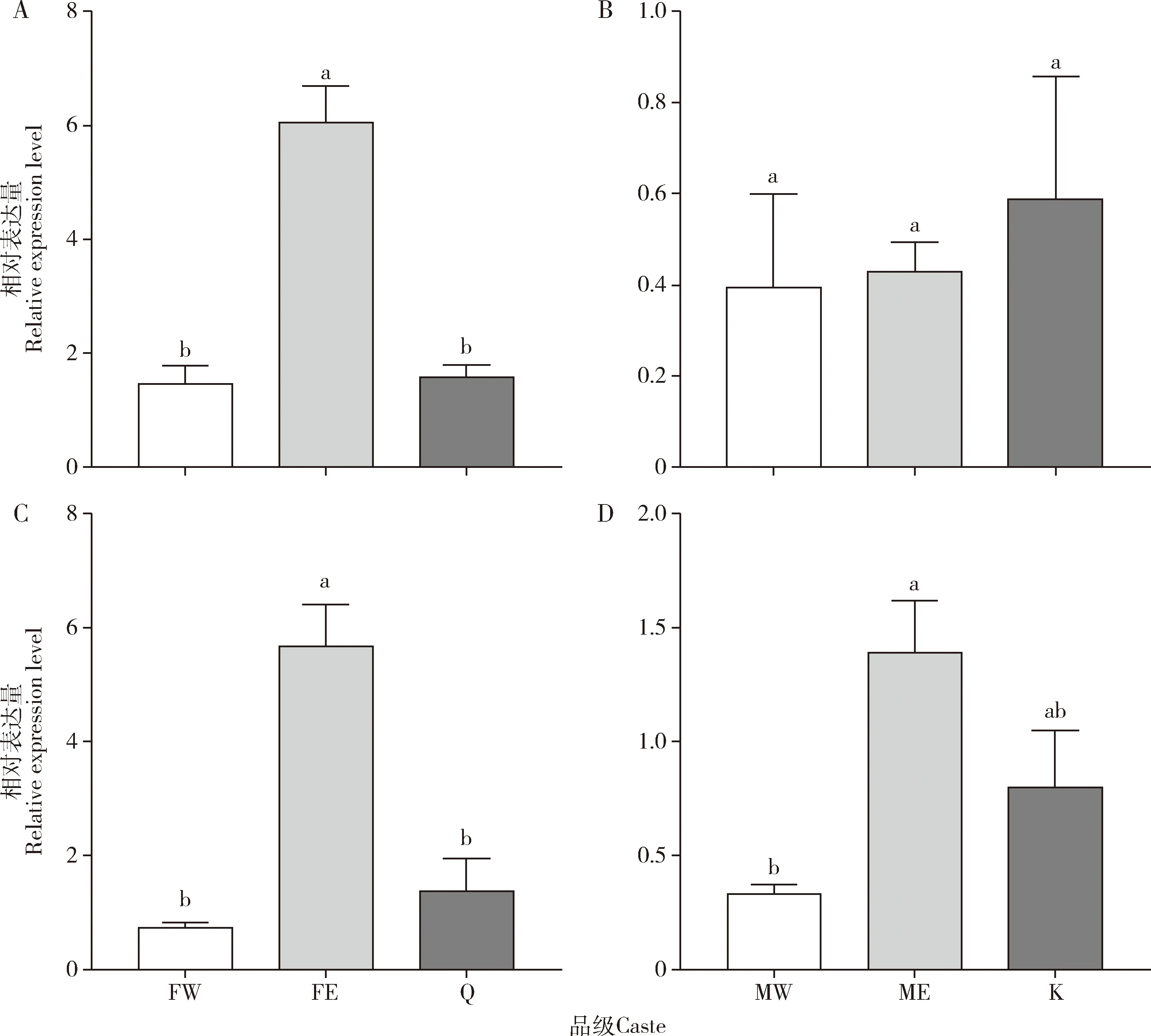
图6 黑胸散白蚁工蚁、补充生殖蚁和原始生殖蚁体内RsCarE(A,B)和RsCYP450(C,D)的相对表达量Fig.6 Relative expression levels of RsCarE (A,B) and RsCYP450 (C,D) in workers,ergatiod reproductives and primary reproductives of Reticulitermes chinensis
3 讨论与结论
本研究对比了工蚁、工蚁型补充生殖蚁和原始生殖蚁体内抗氧化酶活性和基因表达量的差异,发现工蚁转化成补充生殖蚁后,其CAT和SOD活性和基因表达量都有显著提高(图1和2),这表明工蚁转化为补充生殖蚁后通过提高体内抗氧化酶的活性和基因表达水平延缓了衰老速度;而其CAT的活性和基因表达量以及SOD的基因表达量都高于原始生殖蚁的,SOD活性与原始生殖蚁的没有显著性差异(图1和2)。原始生殖蚁婚飞建巢以后,需要承担繁重的巢群维护和育幼工作,建巢第一年大约产7~10颗卵,而工蚁转变成补充生殖蚁后受到其他工蚁的照料,会立即进入产卵状态,其产卵速率以及产卵量都远远高于原始生殖蚁的,Schrempf等(2005)在蚂蚁中证实交配会增加寿命,而交配和繁殖率高的补充生殖蚁的CAT活性显著高于产卵率低的原始生殖蚁的也从侧面印证了这一点,但还有待证实。
代谢解毒是昆虫抵抗寄主植物的防御反应和化学杀虫剂毒杀的重要途经(袁星星等,2020),解毒酶活性的增加有助于昆虫抵抗毒素。Banerjee(1967)对工蚁、兵蚁和生殖蚁体内AKP活性进行检测,研究结果表明生殖蚁体内AKP活性高于工蚁和兵蚁的。本研究中检测了工蚁、工蚁型补充生殖蚁和原始生殖蚁体内的AKP活性,雌雄补充生殖蚁体内AKP活性分别达到工蚁的2.27和1.80倍,与原始生殖蚁没有显著差异(图3:C,D),这与Banerjee (1967)的结果基本一致。同时我们也检测了ACP的活性和基因表达量,雌雄补充生殖蚁体内ACP的活性相较工蚁提高了39%和48%,基因表达水平分别达到工蚁的95.49和59.78倍(图3:A,B;图4:A,B)。磷酸酶是机体的解毒酶之一,同时也参与卵母细胞的退化与吸收与卵泡细胞中激素的吸收运转,而工蚁转化为补充生殖蚁后,其最重要的职能就是产卵,AKP和ACP活性的提高促进了补充生殖蚁的产卵。CarE是昆虫体内重要的解毒酶之一。高祖鹏等证明昆虫通过提高CarE等解毒酶的活性,加速代谢有毒物质,提高自身抗药性(Scott,1999;高祖鹏,2020)。Field等(1999)以及Field和Devonshire(1998)在研究中发现CarE活性与昆虫对有机磷的抗药性倍数成正相关。我们经过实验检测,发现补充生殖蚁体内CarE活性是工蚁的3倍(图5:A)。补充生殖蚁升高的CarE活性提高了其抵抗外界毒素的能力,有助于其维持自身的良好状态,进行正常的生理活动以维持巢群的稳定。
黑胸散白蚁广泛分布于我国北京、天津、山西、陕西、四川和长江流域,以植物、木质材料为食,对建筑物及森林造成重大破坏,是损害房屋建筑的主要元凶之一。Huang等(2013) 对采集自我国不同地区的黑胸散白蚁进行了遗传分析,发现重庆的白蚁群体存在两个不同的遗传结构,来源于采样地的两次建筑施工,其中一个群体与长沙的样本有相似的遗传结构,这可能是由于人类活动导致其进行了长距离迁移。除此以外,Wu等(2019)在对黑胸散白蚁的研究中发现,黑胸散白蚁与黄胸散白蚁婚飞期有交叉,但是两种白蚁在配对选择上没有种间偏好,并且都能够杂交产生后代。这无疑提高了黑胸散白蚁的适应性,但同时也增加了其防治难度。
白蚁蚁群由蚁王蚁后发展而来,蚁王蚁后在建巢前后会经历大量生理变化(Lietal.,2015,2021;Zhangetal.,2021),建巢后产卵量较少,卵孵化的成功率较低,巢群发展缓慢(彭晓涛等,2009)。在低等白蚁中,当巢群发展到一定规模,就会有补充生殖蚁产生,补充生殖蚁完成转化后会立即进入产卵阶段,产卵数量高于建巢初期的原始生殖蚁(唐国清和刘源智,1990),其危害性更高。因此对于补充生殖蚁的生理研究有助于掌握白蚁群体发展规律,深入了解白蚁巢群生存和扩张的机理,对开展生物防治和白蚁类资源的研究有重要意义。

