钙敏感受体在急性淤胆型肝炎模型大鼠中的表达及大黄素的作用
郑文彬, 鄢素琪, 汤建桥, 周俪姗, 黄 娟, 熊小丽, 江治霞*
(1.华中科技大学同济医学院附属武汉儿童医院中西医结合科,湖北 武汉 430016;2.华中科技大学同济医学院附属武汉儿童医院病理科,湖北 武汉 430016)
婴儿胆汁淤积性肝病是指在婴儿期以肝细胞和胆管内胆汁淤积为特征的常见且复杂的肝脏疾病[1],是婴儿肝病就诊和入院治疗的首要原因,也是婴儿期致死或致残的重要原因之一[2]。但是目前用于治疗婴儿胆汁淤积性肝病的药物中,作用机制研究较清楚且具有循证医学证据的不多,临床使用有限。钙敏感受体(calcium sensitive receptor,CaSR)属于G蛋白耦联受体,1993年首次从牛甲状旁腺中克隆出来[3],其存在于许多组织器官中,CaSRmRNA表达增加或减少与多种疾病密切相关[4]。课题组前期研究表明大黄素可以通过促进法尼醇X受体(FXR)表达缓解α-异硫氰酸萘酯诱导大鼠肝内胆汁淤积[5],且CaSR参与了胆汁淤积的发生[6],本研究将探讨CaSR在急性淤胆型肝炎模型大鼠中的表达及大黄素的作用。
1 材料
1.1 动物 SPF级离乳后幼龄SD大鼠30只,雌雄各半,体质量70~90 g,购自湖北省疾病预防控制中心,实验动物使用许可证号SYXK(鄂)2010-0057。饲养于华中科技大学同济医学院实验动物部屏障系统 (设施使用编号00132888),温度(22±1)℃,12 h/12 h昼/夜交替循环,自由进食饮水。所有实验均按照国家卫生研究院《哺乳动物护理与使用规范》进行,并经华中科技大学同济医学院实验动物伦理委员会批准([2016] IACUC编号2313)。
1.2 试剂与药物 α-异硫氰酸萘酯(批号STBD6070V)购自美国Alfa Aesar公司;熊去氧胆酸胶囊(批号17D20586L)购自德国Losan Pharma GmbH公司;醋酸地塞米松片(批号170206)购自浙江仙琚制药股份有限公司;大黄素(批号043K35051V)购自美国Sigma公司。花生油(批号SLKD6527V)购自美国Sigma公司;TBIL、DBIL、TBA、ALT、AST、γ-GT、ALP试剂盒均购自南京建成生物工程研究所;核蛋白与浆蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒均购自武汉阿斯本生物技术有限公司;实时荧光定量PCR试剂盒购自日本TaKaRa公司;钙敏感受体抗体购自英国Abcam公司。
1.3 仪器 PUS-2018N半自动生化仪购自北京普朗新技术有限公司;DYY-6C电泳仪、DYCZ-400D转移电泳仪均购自北京六一仪器厂;Mx3000荧光定量PCR仪购自美国Agilent公司。
2 方法
2.1 药物配制 地塞米松用蒸馏水配制成0.45 mg/mL溶液,熊去氧胆酸用蒸馏水配制成6 mg/mL混悬液,大黄素用羧甲基纤维素钠配制成4 mg/mL混悬液。
2.2 模型建立及给药 大鼠适应性喂养3 d后随机分为5组,每组6只(雌雄各半),分别为正常组、模型组、地塞米松组、熊去氧胆酸组、大黄素组。正常组和模型组灌胃给予生理盐水,地塞米松组灌胃给予地塞米松1.8 mg/kg[5],熊去氧胆酸组灌胃给予熊去氧胆酸60 mg/kg[5],大黄素组给予灌胃大黄素40 mg/kg[7],连续4 d。第5天,除正常组外,其他各组灌胃给予0.5%α-异硫氰酸萘酯(50 mg/kg)花生油溶液建立肝内胆汁淤积模型,灌胃前12 h所有动物均禁食。造模后各给药组继续灌胃给予相应药物,模型组灌胃给予等量生理盐水。
2.3 标本采集 α-异硫氰酸萘酯造模48 h后,大鼠腹腔注射1%戊巴比妥50 mg/kg进行麻醉(麻醉前禁食12 h),摘右眼球采血2 mL,3 000 r/min离心30 min,分离得到血清,-20 ℃保存备用。采抽血后取右叶肝组织,生理盐水冲洗,放入液氮中保存待检测;取肝右叶同一部位肝组织,放入4%多聚甲醛中固定48 h,二甲苯脱水,常规石蜡切片,HE染色观察组织病理变化。
2.4 血清肝功能水平检测 按照试剂盒说明书检测血清总胆红素(TBIL)、直接胆红素(DBIL)、胆汁酸(TBA)、丙氨酸转氨酶(ALT)、天冬氨酸氨基转移酶(AST)、谷氨酰转肽酶(γ-GT)、碱性磷酸酶(ALP)水平。
2.5 RT-qPCR法检测肝组织CaSRmRNA表达 取各组大鼠肝脏右叶组织,根据试剂盒说明书提取组织总RNA,测定浓度后分别取2 μg总RNA逆转录成cDNA,CaSR正向引物序列5′-GTATAACTTCCGTGGATTCCG-3′,反向引物序列5′-CAGTTGCAGAACTCGTCCAGG-3′。反应条件为95 ℃预变性1 min;95 ℃ 15 s,58 ℃ 20 s,72 ℃ 45 s,共40次循环。熔解曲线反应条件为60 ℃升温至95 ℃,每20 s升温1 ℃。采用2-ΔΔCT法计算CaSRmRNA相对表达。
2.6 Western blot法检测肝组织CaSR蛋白表达 取各组大鼠肝脏右叶组织,加入含有完整蛋白酶抑制剂的RIPA裂解液进行裂解,4 ℃、12 000 r/min离心5 min,取上清即得总蛋白,用BCA蛋白检测试剂盒进行定量,加入蛋白上样缓冲液于热水浴变性后保存备用。各组取等量蛋白上样,10% SDS-PAGE凝胶电泳,再转移到PVDF膜上,5%脱脂奶粉封闭膜1 h,加入CaSR(1∶500)、GAPDH(1∶10 000)一抗和相应的辣根过氧化物酶(HRP)结合的二抗,连续孵育1 h,加入增强型化学发光(ECL)试剂,采用凝胶成像系统曝光显影,由AlphaEaseFC软件处理系统分析比较CaSR蛋白与内参蛋白(GAPDH)条带的光密度值。
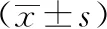
3 结果
3.1 大黄素对急性淤胆型肝炎大鼠血清肝功能水平的影响 与正常组比较,模型组大鼠血清TBIL、DBIL、TBA、ALT、AST、γ-GT、ALP水平升高(P<0.01) ;与模型组比较,各给药组大鼠血清TBIL、TBA、ALT、γ-GT、ALP水平降低(P<0.05,P<0.01),熊去氧胆酸组和大黄素组AST水平降低(P<0.05,P<0.01),大黄素组DBIL水平降低(P<0.01);与地塞米松组、熊去氧胆酸组比较,大黄素组TBIL、DBIL、TBA、ALT、AST、γ-GT、ALP水平降低(P<0.05,P<0.01),见表1。

表1 各组大鼠血清肝功能水平比较
3.2 大黄素对急性淤胆型肝炎大鼠肝组织病理形态的影响 正常组大鼠肝小叶结构完整,肝细胞核圆,呈放射状排列;模型组大鼠肝组织汇管区小胆管增生,炎性细胞浸润,部分肝细胞脂肪变性;地塞米松组大鼠肝组织汇管区小胆管增生,较多炎性细胞浸润;熊去氧胆酸组大鼠肝组织汇管区小胆管增生,少许炎性细胞浸润;大黄素组大鼠肝组织汇管区见少许炎性细胞浸润。造模干预后,模型组肝脏可见明显病理改变;地塞米松组病理改变较模型组加重;熊去氧胆酸组及大黄素组病理改变较模型组减轻;大黄素组病理改变轻于熊去氧胆酸组,见图1。

注:箭头指示炎性细胞浸润。
3.3 大黄素对急性淤胆型肝炎大鼠肝组织CaSRmRNA表达的影响 与正常组比较,模型组大鼠CaSRmRNA表达升高(P<0.01);与模型组比较,各给药组CaSRmRNA表达降低(P<0.01);与地塞米松组、熊去氧胆酸组比较,大黄素组CaSRmRNA表达降低(P<0.01),见表2。

表2 各组大鼠肝组织CaSR mRNA表达比较
3.4 大黄素对急性淤胆型肝炎大鼠肝组织CaSR蛋白表达的影响 与正常组比较,模型组大鼠CaSR蛋白表达升高(P<0.01);与模型组比较,各给药组CaSR蛋白表达降低(P<0.01);与地塞米松组比较,大黄素组CaSR蛋白表达降低(P<0.01);与熊去氧胆酸组比较,大黄素组CaSR蛋白表达降低(P<0.01),见图2、表3。

注:A为正常组,B为模型组,C为大黄素组,D为熊去氧胆酸组,E为地塞米松组。

表3 各组大鼠肝组织CaSR蛋白表达比较
4 讨论
婴儿胆汁淤积性肝病病因复杂,预后存在显著差异,在早期很难进行及时、准确的诊断并采取适当的干预措施[8]。目前婴儿胆汁淤积性肝病的主要治疗药物包括熊去氧胆酸和糖皮质激素[9],但是熊去氧胆酸的疗效不能令人满意,且由于适应症有限,在婴幼儿临床应用范围狭窄[10];而糖皮质激素因具有免疫抑制作用,使用前需充分权衡治疗收益和可能的不良反应[11],因此需要进一步探索有效治疗胆汁淤积的药物。α-异硫氰酸萘酯诱导大鼠能模拟人类肝内胆汁淤积,是目前国内外公认的肝内胆汁淤积模型[12-13],所以本研究采用此模型进行实验。大黄素是一种经基葱酮衍生物,具有肝脏保护作用及抗炎、抗病毒、抗氧化等药理作用[14], 能够缓解α-异硫氰酸萘酯诱导急性胆汁淤积模型大鼠的生化指标并减轻肝组织病理损伤[5]。Xiong等[7]发现不同剂量大黄素对α-异硫氰酸萘酯诱导幼龄大鼠的肝内胆汁淤积的保护效果不同,其中40 mg/(kg·d)剂量组效果最好,因此本研究采用此剂量大黄素进行实验。熊去氧胆酸参考药品说明书折算为大鼠剂量,地塞米松参考第8版传染病学淤胆型肝炎治疗剂量折算为大鼠剂量[5]。
G蛋白偶联受体是一大类膜蛋白受体的统称,CaSR为其C家族中的一员[15]。CaSR基因位于3号染色体长臂上[16],CaSR蛋白主要由2个启动子和7个外显子基因编码而成,其主要生物学功能是调节人体内钙离子稳态[17]。CaSR能与第二信使Ca2+偶联经G蛋白途径激活磷脂酶C、A2、D,通过细胞内的信号转导影响细胞生理功能;其次,CaSR能够激活多条信号通路,如核因子κB(NF-κB)通路[18]、丝裂原活化蛋白激酶(MAPK)通路[16]、Janus蛋白酪氨酸激酶/转录激活因子(JAK/STAT)通路[19],从而使得免疫细胞活化,淋巴细胞发育、分化及凋亡,介导炎症反应,促进细胞因子生成。CaSR在人体分布广泛,神经系统、心血管系统、胃肠道、肝、乳腺、肾脏及骨组织等均有表达[20]。2001年Canaff等[21]首次发现大鼠肝脏组织和原代肝细胞中有CaSR的表达,其呈剂量依赖性地调节胆汁流量。课题组前期研究也证实,大鼠肝脏组织和原代肝细胞中有CaSR的表达,通过调节线粒体通路和MAPK途径可以下调CaSR表达,从而抑制肝细胞凋亡,达到改善胆汁淤积的目的[6]。本研究发现,α-异硫氰酸萘酯诱导的急性胆汁淤积大鼠血清TBIL、DBIL、TBA、ALT、AST、γ-GT、ALP水平升高,可见病理损伤,同时CaSR mRNA及蛋白表达升高;大黄素组大鼠血清TBIL、DBIL、TBA、ALT、AST、γ-GT、ALP水平降低,病理损伤明显缓解,同时CaSR mRNA及蛋白表达降低,且大黄素组在改善上述指标方面优于地塞米松组和熊去氧胆酸组。提示,大黄素可以通过抑制CaSR表达,从而改善肝内胆汁淤积,其作用优于地塞米松及熊去氧胆酸。
综上所述,本研究证实了大黄素对淤胆型肝炎的治疗作用,其作用机制可能与抑制CaSR表达有关,大黄素针对胆汁淤积的CaSR受体相关通路将是本课题组未来研究的重点。

