雷公藤红素遗传毒性研究
黄 鹤, 张 莉, 涂如霞, 吴思澜, 李恒华
(重庆市中药研究院,重庆市药物安全评价中心,重庆 400065)
雷公藤红素,又名南蛇藤素,是一种醌甲基三萜,主要存在于卫矛科雷公藤属及南蛇藤属植物中,是一个具有多种生物活性的天然产物[1-2]。雷公藤红素具有显著的抗炎、免疫抑制、抗肿瘤、抑制血管生成、诱导细胞凋亡、神经保护等作用[3-8],具有较大的研究和开发价值。但雷公藤红素的毒性也不容忽视,有研究表明其对斑马鱼胚胎具有心脏毒性[9],对胆管细胞具有毒性[10],对造血系统也有一定的损伤[11],其毒性机制不甚清楚,尚未见相关文献报道雷公藤红素是否具有致基因突变和染色体畸变的遗传毒性。因此,本研究根据药物遗传毒性研究技术指导原则规定,通过鼠伤寒沙门氏菌回复突变试验(Ames试验)、体外培养中国仓鼠肺(CHL)细胞染色体畸变实验和小鼠骨髓嗜多染红细胞微核实验进行检测,为雷公藤红素研究开发提供理论依据。
1 材料
1.1 菌株 组氨酸缺陷型鼠伤寒沙门菌TA97a、TA98、TA100、TA102、TA1535,购自美国Moltox公司,实验前进行菌株鉴定,均符合规定标准。
1.2 细胞 中国仓鼠肺(CHL)细胞,购自中国科学院上海生命科学研究院,实验前检测无支原体污染。
1.3 动物 选用性成熟雄性昆明小鼠60只,7~8周龄,SPF级,体质量30~40 g,由重庆市中药研究院实验动物研究所提供,实验动物生产许可证号SCXK(渝)2017-0003。实验在本单位药物安全性评价中心屏障环境动物实验设施进行,并经本单位实验动物福利伦理委员会审核批准。
1.4 试剂与药物 雷公藤红素(北京融诚鑫德科技发展有限公司,批号L-003-170611)。环磷酰胺、ICR191、2-硝基芴(美国Sigma公司,批号WXBC7023V、SLBV4070、S43858V);丝裂霉素(美国Apexbio公司,批号A4452);叠氮钠(成都麦卡希化工有限公司,批号150309002);2-氨基芴、D-生物素、L-组氨酸盐酸盐一水物(上海阿拉丁生化科技股份有限公司,批号J1311022、D1524076、H1518057);1,8-二羟基蒽醌[西格玛奥德里奇(上海)贸易有限公司,批号WXBB0392V];二甲基亚砜(DMSO)、秋水仙碱(北京鼎国昌盛生物技术有限责任公司,批号93D00104、77010150);α-MEM(美国HyClone公司,批号SH30 265.01);0.25%Trypsln-EDTA、青霉素链霉素混合液(美国Genview公司,批号811120101100、811200101100);0.4%台盼兰染液、NADP-Na2(北京索莱宝科技有限公司,批号20181127、410F024);胎牛血清[赛尔博克斯生物制品(香港)贸易发展有限公司,批号P252018];肝微粒体酶(S9)(美国Moltox公司,批号3533);底层培养基、顶层培养基、营养肉汤、营养琼脂(青岛日水生物技术有限公司,批号20180816、20180816、20180426、20180724);葡萄糖-6-磷酸二钠(山东西亚化学股份有限公司,批号F09443)。体外细菌试验中雷公藤红素用DMSO配制,阳性药用DMSO或灭菌水配制或稀释,溶剂对照为同体积DMSO;细胞实验中雷公藤红素用DMSO溶解,再加细胞培养液稀释,阳性药均用灭菌水配制,溶剂对照为含等浓度DMSO的细胞培养液;小鼠实验中雷公藤红素用0.5%羧甲基纤维素钠(CMC-Na)溶液配制,阳性药用0.9%氯化钠溶液配制,溶剂对照为等体积0.5%CMC-Na溶液。
1.5 仪器 1384A2生物安全柜、IGS180生化培养箱、4111CO2培养箱、ST16R高速冷冻离心机(美国Thermo Fisher Scientific公司);Scan 300菌落计数仪(法国Interscience公司);GR85DA立式高温高压灭菌器[致微(厦门)仪器有限公司];HWS-26电热恒温水浴锅(上海一恒科学仪器有限公司);细胞用超纯水机(重庆市安特生环保设备有限公司);SW-CJ-2FD双人单面垂直净化工作台(苏州安泰空气技术有限公司);IX71倒置荧光显微镜、CX31光学显微镜(日本Olympus公司)。
2 方法
按照2018年《药物遗传毒性研究技术指导原则》设计要求,分别应用鼠伤寒沙门氏菌回复突变试验、体外培养CHL细胞染色体畸变实验和小鼠骨髓微核实验检测雷公藤红素的遗传毒性[12]。
2.1 Ames试验 选用5株鼠伤寒沙门氏菌突变型菌株(TA97a、TA98、TA100、 TAl02和TAl535),试验前对菌株进行遗传特性鉴定,均符合要求。根据前期剂量筛选实验结果,本试验选择雷公藤红素的剂量为2 000、400、80、16、3.2 μg/mL,另设阴性对照组、溶媒对照组(DMSO)和阳性对照组。阳性对照组不加S9时,TA97a加入1 μg/皿的ICR191,TA98加入5 μg/皿的2-硝基芴,TA100和TA1535加入1.5 μg/皿的叠氮钠,TA102加入0.5 μg/皿的丝裂霉素;加S9时,TA97a、TA98、TA100加入10 μg/皿的2-氨基芴,TA102加入50 μg/皿的1,8-二羟基蒽醌,TA1535加入200 μg/皿的环磷酰胺,每皿给药体积为0.1 mL,设3个平行皿,37 ℃培养48 h,计数每皿的回复突变菌落数。至少在一个菌株上,在有或无代谢活化系的情况下,供试品多诱发的回复突变菌落数出现质量剂量依赖性的增加和/或在一个或多个质量浓度组上出现可重复性的增加(回复突变菌落数均数比相应菌株的阴性对照菌落均数增加1倍以上),可判定为阳性结果。
2.2 染色体畸变实验 根据细胞毒性预实验结果,本实验在无或有S9代谢活化系统,暴露4 h条件下,雷公藤红素剂量为300、150、75、37.5 μg/mL;在无S9代谢活化系统,暴露24 h条件下,雷公藤红素剂量为180、90、45、22.5 μg/mL;同时另设阴性对照组(α-MEM培养液)、溶媒对照组(DMSO 10 μL/mL,以α-MEM培养液为溶媒)和阳性对照组(加S9时为1.25 mg/mL环磷酰胺,不加S9时为12.5 μg/mL丝裂霉素),给药体积均为0.1 mL,设2个平行培养瓶,在37 ℃、5% CO2培养箱中培养至24 h,终止培养前2 h,加入50 μg/mL秋水仙碱0.1 mL,使染色体停滞在分裂中期,培养结束后收集细胞,台盼蓝染色并计数细胞,并计算各剂量组相对群体倍增数(RPD),以反应细胞毒性情况。群体倍增数(PD)=[log(处理后的细胞数/处理前的细胞数)]/log2;RPD=(处理组的倍增数/对照组的倍增数)×100%;细胞抑制率=100%-RPD。剩余细胞悬液离心后弃上清液,保留细胞沉淀物,经低渗、固定、制片、Giemsa染色,油镜观察300个中期分裂相细胞,分别记录各组含有结构畸变染色体的细胞数和畸变类型,计算染色体畸变率。受试物所诱发的染色体畸变率呈剂量依赖性增加,或出现可重复性增加,可判定为阳性结果。
2.3 小鼠骨髓微核实验 用7~8周龄健康KM雄性小鼠60只,按体质量随机分为6组,每组10只,分别为溶媒对照组(0.5% CMC-Na),环磷酰胺组(40 mg/kg),雷公藤红素100、50、25、12.4 mg/kg组。雷公藤红素各剂量组及溶媒对照组每天灌胃给药1次,容量为0.2 mL/10 g,连续3 d;环磷酰胺组于第3天腹腔注射给药1次,给药体积为0.1 mL/10 g。末次给药后约24 h,进行股骨骨髓采样并制作涂片,甲醇固定,姬姆萨染色,油镜下观察。每只小鼠计数4 000个多染红细胞,并计算微核率;同时计数500个骨髓红细胞[多染红细胞(PCE)加正染红细胞(NCE)],求出多染红细胞/总红细胞的比值,即PCE/(PCE+NCE)。受试物所诱发的微核率呈剂量依赖性升高,或某一剂量组在某一测试点呈现可重复性升高,可判定为阳性结果。
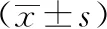
3 结果
3.1 Ames试验 各培养皿上背景菌苔生长良好,2次试验中各菌株自发回复突变菌落数(阴性对照组)均在正常范围内,阳性对照组回复突变菌落数均高于阴性对照组2倍以上(P<0.05,P<0.01),提示本试验体系可靠。在加或不加S9代谢活化系统条件下,雷公藤红素1 000 μg/皿剂量作用于各菌株均有红色沉淀产生,影响结果观察,不计入统计;雷公藤红素在个别剂量下表现出一定的细菌毒性(回复突变菌落数降低)(P<0.05,P<0.01)。在有或无代谢活化系统的情况下,雷公藤红素各剂量组回复突变菌落数均未见有可重复剂量相关性升高,个别剂量作用下某些菌株回复突变菌落数有一定增加,但未超过阴性对照组回复突变菌落数的2倍,且在以往Ames试验对照范围内,未见剂量相关性升高,故无毒理学意义。因此,0.32~200 μg/皿的雷公藤红素均未引起所有测试菌株基因突变,Ames试验结果为阴性。具体结果见表1~3。

表1 雷公藤红素对鼠伤寒沙门氏菌突变型菌株回复突变菌落数的影响(平行试验一)(个/皿,

表2 雷公藤红素对鼠伤寒沙门氏菌突变型菌株回复突变菌落数的影响(平行试验二)(个/皿,

表3 阳性对照药物及剂量
3.2 体外培养CHL细胞染色体畸变实验 高剂量雷公藤红素表现出明显的细胞毒性,见表4。在有或无S9代谢活化系统暴露4 h和无S9代谢活化系统暴露24 h,与阴性对照组比较,阳性对照组染色体畸变率均升高(P<0.01),表明试验系统可靠;溶媒对照组、雷公藤红素各剂量组染色体结构畸变率无明显变化(P>0.05),雷公藤红素个别剂量有统计学差异(P<0.05,P<0.01),但未见重复性剂量依赖性升高,故无毒理学意义。结果表明,雷公藤红素未引起CHL细胞染色体结构畸变率升高,染色体畸变试验结果为阴性,见表5。
3.3 小鼠骨髓微核实验 环磷酰胺组小鼠骨髓微核率高于溶媒对照组(P<0.01),显示本实验体系可靠。实验期间,小鼠出现腹泻症状,雷公藤红素剂量越高,腹泻动物数越多,同时随给药时间的延长,腹泻小鼠数也增多。雷公藤红素剂量为100、50、25 mg/kg时,腹泻次数分别为20、21、6次。与溶媒对照组比较,雷公藤红素100、50、25、12.4 mg/kg组小鼠体质量均降低(P<0.05,P<0.01),剂量越高,给药时间越长,体质量降低幅度越大,这与雷公藤红素引起的动物腹泻情况一致;雷公藤红素100、50、25 mg/kg组小鼠PCE/(PCE+NCE)值降低(P<0.01),提示雷公藤红素对骨髓有抑制作用;雷公藤红素各剂量组小鼠骨髓微核率无明显变化(P>0.05)。结果表明,各剂量雷公藤红素均未引起骨髓细胞染色体完整性损害或导致染色体分离异常,微核实验结果为阴性,见表6~8。
4 讨论
近年来,雷公藤红素的抗肿瘤作用使其成为研究热点之一。目前抗肿瘤药物大都具有明显的细胞毒性,并且很多都具有潜在的遗传毒性,可引起人体体细胞和生殖细胞不可逆转的遗传损伤[13-14]。雷公藤红素是否具有遗传毒性,目前尚未见研究报道,而遗传毒性研究是药物非临床安全性评价的重要内容,它与其他毒理学研究尤其是致癌性研究、生殖毒性研究有着密切的联系,是药物进入临床试验及上市的重要环节[15-18],因此,本研究采用目前公认检测受试物致突变的几种检测方法,分别从体外到体内,在微生物、离体细胞和整体动物水平上系统评价雷公藤红素的遗传毒性。

表4 各剂量雷公藤红素的细胞毒性

表5 雷公藤红素对CHL细胞染色体畸变的影响

表6 雷公藤红素对小鼠体质量的影响

表7 雷公藤红素对小鼠体质量增长的影响

表8 雷公藤红素对小鼠骨髓微核的影响
Ames试验是经典的检测基因突变的方法之一,主要通过检测组氨酸靶基因中的碱基置换或移码突变来评价受试物的致突变性,从基因水平反映了遗传物质受损伤状况[19]。本研究结果显示,在加或不加S9的条件下,3.2~200 μg/皿雷公藤红素均未引起细菌回复突变数有意义的增加,试验结果为阴性,提示雷公藤红素对鼠伤寒沙门氏菌无致突变性。染色体畸变实验通过制备细胞中期分裂相染色体标本,在光镜下直接观察染色体数目和形态的变化,以检测细胞染色体的损伤情况[20-21]。本研究表明,22.5~180 μg/mL(接触24 h,不加S9)以及37.5~300 μg/mL(接触4 h,加或不加S9)的雷公藤红素均未引起CHL细胞染色体畸变率有意义的升高,实验结果为阴性,提示雷公藤红素对哺乳动物培养细胞染色体无致畸变作用。小鼠微核实验是用于快速检测化学毒物损伤细胞染色体和干扰细胞有丝分裂的方法,微核的产生与染色体断裂及纺锤体受损有关,微核率大小可间接反映染色体受损情况,能检测受试物导致染色体完整性的改变和分离,改变两种遗传终点[21-22]。本研究发现,灌胃给予100、50、25、12.4 mg/kg雷公藤红素均未引起骨髓嗜多染红细胞微核率有意义的增高,实验结果为阴性,提示雷公藤红素无致小鼠股骨骨髓嗜多染红细胞微核形成作用,不会影响细胞染色体完整性及有丝分裂进程。
综上所述,本研究采用Ames试验、染色体畸变实验和体内微核实验这3个经典实验组合进行雷公藤红素的遗传毒性评价,结果提示,其不具有潜在的致基因突变和染色体畸变的遗传毒性,与很多抗肿瘤药物相比,显示出一定的优势,具有极大的开发潜力。本研究为雷公藤红素进一步开发利用提供了毒理学依据,但雷公藤红素作用靶点尚未完全阐明,其相关毒性以及具体机制有待更进一步深入研究。

