普通糖色制备过程中的化学反应及其形成机理
杨桢晶,马 浩*,乔艳辉,滕俊江,李 凝,蔡 滔
(1.广东石油化工学院 化学学院,广东茂名 525000;2.广东石油化工学院 化学工程学院,广东茂名 525000)
1 材料与方法
1.1 材料与设备
白砂糖购自当地超市(福建好日子食品有限公司生产)。
溴化钾(光谱纯)、二甲基亚砜(DMSO-d6,TMS 0.03%),由北京百灵威科技有限公司提供;去离子水,实验室自制。
傅里叶变换红外光谱仪(FT-IR,Nicolet 6700,美国赛默飞世尔科技公司);核磁共振波谱仪(NMR,Bruker Avance III 400M,德国布鲁克公司);气相色谱-质谱联用仪(GC-MS,GCMS-QP2010 SE,日本岛津公司)。
1.2 实验方法
1.2.1 糖色的熬制
糖色采用开口式常压法在烧杯中进行熬制,具体方法如下。
①称取50 g 白砂糖,置于250 mL 烧杯中,加入25 mL 蒸馏水进行混合。②通过电热套对烧杯进行加热,炒熬糖色,同时利用温度计跟踪反应体系温度。③反应体系温度上升至90 ℃时,白砂糖全部熔融;温度升至110 ℃时,反应液开始沸腾(冒气泡),大量水分挥发。④温度升至180 ℃时,在糖液由无色变为浅黄色时,用药匙取样,定义为1 号样;随后每间隔1 min,取样一次,依次为2 号样、3 号样等,直至糖液变成深黑色并伴有固体产生时,停止熬制。为方便对比,在步骤③原料全部熔融时取样,定义为0 号样。
1.2.2 糖色的表征
糖色在熬制过程中分子结构变化通过傅里叶变换红外光谱仪(Fourier Transform Infrared Spectrometer,FTIR)(KBr 压片法)以及核磁共振波谱(Nuclear Magnetic Resonance Spectroscopy,NMR)(DMSO-d6 为溶剂)进行追踪;糖色中挥发性物质则通过乙酸乙酯对样品中的挥发性物质进行萃取分离,然后利用气相色谱-质谱联用仪(Gas Chromatography-Mass Spectrometry,GCMS)进行定性分析(HP-5MS 毛细管柱30 m×0.25 mm×0.25 µm;进样量:1 μL;分流比:25∶1;高纯氦气为载气;进样口温度:250 ℃;柱始温:40 ℃,保持2 min,以20 ℃·min-1升温至250 ℃,保持1 min)。
2 结果与分析
2.1 糖色的色泽分析
糖色在制备过程中,随着炒熬时间的延长,色泽逐渐加深,表明在熬制糖色过程中原料分子结构发生变化(图1)。此外,在取样过程中发现,在1 号样取样后糖液继续熬制7 min 时,所制备的糖色(8 号样)中已有大量不溶的焦炭固体生成,不能用于糖色,说明糖色制备过程发生的化学反应速度较快,本文所采用的水炒糖色的方法熬制时间在1 号样(糖液由无色变为浅黄色)取完后不宜超过6 min。结合糖色的形成过程的颜色变化趋势,可将糖色的形成分为3 个阶段:①无色的始发阶段;②黄色的中间阶段;③深色阶段。
农村基层的问题,看似多是小事,其实不然,这一件件、一桩桩都是具体的事,涉及村民切身利益,都需要有关部门面对面、实打实地去解决。小小几个喇叭,反映出有关部门在基层工作中仍然存在形式主义、条块分割等问题,值得深思。

图1 糖色制备过程中的色泽变化
2.2 糖色的红外光谱分析
为了研究糖色在制备过程中的分子结构变化,本文先利用FT-IR 对各糖色样品进行分析,结果如图2所示。
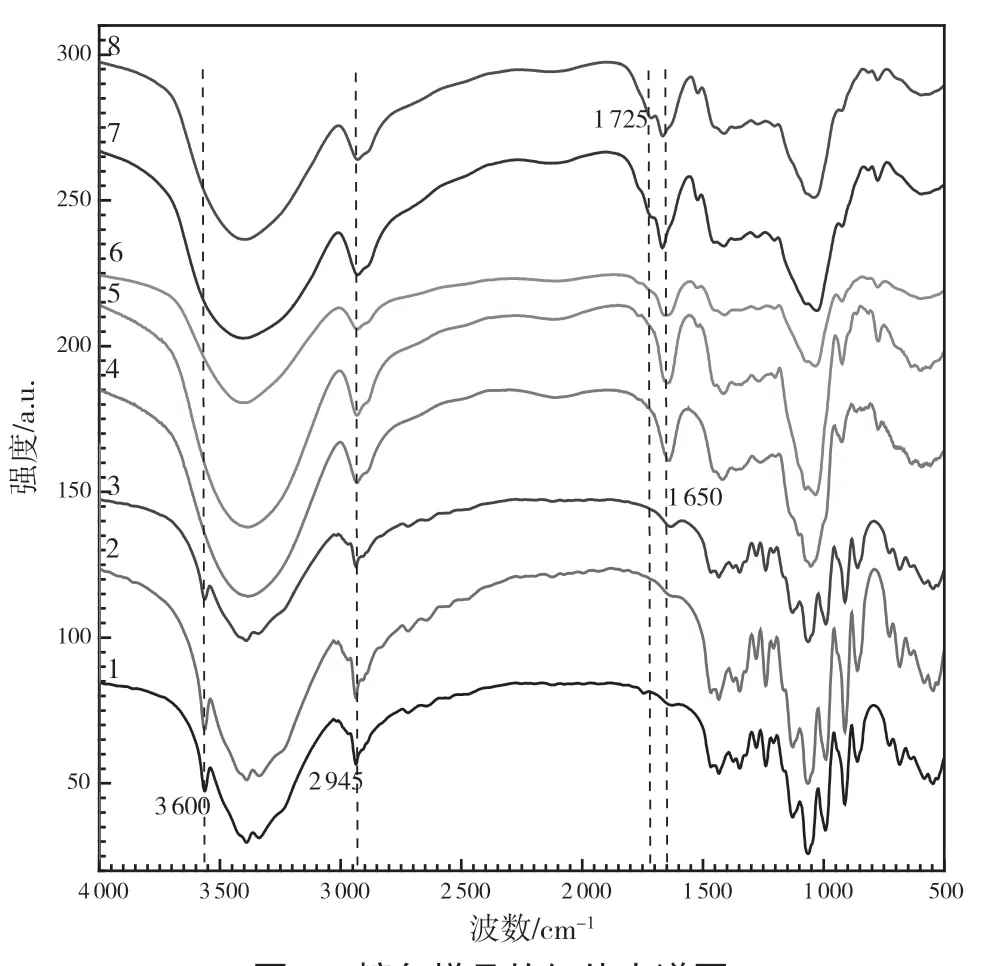
图2 糖色样品的红外光谱图
1 号样的红外光谱图中,3 600 cm-1处的尖峰和3 400~3 200 cm-1处的宽峰,分别对应于游离和缔合羟基(-OH)的伸缩振动吸收峰;3 000~2 800 cm-1和1 450~1 250 cm-1的多处吸收峰则来源于原料中亚甲基(=CH2)、次甲基(≡CH)的C-H 的伸缩振动和变角振动(弯曲和变形);1 200~1 000 cm-1处的吸收峰,为原料骨架中碳-氧键(C-O-C 和C-O-H)的伸缩振动吸收峰[4];860 cm-1和820 cm-1附近的吸收峰分别对应于β-呋喃糖苷键和α-吡喃糖的特征吸收峰[5]。1 号样所对应的红外光谱曲线与蔗糖的一致[4],说明样品在颜色发生改变前分子结构没发生明显变化,也间接说明糖色的颜色与其分子结构有直接的关联。
通过对比1~6 号样的红外光谱图发现,随着熬制时间的延长,样品中所对应的特征吸收峰发生明显变化,且在1 650 cm-1附近出现新的吸收峰,说明原料分子结构发生改变。1 650 cm-1的吸收峰为碳-碳双键(C=C)的特征吸收峰,结合原料(蔗糖)分子结构的特点,说明糖色在熬制过程中发生脱水反应[6]。当1 号样取样后糖液继续熬制6 min 后(7 号样和8 号样),1 725 cm-1处出现吸收峰,表明在该条件下熬制的糖色含有羰基(C=O)结构[7]。因此,通过FT-IR 的初步分析,发现普通糖色中含有-OH、C=C 和C=O 官能团,结合糖色的色泽变化趋势,糖色中可能含有上述官能团的共轭结构。
2.3 糖色的核磁共振氢谱分析
为了进一步研究糖色的结构特点,本文继续利用1H NMR 对糖色样品进行深入分析,结果如图3所示。
由图3可知,原料骨架上的质子(C-H 键,非活泼氢)的化学位移值主要集中在3.0~5.3 ppm,与蔗糖分子的化学位移一致。随着熬制时间的延长(3 号样和4 号样)在6.18 ppm 和6.56 ppm 处出现新的峰,为非共轭C=C 双键上质子的化学位移,进一步证明在糖色熬制过程中,有双键结构的生成[8]。结合原料分子的结构特点和熬制条件,C=C 双键来源于原料分子内的脱水反应,结果与红外光谱一致。然而,进一步延长熬制时间(5 号样~8 号样),非共轭双键上所对应质子的峰强度逐渐降低,且在7.48 ppm附近出现多重峰(共轭C=C 双键质子的化学位移),表明糖色在熬制过程中所形成的非共轭C=C 双键,在脱水过程中转化为共轭C=C 双键[9]。此外,在9.50~9.60 ppm 处出现的多峰表明在非共轭C=C 双键向共轭C=C 双键转化过程中,同样有醛基(-CHO)结构形成,且与醛基相连的分子骨架结构明显不同[10]。1H NMR 结果与FT-IR 基本一致。
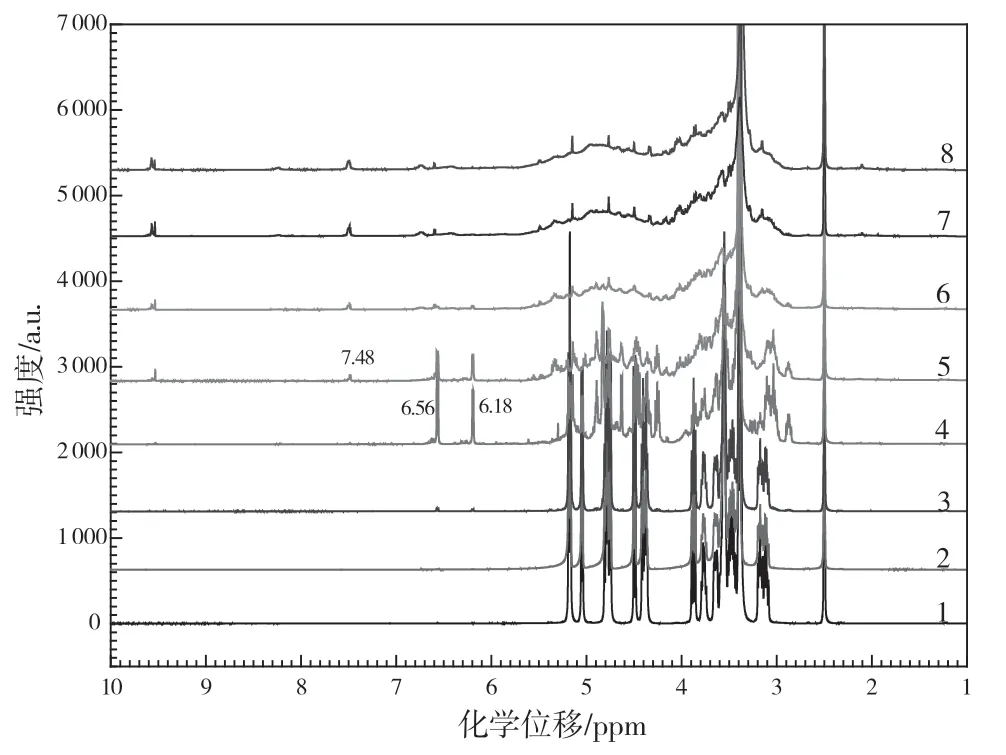
图3 糖色样品的核磁共振氢谱图
综上所示,结合糖色熬制过程中的颜色变化规律和FT-IR、1H NMR 表征结果,初步推断糖色为含有-OH、C=C 和-CHO 基本结构单元的化合物,且各官能团之间具有较强的共轭效应。
2.4 糖色中挥发性物质分析
为了深入研究糖色在熬制过程中原料分子可能经历的化学反应,本文利用GC-MS 技术对糖色熬制过程中4 号样和7 号样中小分子挥发性物质进行分析,结构如图4所示。
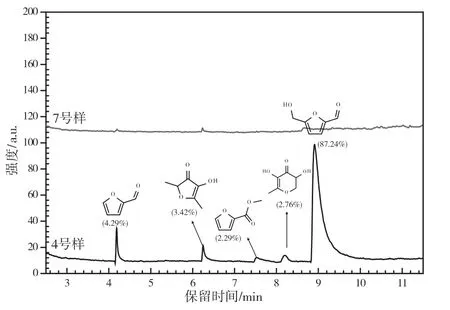
图4 糖色样品的GC-MS 谱图
从4 号样的GC-MS 结果中可以看出,糖色在熬制过程中有大量醛酮类挥发性小分子化合物生成,且该类小分子物质含有-OH、C=C 和-CHO 等官能团,主要来源于原料中蔗糖分子的分子内脱水反应[11]。然而,当熬制时间继续延长时(7 号样),糖色中挥发性小分子化合物的量急剧下降。结合糖色熬制过程中的颜色变化规律,表明熬制初始阶段生成的小分子化合物可能为糖色的中间体,会参与后续各中间体、原料分子间的脱水缩合反应,形成共轭程度更大、颜色更深的糖色[9]。此外,糖色中的共轭C=C 键结构可能来源于呋喃环结构单元。
2.5 糖色的形成机理分析
结合上述糖色熬制过程中的颜色变化规律和FTIR、1H NMR 以及GC-MS 的分析结果,本文对糖化制备过程中的形成机理进行推测,糖色的形成机理及分子结构如图5所示。

图5 糖色形成的可能反应机理
在糖色熬制过程中,反应体系温度逐渐升高,体系中水分大量挥发,同时原料中蔗糖分子发生水解形成吡喃糖和呋喃糖类中间体。随着熬制的进行,糖类中间体可能发生分子内脱水反应,形成糠醛、呋喃酮等挥发性醛酮小分子化合物,同时也可能发生分子间脱水反应形成二糖类中间体[12]。当熬制进行到一定程度后,反应体系中各类中间体浓度逐渐增加,各类中间体之间、原料与各类中间体之间都有可能发生分子间的脱水缩合反应,形成共轭效应更大、吸光能力更强的大分子物质[9,13]。普通糖色与碳水化合物催化转化过程中的副产物胡敏素含有相似的分子结构[14]。
结合糖色的分子结构,本文继续推测了糖色在肉类烹饪过程中的着色机理,如图6所示。肉类在高温烹饪过程中,蛋白质发生部分水解,水解部分则裸露出氨基(-NH2)。而氨基则可以与糖色中的醛基(-CHO)发生反应形成席夫碱结构[15],从而给肉类赋予稳定的糖色。
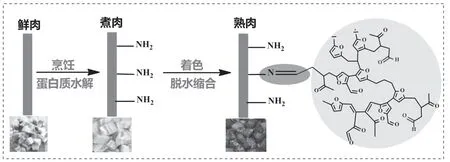
图6 卤肉过程中糖色着色机理示意图
3 结论
通过对糖色熬制过程分子结构变化进行追踪,初步证实糖色在制备过程中主要发生分子内和分子间的脱水缩合反应,形成含有-OH、共轭C=C(呋喃环)、-CHO 等基本结构单元的缩聚物,与碳水化合物转化过程中形成的胡敏素具有相似的分子结构。研究结果对认知糖色的形成过程具有极大的促进作用,可为中餐规范化和产业化奠定基础。

