13C-2H双同位素示踪法研究未漂硫酸盐浆中残余木质素的化学结构
路德胜 张 凯 陈旭东 谢益民
(湖北工业大学制浆造纸研究院,湖北武汉,430068)
制浆是造纸工业中的重要一环,其中硫酸盐法制浆是最常用的制浆工艺。硫酸盐法制浆过程可以去除木材中约97%的木质素[1],但在硫酸盐浆中仍然存在相当一部分残余木质素,主要是由于木质素间形成的缩合结构及与多糖类物质形成的木质素-碳水化合物复合体(LCC),严重阻碍了木材组分的选择性分离[2-4]。从纸浆中分离出残余木质素,能够更好地了解硫酸盐制浆的脱木质素原理及残留在纸浆中的木质素和LCC化学键连接的信息[1],对制浆过程中木质素的深度去除具有重要意义[5-6]。从纸浆中分离残余木质素一般不需要球磨,避免机械研磨造成木质素结构改变[7-8]。从纸浆中分离残余木质素有酸水解和酶水解2 种常用方法[9]。酸水解法是利用酸催化水解多糖组分,得到硫酸盐浆中残余木质素,但在一定程度上会改变木质素的化学结构[10];而酶水解法条件温和,与磨木木质素相比木质素得率较高,分离得到的残余物在一定程度上更能代表浆中的残余木质素,而且由酶水解得到的木质素仍然存在5%~10%的木质素与碳水化合物相连[9-10],可以了解浆中残余木质素和LCC的结构信息。Terashima和Xie 等人研究发现[11-13],通过向植物体投入带有13C和2H同位素标记的前驱物,可以选择性实现特定的木质素结构及糖类信号的富集,结合核磁共振技术可以得出木质素及LCC连接键的结合位点,进而能够有效地断裂木质素及LCC的连接,达到去除木质素的目的。
本研究首先向银杏植株中投入带13C 和2H 标记的前驱物,使之在植物体内正常转化为带13C 标记的木质素和带2H 标记的碳水化合物,然后通过硫酸盐法蒸煮除去大量木质素,对得到的硫酸盐浆进行酶处理,获得酶解木质素,结合固态、液态核磁共振波谱对硫酸盐法蒸煮前后银杏木质部的木质素及LCC 进行分析,探讨蒸煮前后化学键的结构变化,有望为制浆过程中木质素的高效脱除提供理论依据。
1 实验
1.1 实验试剂及原料
实验所用原料为6 年生银杏植株,产地为湖北省。松伯醇葡萄糖苷-[α-13C]参考Xie 等人[12]的方法自主合成;D-葡萄糖-[6-2H2]购自Sigma 公司;羧甲氧基胺半盐酸盐(AOA)购自麦克林试剂公司;纤维素酶“Onozuka”RS 购自日本Yakult 株式会社;半纤维素酶(来源于黑曲霉)购自Sigma 公司;其他所需试剂均为分析纯,购自国药试剂有限公司。
1.2 银杏植物体内前驱物的投入
在6 月4 日选取未完全木质化的银杏植株,在其顶部主干部位进行截取,获得直径15~25 mm、高度30 cm,并带有20~25 片叶子的银杏枝条。将每根植株浸泡在200 mL 配置好的溶液中,该溶液含有松伯醇葡萄糖苷-[α-13C]300 mg,D-葡萄糖-[6-2H2]200 mg,羧甲氧基胺半盐酸盐8 mg。每根植株每天约吸收50 mL 溶液,4 天后每天注入50 mL 的去离子水,使得上述化学药品在一周内吸收完毕。后期补加去离子水,在人工气候培养箱中继续培养3 周,保持温度25 ℃,相对湿度50%。
1.3 银杏木粉的硫酸盐法蒸煮
将银杏植株在人工气候箱中培养1 个月,剥去外皮,从形成层向髓心方向切取新生木质部约1 mm,风干后,用Wiley 粉碎机磨至40~60 目粉末。取银杏木粉50 g(以绝干计),按照硫化度25%、用碱量30%(以Na2O 计)、固液比1∶10 的条件,在高温反应釜中蒸煮,温度175 ℃,升温1 h,保温3 h,所得纸浆得率为50%,卡伯值为43。
1.4 未漂硫酸盐浆中残余木质素的分离
采用酶解法提取纸浆中的残余木质素,先将上述同位素标记的硫酸盐浆用PFI 磨浆机进行打浆处理,最终测得加拿大游离度为270 mL 的纸浆。称取1 g 纤维素酶和1 g半纤维素酶加入到400 mL乙酸/乙酸钠缓冲溶液(pH 值=4.5)中进行溶解,通过G4 砂芯漏斗过滤,滤液低温保存。称取未漂硫酸盐浆24 g,均分到4个碘量瓶中,每个碘量瓶加入酶溶液100 mL,再加150 mL 缓冲溶液,然后在45 ℃下振荡48 h,每次酶解后将2 个碘量瓶内的样品合并,共酶解4 次,最后离心分离残余物与溶液,残余物用稀HCl(pH 值=2)充分洗涤,冷冻干燥。参考Lin等人[14]的方法进一步分离,将酶解后的残余物1 用NaOH 进行抽提,用稀HCl(与水的体积比为1∶2)沉淀,再用稀HCl(pH值=2)充分洗涤,透析后分离得到碱溶性残余酶解木质素(CEL-Alk),实验流程如图1所示。

图1 未漂硫酸盐浆的制备及残余木质素的分离Fig.1 Preparation of unbleached kraft pulp and isolation of residual lignin
1.5 检测方法
1.5.113C和2H丰度的测定
将培养完成后的银杏木粉进行苯-醇(2/1,v/v)和热水抽提,然后通过元素分析仪(FLASH 2000型)和同位素质谱仪(Delta V 型)联用测定13C 和2H 的丰度值。通过式(2)计算13Cα/12Cα的值,式(4)计算D6/H6的值。

式(1)和式(2)中13C/12C 为样品中13C 与12C 丰度的比值;δ13C 为样品的C 同位素值(δ13C(VPDB),‰);1.11802%为标准品的13C 同位素丰度;13Cα/12Cα为样品中木质素结构单元上Cα的13C 与12C 的同位素比值;1.0766%为不带同位素标记的银杏植物体内的13C 同位素丰度;0.3102为银杏植物体内木质素的含量;10为木质素(愈创木基单元)结构中总C原子的个数与Cα位13C个数的比值。

式(3)和式(4)中D/H为样品中D丰度与H丰度的比值;δD 为样品中H 同位素值(δD(VSMOW),‰);0.015575%为标准品中D 的同位素丰度;D6/H6 为样品中纤维素6 号位的D 与H 的同位素比值;0.013505%为银杏植物体内D 的同位素丰度;0.45 为银杏中纤维素的含量;5 为纤维素(葡萄糖单元)中总H的个数与6号位H的个数比值。
1.5.2 高分辨率CP/MAS13C NMR检测
在Bruker Avance Ⅲ型600 MHz 光谱仪上,使用交叉极化(CP)和魔角自旋(MAS)对培养后的银杏植株粉末(200 目)进行固态13C NMR 光谱测定,温度300 K,接触时间3 ms,脉冲迟滞2 s,每个样品累积扫描4000次。
1.5.3 CEL-Alk的13C和1H NMR检测
硫酸盐浆中残余木质素溶解在DMSO-d6中(c=130 mg/mL,用于1H 和13C NMR 实验),在300 K 条件下,在Bruker Avance Ⅲ型600 MHz光谱仪上测定其核磁共振光谱,13C NMR 测定脉冲延迟2.5 s,采集时间0.95 s,累积扫描10000 次;1H NMR 测定循环延迟4.2 s,采集时间0.72 s,累积扫描400次。化学位移参考溶剂信号δ(1H)=2.5,δ(13C)=39.5。
2 结果与讨论
2.1 双同位素标记的银杏新生木质部的13C/2H 丰度分析
13C 和2H 的同位素丰度如表1所示,经13C/2H 标记后的银杏木质部同位素比值都有较明显的提高,其中13Cα/12Cα值为未标记物的3.2 倍,D6/H6 值比未标记高13倍,表明人工投入的13C和2H 标记的前驱物在植物体内成功得到了转化,未影响植物的正常生长,为后续实验奠定了基础。

表1 银杏木粉的13C/2H丰度Table 1 13C/2H abundance of ginkgo wood mill
2.213C/2H 双同位素标记的银杏木粉的固态CP/MAS13C NMR分析
高分辨率CP/MAS13C NMR 核磁共振谱可以对难溶性大分子物质进行全组分无损分析,对结构研究具有一定的参考价值[15-17]。但是在核磁共振测定过程中,固体分子之间不能自由运动,自旋耦合较强,导致吸收峰较宽,掩盖了一些信号。由13Cα标记物与未标记物得到Cα增强信号的差示谱图(图2,以δ=55.8 处甲氧基的吸收峰为基准),能够从很大程度上弥补CP/MAS13C NMR 谱的不足,同时也证实了松伯醇葡萄糖苷-[α-13C]在银杏植物体内的成功转化。在差示谱图中,尽管δ在50~110范围内不可避免地会有残余的多糖信号,但在低场区域(δ>160)和高场区域(δ<50)均未发现明显的吸收峰,基线较为平坦,认为残留的多糖信号对此贡献很少。由图2可以明显看到有关Cα的增强信号,在δ=134.0 处(No.3)显示的是松伯醇结构中—Cα==C—的信号[18]。δ=105.6 处(No.4)是木质素结构单元与多糖类物质以缩醛键连接的Cα信号[19],原本裸子植物的木质部中存在一定量的缩醛键LCC 结构。化学位移δ=90.1 处(No.5)Cα的信号归属于G 型木质素单元间苯基香豆满结构[20]。δ=84.2(No.6)信号是与多糖类物质以苯甲醚键连接的木质素结构中的Cα[21]。δ=75.5(No.7)处的增强信号可能来自与苯甲酯键型LCC 结构以及β—1 缩合型结构的Cα信号。δ=72.9(No.8)处的增强信号最为明显,表明原木质素单元间存在大量的β—O—4结构,证实了β—O—4结构是木质素单元间主要的连接结构,这与前人的研究结果一致[19]。δ=63.0(No.10)处的增强信号表明天然银杏植株中存在β—1 型木质素单元间结构[22]。

图2 银杏木粉的CP/MAS13C NMR谱图及其差示谱图Fig.2 CP/MAS13C NMR and difference spectra of ginkgo wood mill
2.3 CEL-Alk的13C NMR分析
使用纤维素酶和半纤维素酶对硫酸盐法蒸煮后的浆料进行酶解处理,降解掉大部分多糖组分,减少糖组分在核磁共振测试中的信号。对硫酸盐法蒸煮后CEL-Alk中碱溶木质素部分进行了13C NMR 光谱表征,根据参考文献[19],将δ=55.8处甲氧基的信号峰作为基准峰,对比结果如图3所示。具体的13C化学位移归属见表3,主要的木质素和LCC连接结构如图5所示。

表3 CEL-Alk的13C NMR化学位移及信号归属Table 3 13C NMR chemical shifts and signal assignments of CEL-Alk

图3 银杏CEL-Alk的13C NMR谱图Fig.3 13C NMR spectra of ginkgo biloba CEL-Alk
通过图3发现,在化学位移δ=147.4(No.7)处显示的是愈创木基C4[23]以及肉桂酸中的Cα吸收峰[24],α-13C标记产物在此处有较明显的增强,表明木质素在硫酸盐法蒸煮过程中部分碎解,产生了较多的肉桂酸结构。在化学位移δ=129.8(No.8)处的振动信号是由愈创木基C1[24],松伯醇中的Cα和Cβ[13],以及少量对-香豆醇中的C2 和C6 引起的[12],α-13C 标记后有明显的增强,表明在硫酸盐法蒸煮过程中与木质素结构单元α位碳原子连接的醚键、酯键发生了断裂,形成了较多的—Cα==Cβ—,13C标记的产物的Cα信号的增强较为明显。化学位移δ=102.1(No.13)处是与糖单元有缩醛键连接的Cα,聚木糖、甘露糖以及苯基糖苷上的C1 产生的吸收峰[25-26],α-13C 标记的残余CEL-Alk 在此处信号有明显增强,表明硫酸盐浆残余木质素中有一小部分是木质素Cα与多糖以缩醛键连接的,而连接的糖的类型很有可能是聚木糖[19],说明具有缩醛键的LCC结构在硫酸盐法制浆过程中比较稳定。在δ=97.1(No.14)处显示的是苯基糖苷区域[27],一般是木质素的酚羟基与多糖还原端羟基形成苯基糖苷键[5,8],而葡甘聚糖在碱性高温条件下容易降解,聚木糖则相当稳定[28],认为此共振信号是木质素与聚木糖连接形成的糖苷键。化学位移δ=80.6(No.15)处的增强信号为木质素单元Cα与碳水化合物形成的苯甲醚键结构[29-30],而硫酸盐法蒸煮后纸浆中碳水化合物主要是甘露糖和木糖[31],所以此位置可能是木质素Cα与甘露糖C6位的连接,也可能是木质素Cα与聚木糖C2或C3位的连接[32]。
化学位移δ=75.8(No.16)处,在未标记的CELAlk核磁谱图上未发现明显的信号峰,而在α-13C标记物中能看到明显的增强信号,这就排除了木糖、甘露糖和葡萄糖对此信号的贡献,确定是来自木质素单元β—O—4(苏型)结构中Cα信号[26],表明非酚型β—O—4 型木质素在碱法制浆中具有一定的稳定性,在硫酸盐法蒸煮后仍然有部分存在。δ=72.5(No.17)处的共振信号是由β—O—4(赤型)结构中的Cα[23-25],甘露糖和β-葡萄糖上的C2、C3,以及聚木糖上的C2,β—β结构中的Cγ也会在此处产生共振信号[33],但在未标记样品的谱图上没有发现信号峰,证明是由蒸煮后残余的非酚型β—O—4 结构中的Cα共振引起的。在δ=67.3(No.18)处的信号峰是由Ar—CHOH—CH3结构中的Cα引起的[25],表明在硫酸盐法蒸煮后,CEL-Alk残留着部分带α—OH的芳基片段,Cγ位产生甲基,而蒸煮及酶解过程会不同程度地破坏糖类结构,导致α,β-甘露糖C4,β-木糖C5 在此处的信号消失。在化学位移δ=63.16(No.20)处,带α-13C标记的CEL-Alk 与未标记的CEL-Alk 相比,信号峰有较为明显的提高,表明此信号是由硫酸盐法蒸煮过程中β—1缩合型结构Cα产生的[26,34],说明β—1缩合型结构在硫酸盐法制浆过程中比较稳定。在δ=25~50之间存在大量的甲基和亚甲基的碳信号,这是由于在硫酸盐法制浆过程中酚型及非酚型的α-醚键、β-醚键的断裂,导致木质素结构单元产生大量的甲基和亚甲基结构。
2.4 CEL-Alk的1H NMR分析
1H NMR 的共振信号较宽且重叠,测出的谱图较粗钝[35],六碳糖的C6 位经过2H 同位素标记后,相关的信号会减弱,采用差示谱图进行处理,可以使减弱的信号显露出来[21]。经酶处理后浆料中没有LCC 连接键的大量多糖类物质被水解掉,通过差示谱图可以更加清晰地看到木质素与多糖之间的连接,以芳香质子为基准,2H 标记的CEL-Alk 和未标记的CEL-Alk 的差示谱图如图4所示。

图4 银杏CEL-Alk的1H NMR差示谱图(未标记的谱图减去2H标记的谱图)Fig.4 1H NMR difference spectra of ginkgo CEL-Alk(unlabeled spectra minus2H labeled spectra)
由图4 可知,除了乙酰基中甲基的共振信号外,几乎所有的共振信号都出现在δ在3.0~5.5之间。化学位移δ在4.78~4.70(No.2)和δ在4.68~4.53(No.3)处显示的是葡萄糖单元C6 上的D 信号[21],为木质素单元Cα位与葡萄糖单元上伯羟基形成的苯甲醚键结构,在No.3 处可能还存在甘露糖C6 上的D 信号,显示为木质素Cα与葡萄糖或甘露糖C6 的苯甲醚键连接[36-37],说明硫酸盐浆中残留的木质素-多糖复合体苯甲醚键结构较稳定,这与Taneda等人[38]的研究结果基本一致。化学位移δ在3.82~3.72(No.4)吸收区域中有葡萄糖单元C6 上D 的贡献,可能是纤维素(未取代)6-D 和6-D’的共振信号[21],说明酶降解后的残余木质素中还含有少量的纤维素组分。由CEL-Alk的1H NMR 差示谱图可以得出,硫酸盐浆中木质素与多糖之间存在苯甲醚键连接。详细的1H NMR 信号归属如表4所示,残余的木质素及LCC结构见图5。

表4 CEL-Alk的1H NMR差示谱图的化学位移及信号归属Table 4 Chemical shifts and signal assignments of1H NMR difference spectra of CEL-Alk
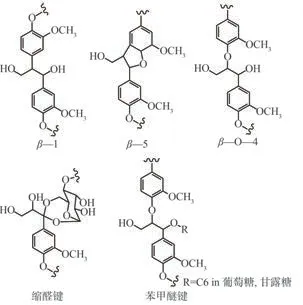
图5 银杏材硫酸盐法制浆后残余木质素及LCC结构Fig.5 Residual lignin and LCC structure of ginkgo wood after kraft pulping
3 结论
将松柏醇葡萄糖苷-[α-13C]和D-葡萄糖-[6-2H2]及阻诘剂AOA 投入生长的银杏植株中。培养一个月后,新生木质部的13C/2H 丰度显示木质素及聚糖分别被13C和2H 所标记。对双同位素标记的木粉进行硫酸盐法蒸煮,采用酶水解法分离得到浆中的纤维素酶解木质素(CEL),再利用碱抽提从残余木质素中获得碱溶性CEL(CEL-Alk)。
3.1 由13C/2H 双同位素标记的银杏木粉的固态CP/MAS13C NMR 光谱可知,天然银杏木质部中木质素结构单元间主要以β—1、β—5、β—O—4连接,少量木质素单元Cα与多糖类物质以苯甲醚键和缩醛键连接。
3.213C/2H 双同位素标记的CEL-Alk 的13C NMR 分析结果表明,银杏木粉经硫酸盐法蒸煮后残余木质素主要是β—5、β—1 等缩合结构,部分木质素通过缩醛键与多糖类物质相连。
3.313C/2H 双同位素标记的CEL-Alk 的1H NMR 差示谱图显示出木质素单元Cα与葡萄糖或甘露糖形成的苯甲醚键结构,表明苯甲醚键结构在硫酸盐法蒸煮过程中较稳定。

