茶树异胡豆苷合酶基因CsSTR1克隆及表达分析
周棋赢,李娅菲,郭文利,张馨月,葛 鑫,方志贞,孙 洁,王仪佳,陈 尚
(1.信阳师范学院生命科学学院/茶学与食品科技学院,河南 信阳 464000;2. 河南省茶树生物学重点实验室,河南 信阳 464000;3.河南省茶叶精深加工工程技术研究中心,河南 信阳 464000;4.大别山农业生物资源保护与利用研究院,河南 信阳 464000; 5. 信阳师范学院国际教育学院,河南 信阳 464000)
【研究意义】异胡豆苷合酶(Strictosidine synthase, STR)是催化色胺和裂环马钱子苷通过Pictet-Spengler反应合成异胡豆苷的一类酶。研究表明,异胡豆苷是植物体内具有重要药用价值的萜类吲哚生物碱(Terpenoid indole alkaloids,TIAs)合成的通用前体,STR常被用作TIAs代谢工程中的候选基因和作用靶点[1-3]。STR基因的表达受低温、干旱等环境因子,植物激素与病虫害侵染等因素影响,在植物抗逆反应中具有重要作用[4]。茶是世界公认的三大健康饮料之一,具有重要的健康功效。围绕茶树(Camelliasinensis)STR基因(CsSTR)开展研究,为进一步揭示茶叶的药用价值及茶树抗性育种具有重要意义。【前人研究进展】STR的三维结构呈六叶β-螺旋浆状,每叶由4个反向平行的折叠片组成。β-螺旋浆状结构中有3个α螺旋,其中外部和内部的α螺旋通过Cys-89和Cys-101间的二硫键进行连接,这一特征在物种进化过程中具有高度的保守性,当Cys-89被其他氨基酸替代后,STR就会失去活性[5]。因此,该二硫键对于维持酶的整体结构和活性具有重要作用。1988年,STR基因首先在蛇根木(Rauvolfiaserpentina)中得到克隆,被命名为STR1。STR1为单分子蛋白质,由344个氨基酸组成,分子量约为35.3 kD[5]。目前,STR基因已经在长春花(Catharanthusroseus)、日本蛇根草(Ophiorrhizajaponica)、短小蛇根草(O.pumila)、金鸡纳树(Cinchonacalisaya)、萝芙木(R.verticillata)、喜树(Camptothecaacuminata)和臭味假柴龙树(Nothapodytesfoetida)等植物中得到克隆[5-7]。STR基因在植物生长发育和抗逆反应中具有重要作用。在长春花中的研究发现,紫外、盐胁迫、激发子、虫害和MeJA处理都能诱导STR基因表达,而生长素和低温处理则抑制STR基因表达;Ca2+、蛋白磷酸化和NO在植株响应这些处理及调节STR基因表达中具有重要作用[8]。PEG模拟干旱胁迫条件下,随着胁迫时间的延长、胁迫强度增强,STR基因表达量逐渐增加[9]。在日本蛇根草中的研究也发现,植物防御信号SA和MeJA能诱导STR基因的表达[10]。对拟南芥中STR基因的表达模式分析表明,拟南芥中STR基因SSL5、SSL6、SSL7都可以被植物防御信号(SA、MeJA、ET), 伤信号以及病原菌侵染诱导,暗示他们在植物的诱导防御反应中有重要作用[11]。近期研究还发现,在全球气候变暖的趋势下,STR同源基因SSL4增强了高温环境下拟南芥对细菌性青枯病的抗性[12]。水稻中一个STR同源物OsSTRL2,在水稻花药发育和花粉壁形成中具有重要作用[13]。近年来,茶树基因组测序陆续在大叶种‘云抗10号’、中小叶种‘舒茶早’‘龙井43’和‘碧云’以及野生种‘DASZ’中完成[15-17]。河南省茶树生物学重点实验室茶树功能基因组学课题组前期利用生物信息学分析方法,对茶树基因组中的CsSTR基因进行了鉴定和分析[18]。目前为止,CsSTR基因的克隆和表达调控分析还鲜有报道。中国自古就有“神农尝百草,日遇七十二毒,得荼而解之”的历史记载。现代科学研究也发现,茶具有重要的健康功效[14]。茶树作为一种固生、木本经济作物,在生长中常遭受各种逆境胁迫,严重影响茶树的生长、茶叶产量和品质。【本研究切入点】利用RACE克隆,本研究克隆了‘云抗10号’基因组数据库中的一个茶树STR基因(CsSTR1),并对其在非生物胁迫和激素处理条件下的表达量进行分析。【拟解决的关键问题】本研究为后续对CsSTR1基因的功能研究奠定基础,为CsSTR1基因的表达调控及其在茶树抗逆育种中的应用提供理论依据。
1 材料与方法
1.1 RACE克隆
利用“Strictosidine synthase”关键词进行检索,在‘云抗10号’基因组数据库[19]中检索到5个“Strictosidine synthase”基因(CsSTR),其中一个CsSTR基因(CSA035098.1,CsSTR1)的CDS包含不完整的开放阅读框(ORF),采用RACE方法对其全长cDNA进行克隆。首先,利用RNAiso Plus (Takara)试剂提取‘舒茶早’茶树叶片的总RNA,利用cDNA 反转录试剂盒( Takara) 合成第一链cDNA。设计CsSTR1基因片段的扩增引物(F:ATGGACATAGATGAGCACCA; R: AATCCACAACTTGCCATTT TTTTCCT),以第一链cDNA为模板,使用KOD FX DNA聚合酶(TOYOBO)进行PCR扩增。扩增程序为:94 ℃ 5 min; 94 ℃ 30 s, 55 ℃ 30 s, 68 ℃ 30 s, 循环30次; 68 ℃ 7 min。此步骤扩增产物连接到pEASY®Blunt克隆载体 (TransGen Biotech),转化至大肠杆菌DH5α,挑取克隆,经初步PCR鉴定阳性克隆后,送克隆至安徽通用生物公司进行测序。然后,根据SMARTer RACE 5′/3′试剂盒(Clontech)的说明进行:①以 ‘舒茶早’茶树叶片总RNA为模板,分别反转录获取5′ RACE和3′ RACE cDNA模板;②根据克隆测序得到CsSTR1基因的片段序列,设计CsSTR1基因的RACE克隆引物(5′ RACE引物:CCATTGGCAAAAGCAAGGCCTCTTAG;3′ RACE引物:ACAGACACGAGCACGAGCTTTCACAG);③分别对CsSTR1基因5′ RACE和3′ RACE 进行PCR扩增,将扩增产物分别连接到pEASY®Blunt克隆载体,转化大肠杆菌DH5α后,挑取单克隆进行测序。最后,通过序列拼接得到CsSTR1基因的全长cDNA序列。
1.2 生物信息学分析
利用ProtParam、Plant-PLoc、CD-Search、SOPMA和SWISS-MODEL在线工具分别对蛋白理化性质、亚细胞定位、保守结构域、蛋白质二级结构和三级结构进行分析。使用MEGA X软件构建蛋白同源关系进化树。
1.3 材料及处理方法
取生长健康长势一致、来源于同一株信阳群体种茶树的枝条(长度约15 cm)为材料,浸入100 μmol/L脱落酸(ABA)水溶液中进行处理,分别于处理0、3、6、12、24、48 h后,将第2和第3片叶片迅速置液氮中速冻,然后放-80 ℃冰箱保存备用。以相同的方法,将茶树枝条分别浸入1 mmol/L水杨酸(SA)水溶液、1 mmol/L茉莉酸甲酯MeJA溶液(0.5%乙醇溶解)中进行处理。ABA和SA处理组以灭菌水处理组为对照,MeJA处理组以0.5%乙醇处理组为对照。低温处理是将茶树枝条浸入灭菌水中,置于4 ℃冰箱处理;茶树枝条浸入10% PEG-6000 溶液中模拟干旱处理;以常温灭菌水处理组为对照。每个取样时间点设置3个生物学重复。
取根,茎,芽,第1~3叶,花和果材料,迅速置液氮中速冻,然后放-80 ℃冰箱保存备用。每个组织样品取3个生物学重复。
1.4 qPCR分析
利用RNAiso Plus (Takara)试剂提取上述各样品的总RNA,通过琼脂糖凝胶电泳检测RNA的完整性后,利用cDNA 反转录试剂盒(Takara) 合成第一链cDNA。根据克隆得到的CsSTR1基因全长cDNA序列,设计基因特异的qPCR引物(CsSTR1-F: AACAACAGACAAGAGATGAAC;CsSTR1-R:GTGGA GGTGGTTATTGGA)。根据前述方法[20],以茶树CsGAPDH为内参基因(CsGAPDH-F:TTGGCATCGTTGAGGGTCT;CsGAPDH-R:CAGTGGGAACACGGAA AGC),对CsSTR1基因的表达量进行分析。
2 结果与分析
2.1 CsSTR1基因RACE克隆
根据CSA035098.1的CDS序列,通过PCR扩增,得到500~600 bp的条带(图1-A);经测序确认,表明克隆序列与目标序列基本一致,但克隆序列长度为591 bp, 与目标序列相比有17个碱基不同,且在对应CSA035098.1 107 bp后有74 bp的碱基插入,在对应CSA035098.1 136 bp后有个G碱基插入。根据591 bp的测序序列设计CsSTR1基因的5′ 和3′ RACE克隆引物。CsSTR1基因的5′ 和3′ RACE克隆分别得到长度为813和 803 bp的片段(图1-B);经测序分析,表明RACE克隆成功。将前面得到的591 bp扩增序列与5′ 和3′ RACE克隆序列进行拼接,得到CsSTR1基因的全长cDNA序列。CsSTR1基因全长1382 bp,其中CDS 1131 bp,编码376个氨基酸;5′ UTR 长92 bp,3′ UTR 长159 bp(图2)。

1. DNA分子质量标准;2. 基因部分片断扩增产物;3. 5′ RACE扩增产物;4. 3′ RACE 扩增产物

图2 茶树CsSTR1基因的cDNA序列及推导的氨基酸序列
2.2 CsSTR1蛋白特征及结构
CsSTR1蛋白理化分析表明,该蛋白相对分子量为41.5 kD,理论等电点为 6.36,不稳定指数为29.74,脂肪族氨基酸指数为88.94,亲水性平均系数为-0.077。亚细胞定位预测分析表明,该CsSTR1蛋白为液泡定位蛋白。保守结构域分析显示,该蛋白在157~252 位氨基酸处具有异胡豆苷合酶Str_synth保守结构域(图3)。CsSTR1蛋白二级结构主要由无规卷曲、延伸链、α螺旋和β转角组成,占比分别为42.82%、29.79%、16.76%、10.64%(图4)。三维结构预测结果显示,CsSTR1蛋白由β折叠片组成六叶β-螺旋浆状,中间有3个α螺旋(图5),与结构模板6n5v.1.A间的同源性达35.25%。
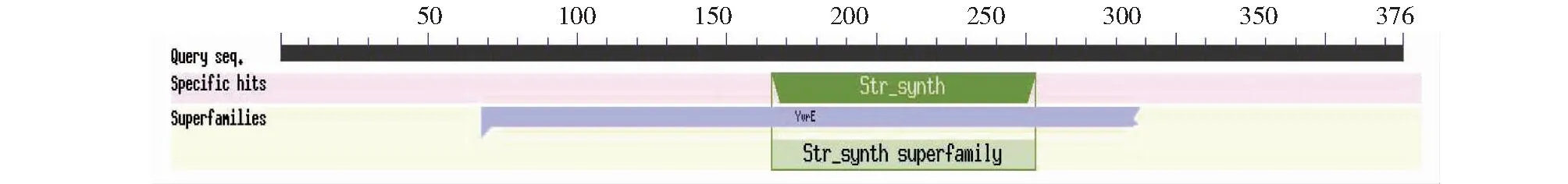
图3 茶树CsSTR1蛋白的保守结构域鉴定

图4 茶树CsSTR1蛋白的二级结构预测
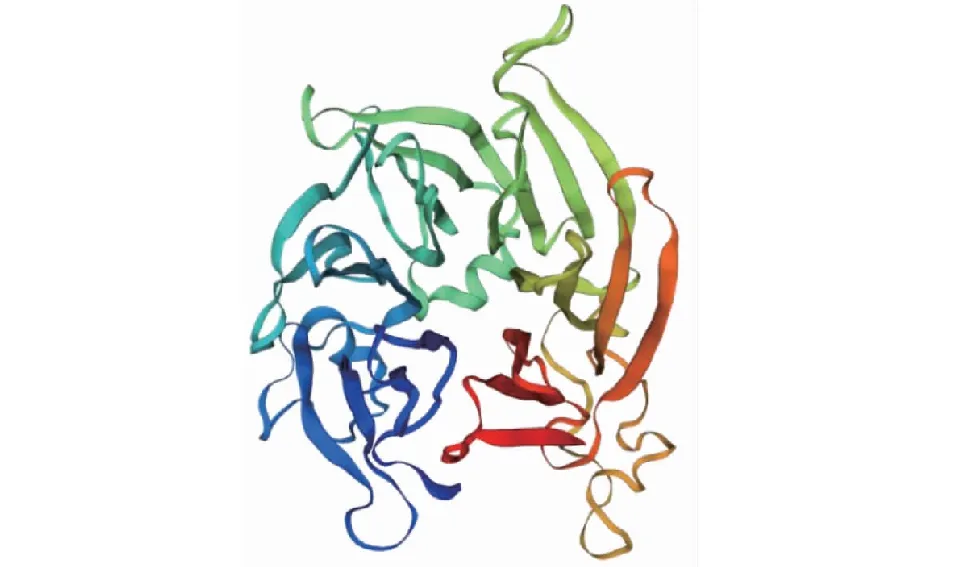
图5 茶树CsSTR1蛋白的三级结构预测
2.3 CsSTR1系统进化分析
将CsSTR1与已报到的植物STR蛋白构建系统进化树,结果显示CsSTR1与水稻STR蛋白OsSTRL2的亲缘关系最近(图6),而与萝芙木、蛇根木、长春花等夹竹桃科植物中的STR以及拟南芥中的STR蛋白SSL亲缘关系较远。
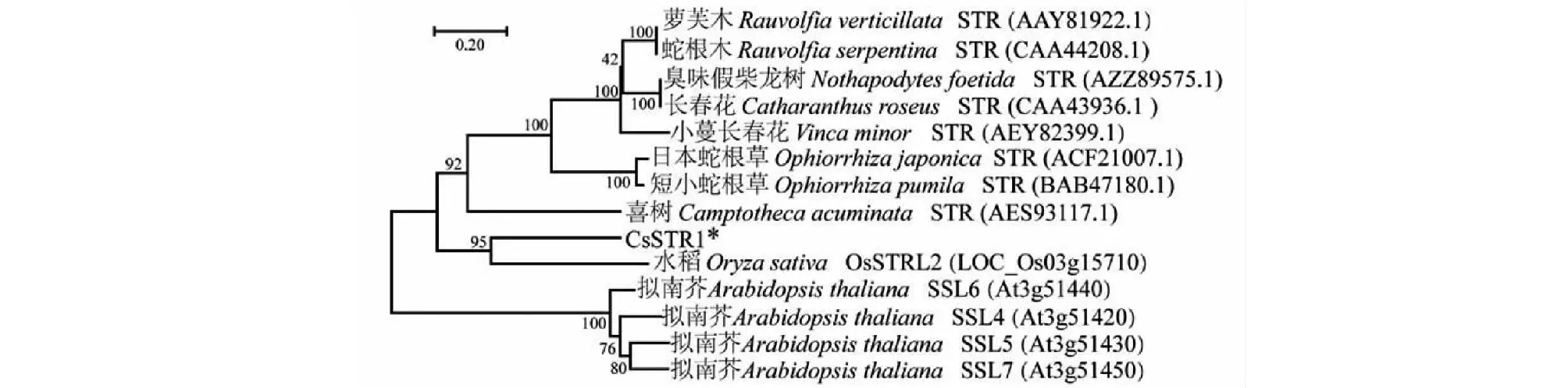
图6 茶树CsSTR1蛋白与其他物种STR蛋白的系统进化树
2.4 CsSTR1基因的表达模式
组织表达模式分析结果表明,CsSTR1基因在芽和嫩叶(第1~3叶)中的相对表达量较高,在老叶、花和果中的相对表达量较低(图7)。低温胁迫条件下,CsSTR1基因在3 h后表达量显著上调,6~24 h 表达量呈下调趋势,12 h 后CsSTR1基因呈显著下调表达,48 h后表达量恢复到处理前水平。PEG 模拟干旱处理条件下,CsSTR1基因在24~48 h后呈现显著上调表达,在48 h后其表达量上调近10倍。MeJA处理后,CsSTR1基因呈现上调表达,在24~48 h后呈现显著上调。SA处理后,CsSTR1基因呈现显著上调表达,3 h后其表达水平上调3.3倍。ABA处理后,CsSTR1基因在3~12 h表达变化不大,但在24~48 h后呈显著下调表达。
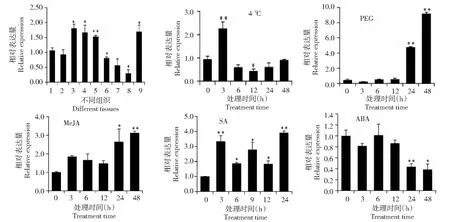
1:根; 2:茎; 3:第1叶;4:第2叶;5:第3叶;6:老叶;7:花;8:果;9:芽.*表示在0.05水平上差异显著,**表示在0.01水平上差异显著
3 讨 论
STR是植物体内调控TIAs合成的重要酶类,还在植物的生长发育和逆境反应中具有重要作用[1-4, 13]。近年来,茶树基因组的破译为茶树优质基因资源的挖掘利用以及茶叶药理作用的进一步研究提供了资料。前期研究发现茶树基因组中具有17个STR基因[18],但目前还没有一个CsSTR基因得到克隆。河南省茶树生物学重点实验室茶树功能基因组学课题组对CsSTR基因的克隆起始于最早破译的‘云抗10号’茶树基因组数据,由于其基因组中一个CsSTR基因(CsSTR1)的CDS包含不完整的开放阅读框(ORF),利用RACE技术,对CsSTR1基因进行了克隆。结果表明,克隆的CsSTR1基因CDS包含完整的编码框,比‘云抗10号’基因组数据注释的对应CDS序列(CSA035098.1)长615 bp,且有17个碱基位点不同。这些碱基位点的不同是否由于‘舒茶早’与‘云抗10号’之间的物种差异造成的,还需要进一步研究。与2018年公布的‘舒茶早’茶树基因组[21]中对应的STR基因(TEA012295.1)CDS序列相比,除在912位有个A与T碱基的颠换,在299 bp后有258 bp的插入,其余序列与该STR基因(TEA012295.1)的CDS序列完全一致。进一步分析显示,CsSTR1基因CDS序列与新公布的‘舒茶早’高质量基因组数据库中对应STR基因(CSS0030692.1)的CDS序列完全一致,表明本研究RACE克隆的准确性。同时,通过RACE克隆,本研究还得到CsSTR1基因的5′ 和3′ UTR序列,为设计CsSTR1基因特异引物进行基因表达研究以及CsSTR1基因上游调控因子的分离鉴定和调控研究奠定了基础。
CsSTR1蛋白三维结构预测分析表明,CsSTR1蛋白呈六叶β-螺旋浆状;亚细胞定位预测分析表明,CsSTR1定位于液泡,这与已有的研究一致[5]。系统进化分析显示,CsSTR1与水稻OsSTRL2的同源性最高,而与萝芙木、蛇根木、长春花等植物中的STR同源性较低,暗示CsSTR1可能不具有催化异胡豆苷合成的功能。研究表明,OsSTRL2主要在花器官中表达,在花药发育和花粉形成中有重要作用,OsSTRL2基因敲除突变导致水稻雄性不育;另外,OsSTRL2突变体还呈现出花药外表皮上不正常的蜡质晶体,可能还影响了水稻对病原菌的抗性[13]。CsSTR1基因在芽和幼叶中表达量较高,而在花和果中表达量较低。表明CsSTR1与OsSTRL2的表达调控不完全一致。CsSTR1可能在茶树芽叶发育和病虫害防御反应中发挥作用。根据最近的研究结果,在利用更大范围STR蛋白构建的系统进化树中,CsSTR1与拟南芥中STR同源蛋白(AT3G57030.1)的亲缘关系最近,与水稻OsSTRL2蛋白位于同一进化分枝[18]。研究表明,拟南芥中该STR (AT3G57030.1)参与调控类黄酮物质的合成[22]。茶叶中类黄酮是具有重要健康功效的内含成分,而且是茶树参与抗逆反应的重要次生代谢物[19, 23]。
STR在应答逆境胁迫和激素信号中有重要作用。CsSTR1基因受低温和PEG模拟干旱处理诱导表达,结果提示CsSTR1参与茶树对低温和干旱的响应。前期研究显示,STR基因表达受干旱脱水胁迫诱导,但低温处理下调STR基因表达[8-9]。虽然CsSTR1受低温诱导表达,但上调表达只出现在低温处理3 h后,在其他检测时间段(6~48 h)呈现下调表达。已有研究表明,植物对低温的应答途径包括ABA非依赖途径和不依赖CBF两条途径[24]。ABA处理后,CsSTR1基因在24~48 h后显著下调表达,暗示CsSTR1基因是以ABA非依赖途径参与对低温的应答。MeJA和SA处理后,CsSTR1基因都呈现上调表达,这与已有的报道一致[8, 10-11]。MeJA和SA是植物体内重要的信号物质,在调控植物胁迫反应和生长发育中都具有重要作用[25]。MeJA还参与调节植物体内的次生代谢[26]。因此,CsSTR1可能通过参与调控茶树次生代谢,在茶树应对逆境胁迫中发挥作用,但其具体的作用机制还需要后续进一步研究。
4 结 论
本研究克隆了茶树中一个异胡豆苷合酶基因CsSTR1。其CDS长1131 bp, 编码376个氨基酸,分子量41.5 kD;5′和3′UTR长分别为92和159 bp。CsSTR1具有异胡豆苷合酶Str_synth保守结构域,其三维结构呈六叶β-螺旋浆状。系统进化分析表明,CsSTR1与水稻OsSTRL2具有较近的亲缘关系。CsSTR1在茶树芽和第1~3叶中表达量较高,在花和果中表达量较低;低温、PEG、MeJA和SA处理均诱导CsSTR1上调表达,ABA处理后CsSTR1下调表达,表明CsSTR1在茶树响应生物和非生物胁迫反应中具有重要作用。

