溶液酸碱性的判断与pH 的计算
亓华兴
(山东省济南市莱芜第二中学)
溶液酸碱性的判断是高考的考点之一,也是学生学好电解质溶液的关键之一,涉及水的电离平衡与盐类的水解等.
1 溶液酸碱性的判断

图1
例1 关于溶液的酸碱性,下列说法正确的是( ).
A.pH=7的溶液呈中性
B.中性溶液中一定有c(H+)=1.0×10-7mol·L-1
C.c(H+)=c(OH-)的溶液呈中性
D.在100 ℃时,纯水的pH<7,因此显酸性

在100 ℃时,纯水的pH=6,呈中性,该温度下pH=7的溶液呈碱性,所以温度未知时,不能根据pH 大小判断溶液酸碱性,选项A、D 错误.常温下中性溶液中c(H+)=1.0×10-7mol·L-1,温度未知,中性溶液中不一定有c(H+)=1.0×10-7mol·L-1,选项B错误.c(H+)=c(OH-)的溶液呈中性,与溶液温度高低无关,选项C正确.答案为C.
2 溶液pH 的计算方法
2.1 单一溶液pH 的计算(25 ℃)

表1
2.2 不同浓度的强酸(或强碱)混合后pH 的计算(25 ℃)
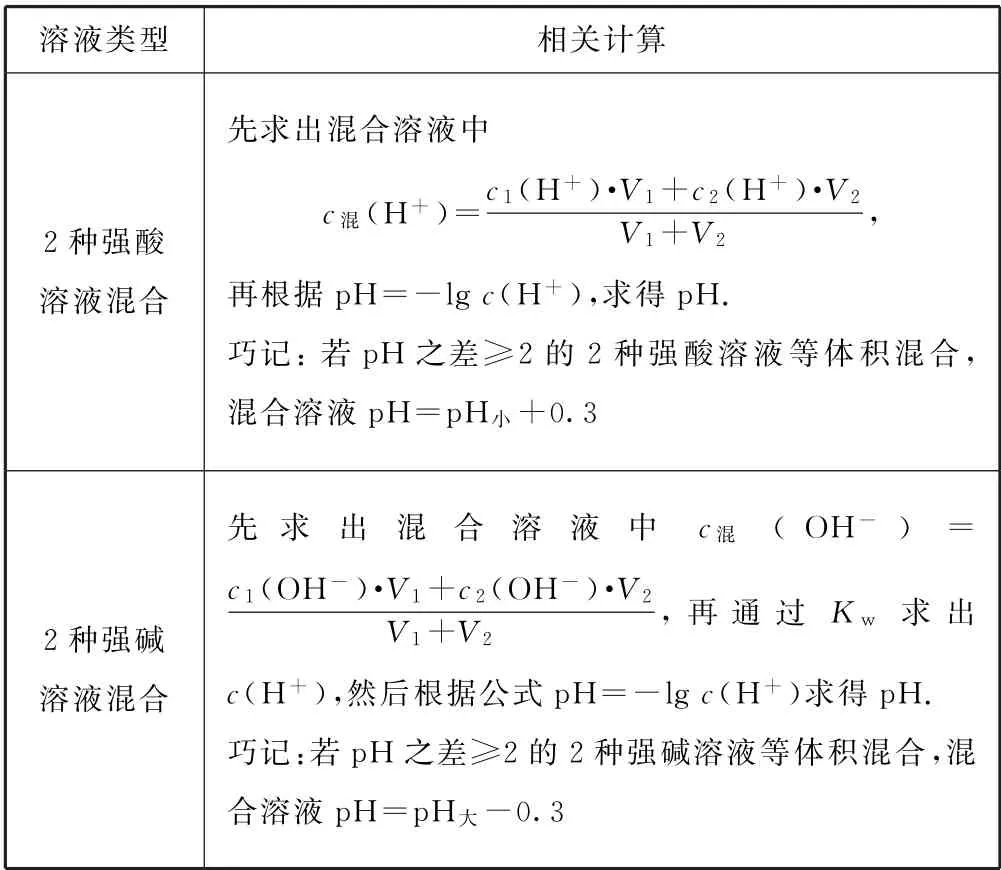
表2
2.3 强酸强碱中和反应后溶液pH 的计算(25 ℃)
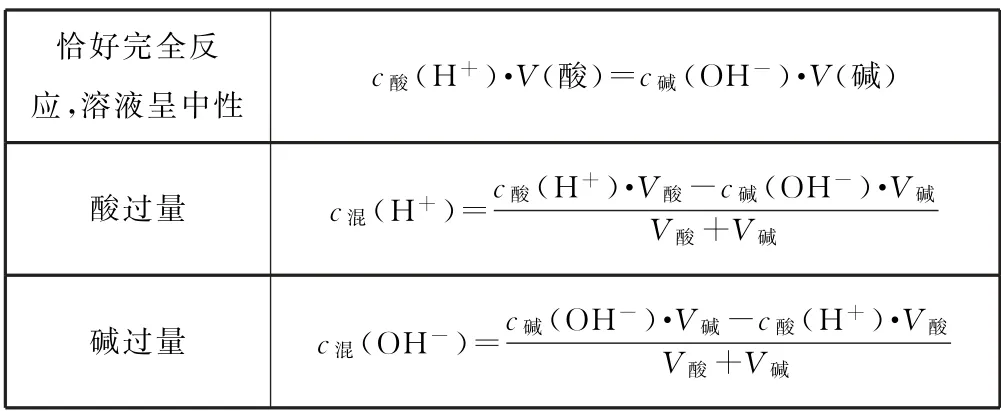
表3
2.4 酸、碱稀释后溶液pH 的计算

表4

例3 25 ℃时,若pH=a的10体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH 与强碱的pH 之间应满足的关系为( ).
A.a+b=14 B.a+b=13
C.a+b=15 D.a+b=7

2)等体积强酸(pH1)和强碱(pH2)混合:
若pH1+pH2=14,则溶液呈中性,pH=7;若pH1+pH2>14,则溶液呈碱性,pH>7;若pH1+pH2<14,则溶液呈酸性,pH<7.
3)酸与碱的pH 之和为14,等体积混合:
若为强酸与强碱,则pH=7;若为强酸与弱碱,则pH>7;若为弱酸与强碱,则pH<7.
规律:谁弱谁过量,谁弱显谁性[酸和碱已电离出的H+与OH-恰好中和,谁弱谁的H+或OH-有储备(即物质过量),还能继续电离].
例4 常温下,pH=11的X、Y 2 种 碱 溶 液 各1mL,分别稀释到100mL,其pH 与溶液体积(V)的关系如图2所示,下列说法正确的是( ).

图2
A.X、Y2种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X 溶液的碱性比Y 溶液的碱性强
C.分别完全中和X、Y 这2种碱溶液时,消耗同浓度盐酸的体积V(X)>V(Y)
D.若9<a<11,则X、Y 都是弱碱

由图可知,pH=11的X、Y2种碱溶液稀释到原溶液体积的100倍时,pH:Y>X,所以物质的量浓度:c(Y)>c(X),稀释后溶液碱性:Y>X,故选项A、B均错误.因为c(Y)>c(X),且V(Y)=V(X),故n(Y)>n(X),所以中和同浓度的盐酸时,Y消耗得多,选项C错误.若9<a<11,说明稀释到原溶液体积的100 倍时,X、Y 的pH 均减小不到2 个单位,故X、Y 都是弱碱,选项D 正确.答案为D.
【方法点拨】酸碱溶液稀释过程pH 的变化趋势图(如图3).

图3

