晚期甲状腺癌靶向治疗和免疫治疗研究新进展
毛爱红,武元元,王军
甲状腺癌是头颈部常见恶性肿瘤,也是内分泌系统最常见的恶性肿瘤。根据全球癌症统计报告,2020年全球甲状腺癌新发病例数为586 202例,新增死亡病例数为53 646例[1],与2018年全球癌症统计报告相比,新发病例增加了18 969例,死亡病例增加了2 575例[1-2]。甲状腺癌发病率的增长速度在所有恶性肿瘤中位居首位。
甲状腺癌起源于滤泡上皮细胞或滤泡旁C细胞。根据组织病理学特征,滤泡细胞来源的甲状腺癌又分为4种[3]:乳头状甲状腺癌(papillary thyroid carcinoma,PTC),占80%~85%;滤泡性甲状腺癌(follicular thyroid carcinoma,FTC),占10%~15%;低分化甲状腺癌(poordifferentiated thyroid carcinoma,PDTC),﹤2%;间变性甲状腺癌(anaplastic thyroid carcinoma,ATC),﹤2%。PTC和FTC合称为分化型甲状腺 癌(differentiated thyroid carcinoma,DTC),占绝大多数(90%)。
手术是大多数甲状腺癌患者的标准治疗方法。对于低风险的DTC患者可以进行单纯的手术治疗,而对于具有高风险特性的DTC患者,可能需要促甲状腺素(thyroid-stimulating hormone,TSH)抑制和放射性碘(radioactive iodine,RAI)治疗。外科手术、RAI消融和TSH抑制治疗模式能够使大多数DTC患者获得良好的预后。然而,有2%~5%的DTC患者在治疗或自然病程中失去分化表型,5%~10%的患者发展为远处转移。虽然ATC的恶性程度高、致死性强,但其发病率低,因此大多数甲状腺癌相关性死亡的原因是DTC进展为RAI难治性(RAI refractoriness,RAIR)甲状腺癌。对于晚期RAIR甲状腺癌患者而言,治疗方法十分局限。此外,传统治疗模式对甲状腺髓样癌(medullary thyroid carcinoma,MTC)和ATC也往往无效。化疗对晚期转移性甲状腺癌的疗效有限。上述问题促使人们不断地探索和尝试采用其他可行的治疗策略。
甲状腺癌的发生、发展、侵袭和转移与基因改变以及信号转导通路及相关分子的功能紊乱密切相关。这些分子水平的改变不仅是甲状腺癌诊断及预后判断的标志,也是生物学治疗的潜在靶点。分子生物学的发展为晚期转移性甲状腺癌的靶向治疗和免疫治疗带来了可能。本文总结了对晚期甲状腺癌具有良好抗肿瘤活性和临床效益的靶向治疗和免疫治疗进展,以期改善晚期甲状腺癌患者的预后。
1 甲状腺癌分类及分子标志物
1.1 DTC
DTC约占甲状腺癌的95%,包括PTC和FTC。PTC占DTC确诊病例的85%,FTC占12%[4]。尽管大多数DTC患者的预后良好,但是仍有10%~15%的DTC患者出现肿瘤复发,2%~5%的DTC患者出现远处转移(肺和骨转移)以及发生甲状腺癌相关死亡。DTC是通过BRAF和RAS激活突变或RET/PTC重排激活甲状腺细胞异常增殖而驱动的。最常见的突变是BRAFV600E,见于40%~80% 的PTC,并且多见于cPTC(classical variant of PTC)和tcPTC(tall-cell variant of PTC)。BRAFV600E突变与淋巴结转移、甲状腺外侵犯、RAI抵抗以及临床晚期相关。有关BRAFV600E突变的PTC预后有不同的研究结果。似乎只有与TERT启动子突变结合才真正与PTC侵袭性相关[5]。BRAFV600E突变导致MAPK信号通路上游靶点RAS的组成型激活,最终导致ERK1/2活化(图1)[6]。BRAFV600E突变被认为是PTC发生和发展的基本起始事件之一[7]。另一个是RAS突变(NRAS、HRAS和KRAS),虽然其在PTC中的作用较小(6%~20%),但是在高达40%~50%的FTC中存在RAS突变。RAS突变和PAX8/PPARγ重排是FTC的驱动因素。此外,RAS突变被认为是一种癌前突变,需要额外的突变来触发癌变,如抑癌基因TP53和PTEN的突变和(或)缺失[8]。尽管在cPTC中没有发现RAS突变和PAX8-PPARγ融合,但在FV-PTC(follicular variant of PTC)中却很常见(90%)[9]。除了BRAFV600E和RAS以外,其他的基因突变如PTEN、PIK3CA、EIF1AX、DICER1、TSHR以及TERT启动子突变也被认为是促进滤泡细胞向DTC转化所必需的[10]。
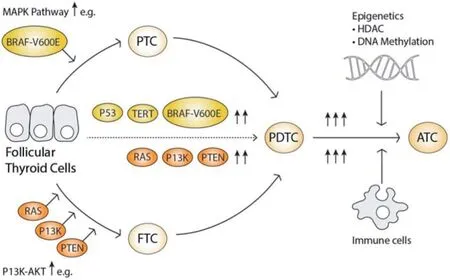
Fig.1 Moleculars in initiation and progression of thyroid cancer图1 参与甲状腺癌发生和发展的分子
1.2 PDTC
PDTC缺乏典型的PTC核特征,即有丝分裂活性高和肿瘤坏死。PDTC通常表现为血管侵犯、淋巴结转移和甲状腺外侵犯,有时发生远处转移。通常,DTC的病灶与PDTC并存,提示原发肿瘤去分化(图1)[3]。PDTC的基因突变率高于DTC。20%~50%的PDTC患者发生RAS突变,35%的PDTC患者发生BRAFV600E突变。与PDTC肿瘤侵袭性相关的基因改变还包括TERT启动子突变(20%~50%)和TP53突变(10%~35%),这些突变与RAS和BRAFV600E突变同时发生。此外,在PDTC中,也被报道了其他基因的改变,如CTNNB1和EIF1AX突变以及ALK重排;基因拷贝数改变也很常见,如1q染色体增加以及1p、13q、15q和22q染色体丢失[3]。
1.3 ATC
ATC是一种临床罕见但侵袭性极强的高致死性恶性肿瘤,占所有甲状腺癌的1.7%。ATC进展迅速,75%的患者出现远处转移(肺、骨和大脑),预后较差,占所有甲状腺癌相关死亡的20%~50%,中位生存期为3~6个月。ATC不摄碘,RAI治疗无效,常规化疗效果非常有限。有趣的是,20%~50%的ATC与DTC相关,表明额外基因突变增加,导致去分化和更具侵袭性的表型[11]。ATC中最常见的突变是BRAFV600E(20%~45%)、TP53突变(高达70%)和RAS突 变(20%~40%)[12]。此 外,TERT启动子突变与BRAF突变和肿瘤更具侵袭性相关[13]。其他与ATC侵袭性相关的基因突变也已有报道,如涉及EIF1AX、NF1、KMT和PI3K/AKT通路中的基因[14]。此外,ATC细胞的角蛋白、波形蛋白和N-钙黏蛋白呈阳性,而甲状腺转录因子1、甲状腺球蛋白和NIS(sodium iodine symporter)呈阴性。
1.4 MTC
不同于其他甲状腺癌,MTC来源于滤泡旁C细胞,占所有甲状腺癌的3%~5%。大多数MTC是偶发的,常与多发性内分泌瘤(multiple endocrine neoplasia,MEN)2A型和2B型综合征相关。大多数MTC患者出现颈部肿块时伴颈部淋巴结转移。RET点突变是MTC的标志,该突变存在于MEN2A和MEN2B型患者以及60%的散发性MTC患者中[15]。
2 甲状腺癌的治疗
甲状腺癌的治疗通常是多学科的,包括积极监测、手术、RAI消融和TSH抑制。当疾病仅涉及局部结构时,手术切除原发灶和区域淋巴结清扫相结合;对于高危患者,术后还应进行RAI消融和TSH长期抑制治疗。RAI消融也用于摄碘的复发和转移性DTC。传统治疗对于晚期转移性甲状腺癌的作用十分有限,目前靶向治疗和免疫治疗已成为晚期转移性甲状腺癌治疗模式的新选择。
2.1 靶向治疗
随着对甲状腺癌发病过程中基因改变的不断识别和发现,针对导致甲状腺癌发生靶点的药物层出不穷,主要包括酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)、BRAF抑制剂和RET抑制剂等(表1)。虽然不能治愈甲状腺癌,但当传统治疗模式无效时,靶向治疗可以控制肿瘤生长、延缓疾病进展以及逆转基因改变导致的治疗耐受或抵抗,使传统治疗再次有效。

表1 晚期甲状腺癌靶向治疗的TKIsTable 1 TKIs with activity for thyroid cancers
2.1.1 逆转DTC的碘抵抗
有多项因素会影响DTC的131I治疗效果,包括患者的年龄、肿瘤的病理类型、转移情况以及TSH、NIS和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达水平。随着时间的推移,大多数DTC患者丧失摄碘能力,发展为RAIR-DTC。RAIR-DTC患者的5年生存率为66%,10年生存率仅为10%[26]。能否逆转DTC的碘抵抗是目前的研究重点。
研究发现,由SLC5A5编码的NIS表达有助于放射性131I摄取以及随后的肿瘤清除[27],而BRAFV600E突变导致DTC细胞去分化和NIS表达抑制,造成甲状腺癌细胞不摄碘[28]。临床前试验研究的结果表明,使用MEK或BRAF抑制剂阻断MAPK通路激活可以促进NIS重新表达,从而恢复对RAI的敏感性[29-30]。此外,数项小规模的临床试验也证实,阻断MAPK信号通路的激活,可以逆转RAIR-DTC对RAI的敏感性。HO等[31]发现,20例接受MEK抑制剂selumetinib治疗后,有12例患者的碘吸收增加,其中8例达到接受RAI治疗的阈值。有趣的是,这项试验招募了BRAF和RAS基因突变的患者,并且5例RAS突变患者的碘摄取都有所增加。随后,经RAI治疗后,4例患者出现明确的局部应答[31]。BRAF抑制剂vemurafeni和dabrafenib也显示出类似的结果[32]。另有一项Ⅱ期随机临床试验(NCT02393690)研究了selumetinib或安慰剂处理复发或转移性DTC后是否可使其重新摄碘,同时增强RAI治疗的疗效,结果有待公布(NCT02393690)。在临床上,建议开展基因组突变分析,以确保在使用RAI治疗前选择合适的TKI,而不是在进展为RAIR后再选用MEK/BRAF抑制剂以逆转碘摄取。
2.1.2 复发或转移性RAIR-DTC的靶向治疗
大多数DTC患者经手术和辅助治疗后可以获得痊愈,但仍有5%~10%的患者发展为远处转移。目前,针对复发或转移性RAIRDTC的治疗以多激酶抑制剂(multikinase inhibitor,MKI)为中心。无论是一线治疗还是作为挽救性治疗,MKI都显示出对RAIRDTC的疗效。
基于2项Ⅲ期随机双盲临床试验(DECISION、SELECT)的结果,美国食品药品监督管理局批准sorafenib和lenvatinib用于复发性或转移性RAIR-DTC[17-18],但是这2种MKI靶向药物都可导致较高的不良事件发生率,在接受lenvatinib治疗的患者中,76%出现3级及以上的不良事件。因此,对RAIR-DTC靶向治疗的安全性和有效性,仍应持续研究。
最近,美国食品药品监督管理局又批准了selpercatinib和pralsetinib用于RET融合阳性DTC的治疗。与之前的MKI相比,这些选择性RET抑制剂不仅有效,而且具有良好的安全性。WIRTH等[23]开展的临床试验显示,19例既往接受过治疗的RET融合阳性DTC患者在接受selpercatinib治疗后,总有效率为79%(95%置信区间:54%~94%),1年无进展生存率为64%(95%置信区间:37%~82%)。另一项研究表明,12例RET融合阳性PTC患者接受pralsetinib治疗后,总有效率为91%,其中1例患者在报告时病情稳定[24]。
ALK/NTRK融合是DTC中存在的少见基因组病变。虽然目前美国食品药品监督管理局尚未批准ALK抑制剂用于甲状腺癌的靶向治疗,但是NTRK抑制剂larotrectinib和entrectinib已获得美国食品药品监督管理局的批准用于治疗组织来源不明的NTRK融合阳性恶性肿瘤。最近,CABANILLAS等[33]报道了21例DTC患者接受larotrectinib治疗的效果,结果显示总有效率为90%(95%置信区间:70%~99%),中位无进展生存期未达到。考虑到NTRK抑制剂的高有效率以及较小的不良反应,对RAIR-DTC中的这类基因改变患者尝试进行NTRK抑制剂治疗是必要的。
2.1.3 ATC的靶向治疗
2018年,SUBBIAH等[34]开展了一项非随机的Ⅱ期临床试验,使用BRAF抑制剂dabrafenib联合MEK抑制剂trametinib治疗BRAFV600E突变的局部晚期或转移性ATC。16例BRAFV600E突变的ATC患者被纳入这项开放标签Ⅱ期临床试验中,中位随访47周,结果显示总有效率为69%(11/16)(95%置信区间:41%~89%),Kaplan Meier曲线估计的12个月总生存率为80%,明显高于ATC的预期生存率。基于这项临床试验的结果,美国食品药品监督管理局批准dabrafenib联合trametinib用于不适合手术或放疗的ATC。当ATC患者不适合手术或放疗时,dabrafenib联合trametinib治疗应被考虑作为BRAFV600E突变ATC患者的一线治疗方案。此外,也可考虑将dabrafenib联合trametinib治疗作为局部晚期BRAFV600E突变ATC患者的术前新辅助化疗。
随着基因组测序数据的公布,包括RET、ALK和NTRK基因重排等其他罕见基因改变也被识别出来。例如,在1例转移性ATC患者中发现CCDC6/RET融合,采用RET抑制剂selpercatinib治疗后,可获得持续19个月的部分缓解[35]。1例ALK1融合患者接受ALK抑制剂crizotinib治疗后出现部分缓解;同一例患者在出现疾病进展后,使用二代ALK抑制剂ceritinib治疗后接近于完全缓解[36-37]。对于NTRK融合阳性的ATC患者,可以考虑larotrectinib治疗[33]。靶向这些基因改变显示出显著的临床获益。其他MKI治疗ATC的临床试验也正在进行之中[38]。希望上述探索能够转化为ATC患者的临床获益。考虑到ATC极高的侵袭性和极低的生存率,目前面临的最大挑战是如何迅速识别这些基因改变。
2.1.4 MTC的靶向治疗
基于Ⅲ期随机双盲临床试验的结果,不可切除的进展转移性MTC患者接受vandetanib或cabozantinib治疗后,其总有效率和无进展生存率均明显提高[20-21],因此美国食品药品监督管理局批准RET抑制剂vandetanib和cabozantinib用于进展转移性MTC的治疗。
2020年,WIRTH等[23]发表了一项Ⅰ/Ⅱ期临床试验的结果,使用强效小分子RET抑制剂selpercatinib治疗MTC。88例既往未接触过vandetanib或cabozantinib的RET突变MTC患者在接受selpercatinib治疗后,总有效率为73%(95%置信区间:62%~82%),1年无进展生存率为92%(95%置信区间:82%~97%)[23]。在55例既往接触过MKI的患者中,总有效率和无进展生存率也有所提高。此外,新型RET抑制剂pralsetinib也正在MTC患者中开展Ⅱ期临床试验,在79例有应答的患者中,总有效率为65%(95%置信区间:53%~75%),与接受MKI治疗的患者的应答率相当[24]。基于上述研究的结果,美国食品药品监督管理局批准selpercatinib和pralsetinib用于治疗RET突变的MTC。然而,与vandetanib和cabozantinib相比,还需要开展进一步的研究以证实其对MTC患者的生存获益。
2.2 免疫治疗
一项研究对505例甲状腺癌患者进行免疫评分,结果显示甲状腺癌分化程度与免疫抑制标志物CTLA-4和PD-L1呈显著负相关。与野生型肿瘤相比,这些免疫抑制标志物更多见于BRAFV600E突变的肿瘤[39]。PD-L1表达水平升高已在一些实体肿瘤中得到了证实,并与不良预后相关[40-41]。表达PD-L1的肿瘤细胞可以抑制T细胞在肿瘤微环境中的激活,从而保护肿瘤细胞免受免疫应答的影响。MASSARI等[42]对185个PTC和66个良性结节中的PD-L1预后潜能进行分析,结果表明甲状腺癌中PD-L1表达水平的增加与更高的复发风险和更短的无病生存期有关。尤其是ATC,通常发生免疫逃逸基因扩增[43]。这些结果表明,靶向PD-L1可能是晚期转移性甲状腺癌的一种有效的治疗方法。
2.2.1 RAIR-DTC的免疫治疗
在一项评估抗PD-1抗体pembrolizumab安全性和抗肿瘤活性的Ⅰb期临床试验[44]中,治疗前4周内未接受过抗肿瘤单抗治疗或2周内未接受过靶向治疗且PD-L1表达阳性的22例局部晚期或转移性DTC患者,每2周服用10 mg/kg的pembrolizumab,持续24个月;结果显示,57%的FTC患者和60%的PTC患者病情稳定,中位持续时间为7个月,6和12个月的无进展生存率分别为59%和36%;2例PTC患者分别于治疗4和5个月后出现部分缓解,应答持续时间分别为20和8个月,由此揭示了pembrolizumab的临床获益,表明靶向PD-1是一种很好的治疗晚期甲状腺癌的策略。
最近,一项Ⅱ期临床试验(NCT02973997)[45]评估了pembrolizumab联合lenvatinib治疗RAIR-DTC的疗效,结果显示20例患者中有3例(15%)在接受联合用药后出现部分缓解,中位无进展生存期为12.6个月(95%置信区间:7.1~18.2个月)。另一项Ⅱ期临床试验[46]研究了PD-1联合CTLA-4免疫检查点抑制剂治疗RAIR-DTC患者的疗效,32例患者中有3例(9%)获得部分缓解;该方案也在ATC患者中进行了试验,10例患者中有3例(30%)获得部分缓解。这些结果表明,抗PD-1/PD-L1抗体联合TKI或免疫检查点抑制治疗是一种很有前景的转移性甲状腺癌的治疗策略。
2.2.2 ATC的免疫治疗
一项Ⅰ/Ⅱ期临床试验[44]评估了PD-1抑制剂spartalizumab治疗ATC的疗效,结果显示42例ATC患者的总有效率为19%,包括5例达到部分缓解和3例达到完全缓解;持续应答时间从16.7周至1.6年(临床试验还在进行之中),1年无进展生存率为17%。PD-L1阳性与肿瘤应答之间有明确的相关性(总有效率:29%vs0%)。临床前研究[47]证实,ATC患者接受BRAF抑制剂联合治疗可以增强抗PD-1/PD-L1抗体的活性。一项前瞻性研究[48]采用PD-L1抑制剂atezolizumab联合vemurafenib和cobimetinib(队列1:BRAFV600E肿瘤)或联合单独cobimetinib(队列2:RAS和NF突变肿瘤)治疗ATC患者,结果显示队列1中的17例患者的总有效率为71%,包括11例达到部分缓解(65%)以及1例达到完全缓解(6%),队列2中的14例患者的总有效率为7%,只有1例达到部分缓解(7%)。虽然总有效率不太令人满意,但中位生存期达到18.23个月(95%置信区间:4.47个月~NE),这在非BRAF突变队列中是值得注意的。此外,dabrafenib 联合trametinib治疗后出现进展的12例ATC患者在接受pembrolizumab治疗后出现客观应答[49]。PD-1抑制剂cemiplimab联合dabrafenib+trametinib和PD-L1抑制剂pembrolizumab联合lenvatinib治疗ATC的2项临床试验(NCT04238624、NCT04171622)正在进行之中,其结果值得期待。
3 结论
虽然目前针对驱动突变的靶向治疗和免疫治疗为晚期、转移性和RAIR甲状腺癌提供了新的治疗策略,并且临床前和临床试验也显示出显著的临床获益,但是晚期、转移性和RAIR甲状腺癌的靶向治疗和免疫治疗仍面临巨大挑战,尤其是存在治疗应答差异性大、治疗后耐药以及多靶点检测费用昂贵等问题。因此,晚期甲状腺癌的治疗仍有很长的路要走,需要进一步研究以改进治疗策略,以期为晚期转移性甲状腺癌患者提供更好的治疗选择,延长其生存期和提高生活质量。未来,分子检测尤其是下一代测序技术在晚期甲状腺癌的治疗中将必不可少,可以辅助指导患者的风险分层以及治疗方案的选择。

