例析“原电池”知识


摘要:本文从中学物理的角度出发,结合例题从本质上厘清原电池装置的原理,建立对电化学过程的系統分析思路,提高学生对电化学本质的认识,促使学生认识中学电化学中电极名称、电流方向、电荷移动方向等容易混淆的问题.
关键词:电化学;原电池;高中化学
中图分类号:G632文献标识码:A文章编号:1008-0333(202301-0143-03
收稿日期:2022-10-05
作者简介:潘科(1992.11-,男,广西壮族自治区南宁人,硕士在读,从事化学教育研究.
1 原电池原理
1.1 为什么电子会发生转移?
原电池两电极存在电极电势,若要使原电池正常工作,必须一端电势低,一端电势高,形成电势差,电子在电势差的驱动下由低电势一极向高电势一极定向移动.自发的氧化还原反应这一形成原电池的前提条件,实质上正是在选用能产生电势差的反应物,即还原剂与氧化剂.还原剂主要处于低电势的一极,可以由电极本身或由外加的物质提供电子;氧化剂主要处于高电势的一极,可以由电极本身或由外加的物质得到电子.
1.2 为什么外电路中电流由正极流向负极?如何定义正极与负极?
物理学家在研究电流的初始阶段时,无法确认电路中的电流是由正电荷还是负电荷的移动产生的,所以当时规定:正电荷定向移动的方向为电流方向,负电荷向某一方向定向移动等效于正电荷向相反方向定向移动,所以负电荷定向移动的方向和电流方向相反.同时,物理学家还规定:外电路中,电流由正极流向负极.电子带负电,在定向移动的过程中,产生的电流的方向和电子移动的方向相反.如图1所示,若M为失去电子的一极,电子由M极定向移动至N,则电流方向为N极流向M极.物理学上还规定,在电源外部,电流的方向是从电源的正极流向负极的.出于这两项规定,可知真正决定电极是正还是负的关键因素,是电子定向移动的方向.通过找到自发的氧化还原反应中的还原剂,分析出电子移动的方向,可推出外电路中电流的方向,再由物理学上的规定来确定正极与负极.这样的分析方法,不仅适用常见的以金属作为电极的原电池,同样使用于其他以氧化还原反应为基础的原电池.
1.3 负极带什么电?正极带什么电?电解质中阴阳离子的移动方向以及产生的电流方向如何?
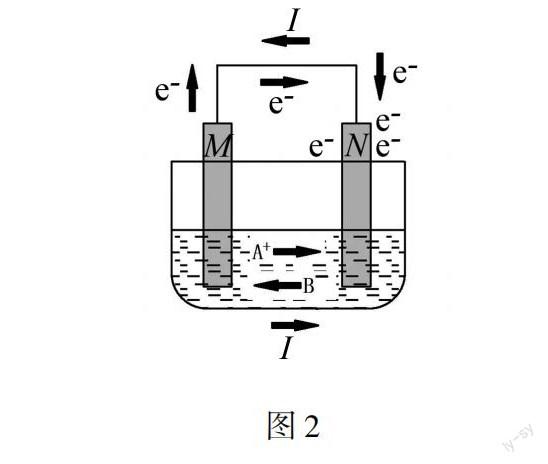
原电池工作过程中,由于负极的电子转移至正极,使得负极带正电,正极带负电.因为同性相斥,异性相吸的电学特性,电解质中带正电的阳离子受到负极区的排斥以及正极区的吸引,由负极向正极移动,所以在电解池中产生由负极流向正极的电流;电解质中带负电的阴离子受到正极区的排斥以及负极区的吸引,在电解池中产生由正极流向负极的电流.这样一来,电解质溶液中形成的电流,与外电路中的电流形成闭合回路(如图2所示).
2 “原电池”例题解析
2.1 经典铜锌双液原电池
例1
关于如图3所示的双液原电池,下列说法不正确的是().
A.电子从锌电极通过电流表流向铜电极
B.铜电极发生还原反应,其电极反应是
Cu2++2e-=====Cu
C.盐桥中阳离子向硫酸铜溶液中迁移
D.电流从锌电极通过电流表流向铜电极,锌电极作正极,铜电极作负极.
解析 A.该原电池中可能发生的自发的氧化还原反应为锌与硫酸铜的反应,锌提供电子,电子流经导线与电流表,再由铜电极附近的溶液中的铜离子得到电子,故A选项正确;
B.原电池放电时,铜离子得电子发生还原反应在铜极上析出,电极反应式为:Cu2++2e-====Cu,故B选项正确;
C.原电池放电时,电子由锌片转移至铜电极区域,使得铜电极区域带负电,根据同性相斥,异性相吸的电学基本原则,带正电荷的阳离子向铜电极区域中的硫酸铜溶液中迁移,故C选项正确;
D.电子从锌电极通过电流表流向铜电极,负电荷移动的方向与电流方向相反,故产生的电流从铜电极通过电流表流向锌电极,物理学上规定,外电路中,电流由正极流出,流入负极,铜应作正极,锌作负极,故D选项错误.
答案选D.
2.2 经典燃料电池
例2某种氢氧燃料电池的内部结构如图4所示,下列有关该装置的说法不正确的是().
A.工作时,电子由电极a通过导线流向电极b
B.电极a为电池的负极
C.电极b上发生的反应为
O2-4e-+4H+====2H2O
D.工作时,电流由电极b流向电极a
解析该装置为氢氧燃料电池,工作过程中,自发的氧化还原反应为2H2+O2===2H2O,由氢分子在电极a处提供电子,电子流经导线后,氧分子在电极b处得到电子,可知电流由电极b流出,通过导线由电极a流入,电极b作正极,电极a作负极.结合原电池原理作答.
A.电极a氢分子提供电子,电极b氧分子得到电子,工作时电子由电极a通过导线流向电极b,A项正确;
B.电极a为电池的负极,物理学上规定,外电路中,电流由b极流出,通过导线由电极a流入,电极b作正极,电极a作负极.B项正确;
C.电极b为正极,应得到电子,电极b上发生的反应为O2+4e-+4H+===2H2O,C项错误;
D.电子由电极a流向电极b,负电荷移动的方向和电流方向相反,故电流由电极b流向电极a,D项正确.
答案选C.
2.3 新型电池
例3某種利用垃圾渗透液实现发电的装置原理如图5所示.当该装置工作时,下列说法不正确的是( ).
A.电子由电极X通过导线流向电极Y
B.外电路中电流由电极Y流向电极X
C.电极X作正极,发生还原反应
D.盐桥中的Cl-向电极X移动
解析该原电池为不涉及金属元素的新型电池,由图可知,电极X区域氮元素由-3价变为0价,价态升高失电子,电极Y区域氮元素由+5价变为0价,价态降低得到电子,电子由X流向Y,电流由Y流向X,根据物理学上的规定,电极X为负极,电极Y极为正极.
A.电子由电极X通过导线流向电极Y,A正确;
B.外电路中电流由电极Y流向电极X,B正确;
C.电池工作时,电流由电极Y沿导线流向电极X,根据物理学上的规定,电极X作负极,氨分子失去电子,发生氧化反应,故C错误;
D.电子流出电极X,电极X带正电,Cl-带负电,根据异性相吸的电学基本性质,Cl-向电极X移动,D正确.
答案选C.
2.4 浓差电池
例4某实验小组设计了如图6所示装置,可观察到与铜导线连接的灵敏电流计指针明显偏转,烧杯a中裸露线头周边溶液蓝色逐渐加深,下列说法错误的是().
A.b中导线与硫酸铜浓溶液构成正极区,发生还原反应
B.若a中滴加几滴稀NaOH溶液,降低溶液中Cu2+浓度,则有利于电极反应进行
C.当两侧溶液中Cu2+浓度相等时,灵敏电流计指针停止偏转
D.盐桥中的阴离子向烧杯b移动
解析该电池为不依赖氧化还原反应的浓度差电池,题目中给出关键条件为a中裸露线头周边溶液蓝色逐渐加深,说明a中发生的变化为:Cu-2e-Cu2+,电子由a通过导线流向b,电流由b流向a,根据规定,b为正极,a为负极.
A.电子由a通过导线流向b,根据规定,b为正极,b处的硫酸铜浓溶液中的铜离子获得电子,发生还原反应,A选项正确;
B.向a中滴加稀NaOH溶液,增加了两个烧杯中硫酸铜的浓度差,有利于电极反应的进行,B选项正确;
C.当两侧溶液中Cu2+浓度相等时,电子不再发生转移,便不会产生电流,C选项正确;
D.电极b获得电子,带负电,盐桥中的阳离子向烧杯b移动,阴离子向烧杯a移动,D选项错误.
答案选D.
参考文献:
[1]包琴.高中物理与化学学科交叉内容的教学设计研究[D].兰州:西北师范大学,2021.
[2]徐敏,张建文.深入原电池原理本质 促进学生观念和能力的发展[J].化学教育,2015(9):27-31.
[3]张玲,陈磊磊.有关原电池的概念及原理[J].化学教学,2010(4):1-4.
[责任编辑:季春阳]

