静电纺丝控释材料的最新研究进展
刘芮铭,张金珊,田强运,林謦怡,张正健
静电纺丝控释材料的最新研究进展
刘芮铭,张金珊,田强运,林謦怡,张正健
(天津科技大学 轻工学院,天津 300457)
综述静电纺丝的发展和原理,控释材料和控释体系,以及静电纺丝控释材料(Electrospinning controlled-release material,ECM)在药物缓释和抗菌方面的应用,旨在为ECM的相关研究提供理论参考和研究思路。通过对国内外研究成果的分析和总结,介绍ECM通过环境pH调节、羧基修饰纳米纤维、光响应、纳米纤维膜厚度、纤维表面孔隙等因素进行控制释放的应用。分析表明,ECM可以应用于药物缓释和抗菌方面,可以实现药物在特定条件下的响应和释放,让药物有合适的释放周期。此外,还可以对各类抗菌剂实现控释,达到长效杀菌、延长货架期的目的。研究ECM(药物缓释用),能够实现药物的可控释放,保证药效的持久性,提升治疗效果。研究ECM(缓释抗菌用)可以获得更长效的抗菌效果,提高食品和药品的卫生安全性。ECM在药物缓释和抗菌方面具有很大的发展前景。
静电纺丝;控释;药物缓释;抗菌
材料的可控释放是当今世界的一个热点技术,根据活性物质的控释机理,可将控制释放系统分为扩散型控释体系、化学反应型控释体系和溶剂活化型控释体系。通过对活性物质的可控释放,可以实现药物的触发释放和缓释作用,达到长效抗菌和延长食品货架期的目的。纳米纤维具有质轻、孔隙率大、比表面积高、力学性能好等优点,常被应用于控释材料领域。静电纺丝技术作为一种生产纳米纤维的有效方式,具有适用性广、生产装置简便、运行条件温和、无污染等优势[1]。相较于其他方式制备的纳米纤维,静电纺丝纳米纤维的尺寸容易被控制[2-3]、表面易功能化[4](如表面涂覆、表面改性)、结构可调控,因此利用静电纺丝制备纳米控释材料正广泛应用于药物缓释和抗菌领域。
1 静电纺丝技术及其原理
1.1 静电纺丝的发展
静电纺丝[5]最早可追溯到17世纪的英国,Gilbert观察到当一块干燥的带电琥珀片靠近液滴时[6],此液滴会逐渐从球状变为锥状[7],并从其尖部不断喷射液滴。19世纪80年代,Rayleigh将此现象理论化,推导出在液滴形成规则锥状射流时的临界电压公式。20世纪30年代初到20世纪中期,Formhals通过申报一系列与静电纺丝有关的科技发明专利,促进了这一技术的蓬勃发展。20世纪以来,科学界不断开展对纳米纤维的研究,在科学家们的努力推动下,出现了多种纳米纤维[8]制备技术,如:机械研磨、溶液吹制、离心纺丝、模板合成、冷冻干燥、静电纺丝等。其中,利用静电纺丝制备纳米纤维的方法脱颖而出,具有成本低廉、技术简单、纤维形态可调等优势。
1.2 静电纺丝的原理
将聚合物溶液放入注射器里,并将高压输电线与注射器喷嘴连接[9],当电荷力超过液滴表层作用力时,液滴会呈锥状喷射,聚合物溶液的状态也在此刻发生转变。此时,在针尖处出现了49.3°的泰勒锥[10],并在采收器上不断固化收集,从而产生了纳米纤维结构。通过调整收集器的形状,能够制备特定形状结构的纳米纤维膜[11]。纳米纤维的定位及排列方式也可通过改变接收装置的转速来实现。通过静电纺丝制备的纳米纤维状态与聚合物溶液本身的性质有关,如电导率[12-13]、黏度[14]、导热性[15]、表面张力[16]、进料量、电压、纺丝温湿度[17-18]、喷嘴与接收装置之间的距离、聚合物溶液通过针尖时的流速[19]等因素。一般制备纳米纤维的聚合物溶液中可能出现溶剂含量和黏度过高或过低等问题,易使纤维分子间的缠结断裂,从而影响纤维的状态和形貌,导致无法产生连续的纤维。由此可见,选用合适的聚合物溶液进行静电纺丝,才能得到想要的高品质纤维。
静电纺丝能够生产纳米级的纤维材料。从广义上来讲,人们可把拥有一定长径比且尺寸为纳米级的一维线性材料认定为纳米纤维。从狭义的概念而言,只有长度在1~100 nm之间的纤维材料才能够称为纳米纤维。由此可见,纳米纤维的定义在不同领域也有着细微区别。由于纳米纤维具有尺寸小、比表面积大的特点,使其在生物医疗[20]、电子电工、过滤及防护等领域有着很大的发展潜力。
采用静电纺丝生产纳米纤维所使用的基本装置包括高压电源、喷射装置和纤维接收装置等部分[21],如图1所示。静电纺丝的变量因素主要包括聚合溶液自身的物理化学特点(如黏度、浓度、电导率、表面张力等)、电场力、喷射速率、针头直径和长度、针头外形、回收设备状况差异、周围环境基本参数(如气温、湿度等)。静电纺丝技术的类型包括同轴静电纺丝、共混静电纺丝、乳液和熔融静电纺丝等形式。其中,乳液静电纺丝法[22]是静电纺丝工艺中被广泛使用的一种技术。在高压静电的作用下,乳液液滴受到库仑斥力和静电力的膨胀作用,以及表面张力和黏弹性力的收缩作用,使其在纳米纤维的轴向同时被压缩和拉伸成椭圆形,通过收集器上溶剂的快速蒸发,得到了具有特定形貌结构的纤维。

图1 静电纺丝设备示意图
2 控释材料及控释体系
控释材料指对活性物质(Active Matter,AM)具有控制释放功能的材料。控制释放体系指在预期的时间内控制AM的释放速率,使之在一定体系内保持特定的有效含量,并在一定时间内以一定速度释放到环境中的技术。常见的控制释放系统可分为扩散型控释体系、化学反应型控释体系和溶剂活化型控释体系3类,如图2所示。
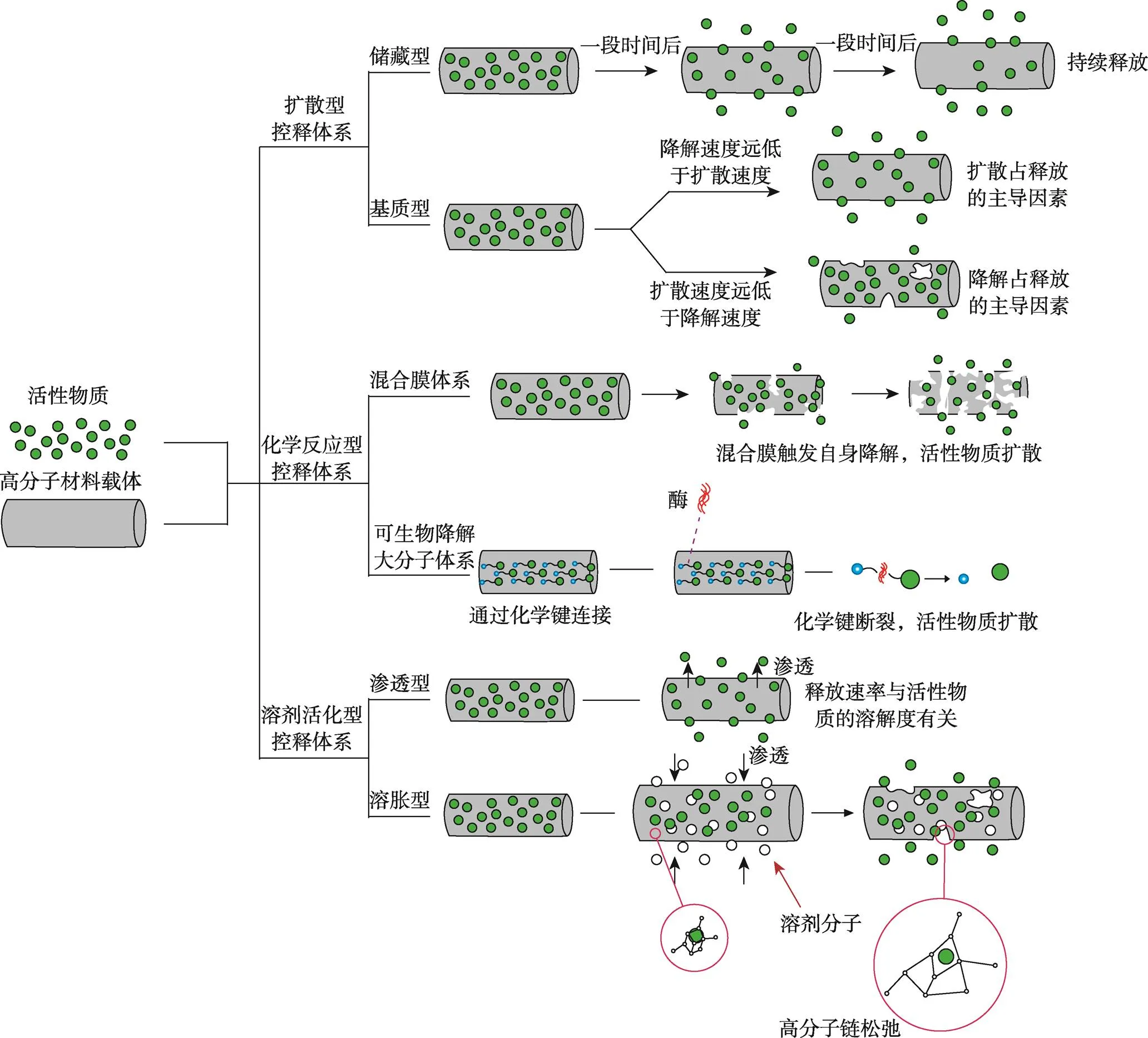
图2 控释体系分类示意图
扩散型控释体系可分为储藏型和基质型。储藏型控释体系指储存在高分子载体内的AM通过向外扩散而释放到周围环境中,且随着时间的改变呈恒速释放状态。在基质型释放体系中,AM以溶解或扩散的方式与高分子载体结合。AM的释放速率既受其在体系中溶解度的制约,也受到高分子载体降解速率的制约。如果降解速率远远小于扩散速率,则扩散成为AM释放的限制因子。相反,如果AM在载体中的移动受限,则降解成为释放的最大限制因子[23]。
化学反应型控释体系包括混合膜体系和可生物降解大分子体系2种。在混合膜体系中,AM分散在载体材料中,其活动受到混合膜的限制,只有在外部高分子混合膜材料进行pH响应或光响应触发自身降解后,AM才能从载体中释放出来。在可生物降解大分子体系中,由于AM与高分子载体及AM分子之间都通过化学键的方式连接,因此AM的释放作用通常需要借助水解或酵解过程来完成。
溶剂活化型控释体系利用高分子载体的渗透和溶胀机理来控制AM以特定速率释放。前者主要运用半透膜的调节渗透压机理,AM的释放速率与AM的溶解度有关;后者利用高分子物质的溶胀性来调节AM的释放速率。最初被溶解或分散在高分子载体中的AM并不扩散,但当溶剂渗透到高分子载体内引起溶胀时,高分子链松弛,AM才在高分子载体中扩散,进而释放出去。由此可见,选用AM控制释放体系的载体也有特定要求,即具有溶胀性,如乙烯−醋酸乙烯共聚物、聚乙烯醇等。
3 静电纺丝与控释材料
控释是一种零级反应,反应速率与反应物浓度的零次方成正比(即与反应物浓度无关)。静电纺丝技术可以解决药物溶解度有限的问题[24],保护生物分子不受有害环境的影响,并且其制备的超高孔隙率和超高比表面积的纳米纤维,使得包埋的药物或抗菌材料具有一定释放动力学规律,以及加载各种药物和抗菌物质的可能性[25]。由此,静电纺丝控释材料(Electrospinning controlled-release material,ECM)成为药物缓释领域和抗菌领域研究的热点。
3.1 静电纺丝控释材料在药物缓释方面的应用
由于静电纺丝可以针对纳米纤维的孔隙率、孔隙尺寸等进行灵活控制,同时可以根据不同需求在溶液中加入不同的药物活性物质,因此静电纺丝控释材料在药物缓释方面具有广阔的应用前景。
Federico等[26]研制了一种pH和氧化还原双触发阿霉素释放的控释静电纺丝膜。静电纺丝载药程序如图3所示,首先,合成了硫辛酰−腙−阿霉素(LA−Hy− Doxo)衍生物[27];然后通过三(2−羧乙基)膦(TCEP)介导的还原,再经过硫醇−二硫化物交换反应后,该分子被稳定储存在具有氧化还原控释作用的聚氨酯脲(PolyCEGS)静电纺丝膜上。通过对体外药物释放和细胞毒性的研究发现,LA−Hy−Doxo静电纺丝膜显示出由pH<7和还原条件触发的双重控制释放,并且在人乳腺癌细胞系(MCF−7)中产生了显著的细胞毒性作用,证明该载药程序可以用于术后实体瘤的治疗。
Hawkins等[28]制备了一种能够通过表面润湿性来改变药物释放速率的纳米纤维材料,见图4。该研究使用聚环氧乙烷(PEO)、乙基纤维素(EC)和水溶性较差的布洛芬(IBP)进行共混静电纺丝,将IBP包埋在纳米纤维中。PEO具有吸水性,EC具有疏水性,使用不同配比的PEO和EC进行共混静电纺丝,可调控纳米纤维的润湿和吸水性能,从而实现药物的可控释放。体外释放实验结果表明,润湿性和吸水率对IBP的释放速率确有控制效果,可用于一些水溶性差的小分子材料的局部释放。
李胜等[29]通过静电纺丝法制得了一类可以通过基因修饰或pH调控进行控释的纳米纤维材料。首先按照之前的文献报道进行NaYF4:Yb3+Tm3+@SiO2微米棒的制备[30],再通过静电纺丝制备无机NaYF4:Yb3+Tm3+@SiO2纳米纤维,并对其进行预处理和再氧化。然后对无机纳米纤维先后进行氨基修饰和羧基修饰,最后进行离心收集、乙醇洗涤和真空干燥。此时,无机纤维已具备控释能力。研究结果显示,羧基修饰纳米纤维能够调控药物的释放速率。此外,pH的变化也会影响药物的释放速率,从而达到控释的目的。此技术在其他羧基修饰载体及含有氨基的药品上也具有发展前景。
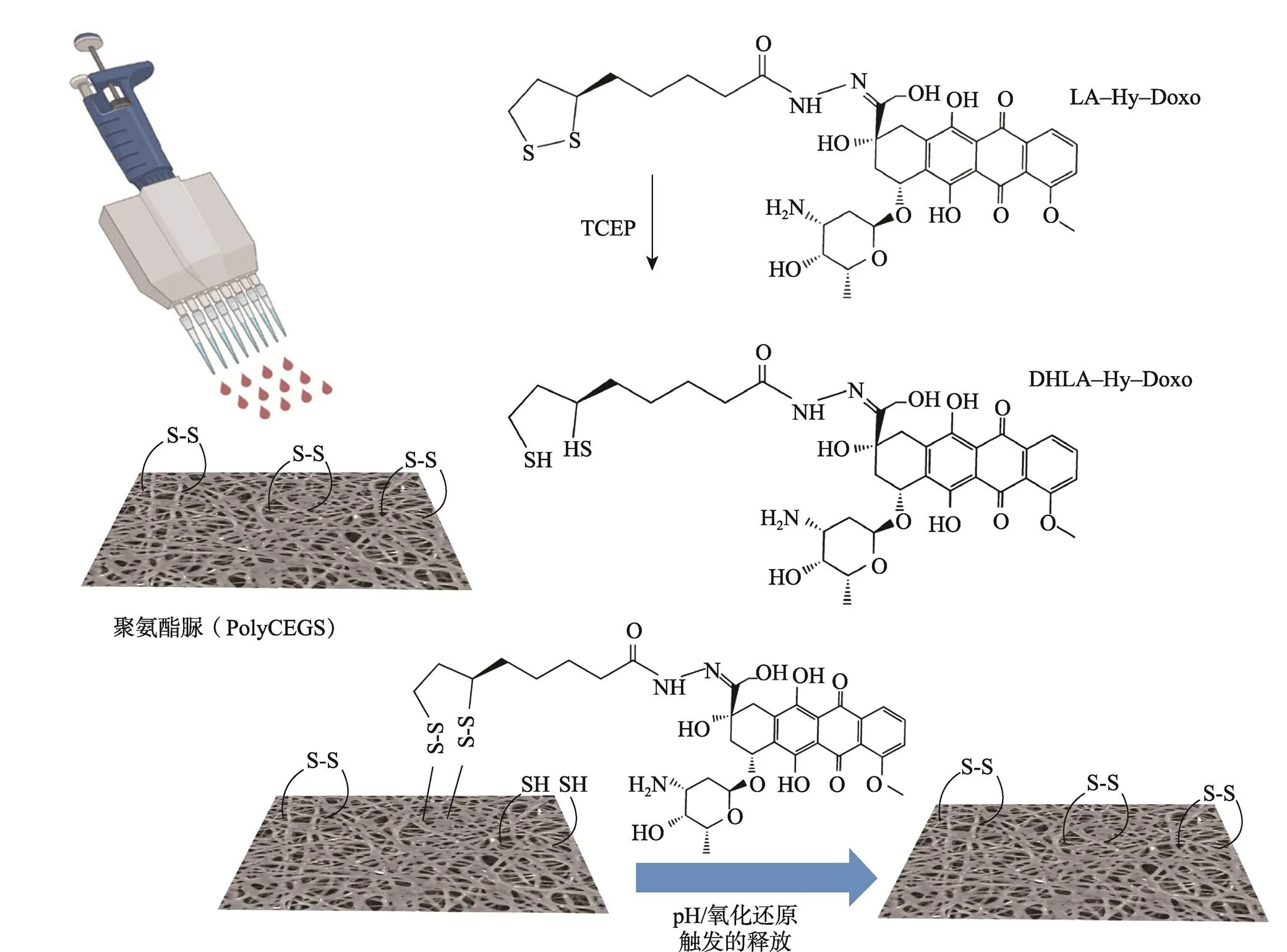
图3 载药程序示意图

图4 IBP控释原理
Balogh等[31]首次采用静电纺丝和熔融挤压法制备了一种pH控释螺内酯(SPIR)的新型阴离子甲基丙烯酸酯三元共聚物(Eudragit®FS,EudFS)。在pH值为0~7时,新型聚合物基本不溶,药物在静电纺丝纤维和研磨的挤出物中均受到限制。如图5所示,该药物在pH值上升到7.4后快速释放。这种控制药物在特定场所释放的能力使经静电纺丝或熔融挤压处理的EudFS在口服药物传递应用上很有前途,特别是针对结肠。
Fazli-Abukheyli等[32]为了控制纳米多孔阳极氧化铝(NAA)中药物的释放,提出了一种新的方法和分析模型,即将NAA包埋在含聚偏氟乙烯/聚乙二醇(PVDF/PEG)的纳米纤维中。其中,PEG的作用是改善PVDF固有的疏水性,纳米纤维的疏水性随着PEG浓度的增加而增强。利用纳米纤维的膜厚和疏水性能来控制NAA中药物的释放确有效果,如图6所示。该研究利用NAA吸收吲哚−3−乙酸(IAA)作为药物释放模型。随着静电纺丝层厚度的增加,零级释放的速度降低,但由于PEG浓度不断提高,释放速度呈现相反的变化趋势。其原因在于PEG含量的增加改善了纤维的均匀性和规则性,减少了珠状纤维的产生,使纤维孔隙率增加,药物分子与纳米纤维表面之间的相互作用变强。综上可知,药物的释放速率与纳米纤维膜的厚度和疏水性有着密切的关系。此外,还比较了静电纺丝涂层对NAA样品释放特性的影响,发现IAA的释放曲线明显改变。静电纺丝涂层可显著降低纳米孔结构的爆释,控制其释放时间。
Cestari等[33]在静电纺丝技术的加持下,将丝素蛋白(SF)、硫酸软骨素(CS)和磺胺嘧啶银(SSD)等成分包埋在纳米纤维中,最终生产出能够控制并降低伤口感染的新型敷料,如图7所示。该研究首先将聚环氧乙烷(PEO)添加到用于静电纺丝的酸性水溶液中,以提高其静电纺丝性。然后采用无水乙醇洗涤制备好的电纺纤维,将PEO从纳米纤维表面去除。X射线能谱仪分析结果表明,该洗涤过程不会去除纳米纤维中的CS和SSD。通过纳米纤维表面Ag+离子的定量分析可知,CS对剩余的SSD有较大的影响。通过FTIR−ATR和DSC分析证实,纳米纤维中CS与Ag+之间及CS与SSD之间均存在相互作用,且形成了聚电解质复合物,因而SSD在CS的存在下表现出更好的分散性,这有利于SSD在纳米纤维中的持久性,对药物的缓释有积极影响。通过对大鼠进行实验,结果表明,相较于普通SSD乳膏,新型辅料仅对实验对象应用一次便可痊愈,证明药物缓释的持久性,以及释放过程中有效药物的吸收率都得到增加,避免了换药时的不适和疼痛。综上可知,CS对SSD能起到一定的控释作用。
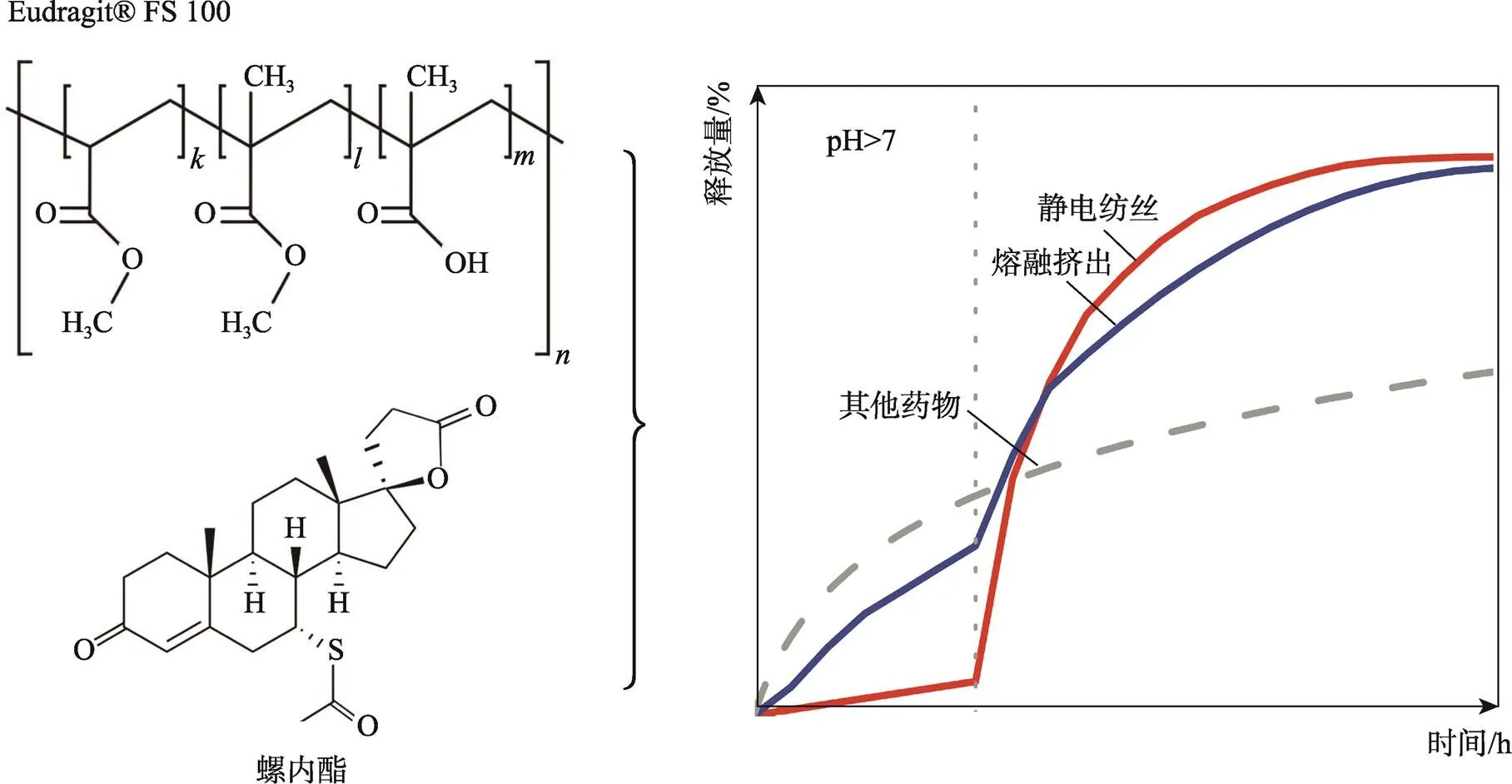
图5 SPIR和EudFS进行电纺和熔融挤压的药物释放趋势示意图

图6 IAA的释放趋势对比

图7 含有磺胺嘧啶银和硫酸软骨素的新型敷料制备及应用
3.2 静电纺丝控释材料在抗菌方面的应用
具有高孔隙率、高比表面积的静电纺丝纳米纤维,除了在生物医疗方面应用广泛,也同样适用于包裹对环境变化敏感的无机抗菌剂和有机抗菌剂,制备出抗菌材料。经由静电纺丝技术制备的抗菌膜对于抑制有害菌落的生长具有显著效果。
采用高分子聚合物和抗菌剂为原料,经静电纺丝可制备抗菌纤维[34]。其中,抗菌剂主要包括无机抗菌剂和有机抗菌剂。无机抗菌制剂主要有Ag基、TiO2基和ZnO基等,有机抗菌制剂主要有抗细菌肽类、溶菌酶、乳酸链球菌素、ε−聚赖氨酸和天然植物精油抗菌剂。
3.2.1 无机抗菌剂的可控释放
静电纺丝制备的纳米纤维相较于其他抗菌材料,具有纳米颗粒负载能力高[35]、释放可调等优点,实现了更高效的Ag+或纳米银颗粒释放。此外,纳米纤维是抗生素和其他抗菌材料可控递送的潜在载体系统,其控释作用可降低Ag+剂量过高带来的全身毒性风险,提高局部抗菌活性[36-37]。
丝素蛋白[38]作为一种天然的生物材料,其独特的生物相容性、通透性、生物降解性、最小的炎症反应性等性能远超大部分有机或无机材料。Calamak等[39]利用甲酸溶解冻干的蚕丝蛋白,加入AgNO3溶液,并配制成静电纺丝液进行静电纺丝。随后通过戊二醛蒸气和甲醇对复合纤维进行处理,制备了无规则卷曲(Silk Ⅰ)和β−折叠(Silk Ⅱ)2种形态的负载Ag+的丝素蛋白复合纳米纤维,研究了不同的丝素形态对Ag+释放速率的影响。在采用戊二醛蒸气和甲醇处理的纤维中均观察到典型的两步释放,最初的快速释放是因扩散,而第2步释放则是因装载物的扩散和降解。针对不同丝素蛋白结构下的Ag+释放曲线进行分析发现,在Silk Ⅱ结构下,经甲醇处理的纤维(Ag/Fib−M)中Ag+的累积释放量低于经戊二醛处理的纤维(Ag/Fib−G)中Ag+的累积释放量。在对甲醇处理的纤维(Ag/Fib−M)进行研究分析可知,由于结晶结构的影响导致Ag+的缓慢释放,既降低了分子流动性,又降低了装载物的扩散率和溶解速度。研究表明,Ag+的释放与聚合物的结构相关,丝素蛋白的形态对纳米纤维上的Ag+有控释作用。
Mahdieh等[40]制备了一种基于银纳米粒子(Ag NPs)尺寸进行控释的核−壳式静电纺丝纤维。纤维壳由聚己内酯(PCL)、聚乙二醇(PEG)和氧化锌纳米粒子(ZnO NPs)组成。Ag NPs作为纤维芯,被包埋在纤维壳中。其中,Ag NPs是主要的抗菌剂,ZnO NPs除了起到协同抗菌剂的作用外,还用于改善孔隙结构,形成连接到核心的深孔。通过在同轴静电纺丝纤维芯内装入不同尺寸的Ag NPs来微调其传递速率。该研究表明,利用大小不同的Ag NPs可以实现药物的快、中、慢3种速率给药,如图8所示。此外,研究发现,使用ZnO NPs不仅能够保持纤维的机械稳定性,还可以避免突然失控释放情况的发生[41]。

1. Ag NPs释放速度快;2. Ag NPs释放速度适中;3. Ag NPs释放速度慢。
光激发智能纳米材料是控制物质在不同环境中释放的新技术之一。Ballesteros等[42]通过静电纺丝法制备了一种以可降解且生物相容性良好的聚己内酯(PCL)纳米纤维垫为载体的智能纳米材料。该垫具有光激发控释的纳米凝胶和银纳米粒子(Ag NPs),如图9所示。当受到405 nm的光辐射后,Ag NPs从纳米凝胶中释放出来,并迅速扩散至整个纳米纤维毡中。这种光激发了Ag NPs的等离子带,打破了纳米凝胶,从而释放出纳米纤维上的Ag NPs,因此这种具有光激发抑菌效果的控释材料可被用作临床应用的光激活创面材料。

图9 Ag NPs光激发释放原理
Wei等[43]借助静电纺制备了可以控制单分散银纳米粒子释放的抗菌纳米纤维垫,如图10所示。使用戊二醛作为交联剂,通过一锅法对掺杂单分散银纳米粒子(Ag NPs)的聚乙烯醇(PVA)电纺纳米纤维进行原位改性。通过控制戊二醛的加入量调控交联度,从而获得纳米纤维垫。研究表明,这种交联可以有效地控制嵌入纤维垫中的Ag向周围水溶液释放的速率和总量。此外,由于受到反应期间形成缩醛基团的影响,这种释放行为在一定程度上也会受释放环境pH值的影响。综上可知,该可控释放抗菌纳米纤维垫具有良好的抗菌功效。
3.2.2 有机抗菌剂的可控释放
Min等[44]利用聚乙烯醇/聚乙二醇(PVA/PEG)共混物进行静电纺丝,将百里香精油(TEO)包埋在多孔聚乳酸(PLA)纳米纤维中,以实现TEO的湿控释放。在相对湿度为20%、50%、80%条件下,对百里香精油的累积释放行为进行了研究。如图11所示,百里香精油从多孔聚乳酸纳米纤维中快速释放,在2 d后的累积释放量大于99%。与PLA/TEO纳米纤维相比,PLA/TEO/PVA/PEG复合膜的百里香精油释放速度较慢。在5 d后PLA/TEO/PVA/PEG复合膜的TEO累积释放量分别为(99.87±1.00)%(相对湿度80%)、(68.16±2.16)%(相对湿度50%)、(36.05±1.83)%(相对湿度20%)。研究结果还表明,随着湿度的增加,聚合物材料膨胀,透气性增强,扩散速率增大,因此可以通过调节一定范围内的湿度来控制TEO的释放速率。
Bugatti等[45]以聚酰胺11(PA11)和填充了溶菌酶(质量分数为50%)的埃洛石纳米管(HNTs)为原料,采用静电纺丝技术,通过改变溶菌酶的负载量制备了一种控释抗菌材料。采用紫外分光光度法测定溶菌酶的控释量,结果表明,此种方法制备的控释抗菌材料其释放动力学与HNTs−溶菌酶负载量有关。经FTIR分析可知,酰胺Ⅰ的N−H拉伸发生了位移,表明PA11与溶菌酶分子之间存在良好的相互作用。由于HNTs的增强作用,材料的弹性模量随着填充量的增加而增加。复合材料膜的释放动力学依赖于载体的负载量,并与改进的Gallagher−Corrigan模型很好地吻合,表明改变填料负载量是可控释放的重要因素。该可控释抗菌膜可用作鸡肉储藏的抗菌垫。

图10 Ag NPs抗菌纳米纤维垫制备原理

图11 复合膜制备原理
Scaffaro等[46]结合静电纺丝技术和溶液浇铸,获得了一种可调节控制释放香芹酚的PLA基功能梯度层压板,如图12所示。通过直接在致密的基板上进行静电纺丝,获得了双层和三层功能梯度层压板。底层为由聚乳酸(PLA)和香芹酚浇铸形成的多层结构致密层,另外1层或2层是仅由PLA进行静电纺丝制备的纤维皮层。研究发现,纤维皮层的存在能够有效解决浸泡早期的爆裂释放问题,并将此类装置的释放活性寿命延长至800 h,说明纤维层厚度和释放动力学之间存在相关性。
Zahabi等[47]从大麦中提取了大麦醇溶蛋白和谷蛋白,并将具有不同负载浓度(体积分数2%~4%)的橄榄精油(ODEO)掺入蛋白质混合物中进行静电纺丝,制备了具有食品级抑菌效果的纳米纤维,如图13所示。研究发现,不同浓度ODEO掺杂的蛋白质混合物,可纺出孔径不同的纳米纤维,纳米纤维的孔隙直径对内部精油起到了控释作用。当ODEO的体积分数为3%时,蛋白质悬浮液不仅可以形成孔隙合适、控释效果好的无珠纤维,而且具有很高的抗氧化和抗菌活性[48]。研究发现,当谷蛋白−大麦醇溶蛋白的质量比为25∶75,电压为15 kV,针与收集器之间的距离为150 mm,喷射流速为1 mL/h时,所制材料的综合性能最佳。这种通过纤维孔隙控释的电纺纳米纤维有望用于活性食品包装[49]。
Dai等[50]研究并设计制备了一款负载有百里酚/β−环糊精的功能化纳米纤维(THY/β−CD−IC−NFs)。通过对酪蛋白和聚环氧乙烷的混合物进行电纺,得到了利用酪蛋白对细菌蛋白酶水解的响应来触发释放的新型控释抗菌材料,实现了百里酚的可控释放。研究结果表明,所制纳米纤维具有长期的抗菌活性,能够使冷藏牛肉保鲜7 d。该研究成果为肉类保鲜提供了一种可行方案。
柠檬精油(LEO)是一种天然抑菌剂,对各种微生物和细菌具有极好的抑制作用。蛭石(VML)具有丰富的多孔结构、比表面积大、吸附能力良好、分散性良好、很高的承载能力等优点。Li等[51]首先对魔芋葡甘聚糖(KGM)和聚丙烯酸(PAA)接枝共聚,并将其与聚乙烯醇(PVA)偶联,以提高其电纺性;然后采用稳定的多孔VML吸收LEO,形成LEO/VML复合物;最后采用静电纺丝技术,制备了含有LEO/VML复合物的KGM−g−PAA/PVA抑菌吸水垫,如图14所示。通过将LEO加载到多孔层状VML中,可以很好地控制KGM−g−PAA/PVA垫中LEO的挥发性释放,从而解决了包装材料中LEO释放难以持续控制和KGM−g−PAA可纺性差等问题。多孔层状VML携带的LEO可以同时提高LEO的热稳定性,降低LEO的释放损失,实现LEO的持续控释。此外,KGM−g−PAA / PVA抑菌吸水垫具有抑菌和吸水双重功能,可有效延长冷鲜猪肉的货架期。

图12 可调节控制释放香芹酚的PLA基功能梯度层压板制备示意图

图13 ODEO控释纳米纤维膜的制备示意图

图14 控释抑菌吸水垫的原理
Hoseyni等[52]利用静电纺丝工艺将儿茶素包封在Azivash gum−PVA的聚合物基质中,制备了一种用于食品和药品抗菌抗氧化的纳米纤维膜,如图15所示。儿茶素是一类天然的具有抗菌抗氧化性的可食性有机物。该研究发现,增加儿茶素的质量浓度(500~1 000 mg/L),封装效率降低,但负载能力增加,且增加儿茶素还能提高生成纳米纤维的热稳定性。儿茶素的添加量与纳米纤维直径之间呈线性相关。根据ATR−FTIR光谱分析可知,将儿茶素负载到纳米纤维中,会引起儿茶素与聚合物溶液之间发生相互作用,从而提高纳米纤维的热稳定性。最终根据儿茶素的释放趋势可以看出,在模拟胃液中儿茶素的释放量大约为50%,在模拟肠液中儿茶素的释放量不超过70%。此外,分别在模拟的低脂和高脂食品培养基中观察到纳米纤维中儿茶素的释放速率不同。研究发现,儿茶素对纳米纤维在低脂高脂的环境下均有控释效果,设计的纳米纤维可应用于活性包装[53],可以提高食品和药品的氧化稳定性。

图15 用于儿茶素控释的纳米纤维膜制备原理
4 结语
静电纺丝技术已成为一种主流且较为成熟的制备优质纤维的技术手段,其制备的静电纺丝控释材料(ECM)具有高孔隙率和良好的生物相容性。在药物缓释方面,静电纺丝所制控释材料,能够实现不同条件下药物的可控释放,如pH调控释放、表面化学修饰控释、结构孔隙调控释放等。在抗菌材料方面,静电纺丝技术可以优化抗菌材料的性能,控制无机和有机抗菌材料的释放速率,实现长效杀菌,并延长包装食品的货架期。由此可见,ECM在医疗和包装等领域都有很大的发展和应用前景,未来在人造血管组织、人造皮肤、病原体定位、医用敷料、食品防腐、果蔬保鲜等方面的研究中具有重要的理论意义和实际应用价值。
[1] ZHANG Xing-shuang, XIE Lei, WANG Xun-gai, et al. Electrospinning Super-Assembly of Ultrathin Fibers from Single- to Multi-Taylor Cone Sites[J]. Applied Materials Today, 2022, 26: 101272.
[2] CHENG Ting-ting, LI Si-qi, XU Lan, et al. Controllable Preparation and Formation Mechanism of Nanofiber Membranes with Large Pore Sizes Using a Modified Electrospinning[J]. Materials & Design, 2019, 178: 107867.
[3] XU Fei, GOUGH I, DOROGIN J, et al. Nanostructured Degradable Macroporous Hydrogel Scaffolds with Controllable Internal Morphologies via Reactive Electrospinning[J]. Acta Biomaterialia, 2020, 104: 135-146.
[4] FATHI M, AKBARI B, TAHERIAZAM A, et al. Surface Functionalization of Titania Nanotubes Arrays and Vancomycin Controlled Release Using Silk Fibroin Nanofibers Coating[J]. Journal of Drug Delivery Science and Technology, 2022, 71: 103320.
[5] WEN Peng, ZONG Min-hua, LINHARDT R J, et al. Electrospinning: A Novel Nano-Encapsulation Approach for Bioactive Compounds[J]. Trends in Food Science & Technology, 2017, 70: 56-68.
[6] SHEPA I, MUDRA E, DUSZA J. Electrospinning through the Prism of Time[J]. Materials Today Chemistry, 2021, 21: 100543.
[7] HE Ji-huan. On the Height of Taylor Cone in Electrospinning[J]. Results in Physics, 2020, 17: 103096.
[8] BARHOUM A, PAL K, RAHIER H, et al. Nanofibers as New-Generation Materials: From Spinning and Nano-Spinning Fabrication Techniques to Emerging Applications[J]. Applied Materials Today, 2019, 17: 1-35.
[9] ANGEL N, LI Song-nan, YAN Feng, et al. Recent Advances in Electrospinning of Nanofibers from Bio-Based Carbohydrate Polymers and Their Applications[J]. Trends in Food Science & Technology, 2022, 120: 308-324.
[10] LU Jia-hui, LI Yan-ying, ZHANG An-qiang, et al. Sustained Release of Ganoderma Lucidum Antitumor Drugs Using a Sandwich Structured Material Prepared by Electrospinning[J]. Journal of Drug Delivery Science and Technology, 2021, 64: 102627.
[11] ECHEVERRIA MOLINA M I, KOMVOPOULOS K. An Electrostatic Finite Element Analysis of the Electrospinning Process of Bilayer Constructs Using a Parallel-Plate Collector[J]. Materials Letters, 2022, 313: 131649.
[12] LV Xiao-hui, TANG Yuan, TIAN Qing-feng, et al. Ultra-Stretchable Membrane with High Electrical and Thermal Conductivity via Electrospinning and In-Situ Nanosilver Deposition[J]. Composites Science and Technology, 2020, 200: 108414.
[13] CHEN Jie, WANG Xiao-hui, DAO Li-ping, et al. A Conductive Bio-Hydrogel with High Conductivity and Mechanical Strength via Physical Filling of Electrospinning Polyaniline Fibers[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2022, 637: 128190.
[14] HE Hai-jun, KARA Y, MOLNÁR K. In Situ Viscosity-Controlled Electrospinning with a Low Threshold Voltage[J]. Macromolecular Materials and Engineering, 2019, 304(11): 1900349.
[15] WEI Zhou-qiao, KONG Xiang-dong, CHENG Jing-zhen, et al. Constructing a "Pearl-Necklace-Like" Architecture for Enhancing Thermal Conductivity of Composite Films by Electrospinning[J]. Composites Communications, 2022, 29: 101036.
[16] WANG Yu, WANG Chi. Extension Rate and Bending Behavior of Electrospinning Jet: The Role of Solution Conductivity[J]. Polymer, 2021, 222: 123672.
[17] RAKSA A, NUMPAISAL P O, RUKSAKULPIWAT Y. The Effect of Humidity during Electrospinning on Morphology and Mechanical Properties of SF/PVA Nanofibers[J]. Materials Today: Proceedings, 2021, 47: 3458-3461.
[18] TOPUZ F, SATILMIS B, UYAR T. Electrospinning of Uniform Nanofibers of Polymers of Intrinsic Microporosity (PIM-1): The Influence of Solution Conductivity and Relative Humidity[J]. Polymer, 2019, 178: 121610.
[19] HAIDER A, HAIDER S, KANG I K. A Comprehensive Review Summarizing the Effect of Electrospinning Parameters and Potential Applications of Nanofibers in Biomedical and Biotechnology[J]. Arabian Journal of Chemistry, 2018, 11(8): 1165-1188.
[20] DEJOB L, TOURY B, TADIER S, et al. Electrospinning ofSynthesized Silica-Based and Calcium Phosphate Bioceramics for Applications in Bone Tissue Engineering: A Review[J]. Acta Biomaterialia, 2021, 123: 123-153.
[21] JAIN R, SHETTY S, YADAV K S. Unfolding the Electrospinning Potential of Biopolymers for Preparation of Nanofibers[J]. Journal of Drug Delivery Science and Technology, 2020, 57: 101604.
[22] ZHANG Cen, FENG Feng-qin, ZHANG Hui. Emulsion Electrospinning: Fundamentals, Food Applications and Prospects[J]. Trends in Food Science & Technology, 2018, 80: 175-186.
[23] 廖玉霞, 万晨露, 余艺, 等. 介孔二氧化硅纳米材料在缓释递药系统中的研究进展[J]. 中国新药杂志, 2019, 28(7): 804-809.
LIAO Yu-xia, WAN Chen-lu, YU Yi, et al. Research Progress of Mesoporous Silica Nanomaterials in Drug Sustained Release Delivery System[J]. Chinese Journal of New Drugs, 2019, 28(7): 804-809.
[24] LURAGHI A, PERI F, MORONI L. Electrospinning for Drug Delivery Applications: A Review[J]. Journal of Controlled Release, 2021, 334: 463-484.
[25] LIU Yu-fei, YANG Long, CHEN Gui-jing, et al. PBAT Hollow Porous Microfibers Prepared via Electrospinning and Their Functionalization for Potential Peptide Release[J]. Materials & Design, 2021, 207: 109880.
[26] FEDERICO S, MARTORANA A, PITARRESI G, et al. Development of Stimulus-Sensitive Electrospun Membranes Based on Novel Biodegradable Segmented Polyurethane as Triggered Delivery System for Doxorubicin[J]. Biomaterials Advances, 2022, 136: 212769.
[27] AKASOV R, DROZDOVA M, ZAYTSEVA-ZOTOVA D, et al. Novel Doxorubicin Derivatives: Synthesis and Cytotoxicity Study in 2D and 3DModels[J]. Advanced Pharmaceutical Bulletin, 2017, 7(4): 593-601.
[28] HAWKINS B C, BURNETT E, CHOU S F. Physicomechanical Properties and in Vitro Release Behaviors of Electrospun Ibuprofen-Loaded Blend PEO/EC Fibers[J]. Materials Today Communications, 2022, 30: 103205.
[29] 李胜. 静电纺无机纳米纤维的制备及监控药物释放的研究[D]. 青岛: 青岛大学, 2019: 9-40.
LI Sheng. Study on Preparation of Electrostatic Inorganic Nanofibers and Monitoring Drug Release[D]. Qingdao: Qingdao University, 2019: 9-40.
[30] CHEN Yin, XIE Shao-wen, TONG Chao, et al. Preparation of NaYF4:Yb3+, Tm3+@NaGdF4:Ce3+, Eu3+Double-jacket Microtubes for Dual-mode Fluorescent Anti-counterfeiting[J]. Transactions of Nonferrous Metals Society of China, 2020, 30(12): 3333-3346.
[31] BALOGH A, FARKAS B, DOMOKOS A, et al. Controlled-Release Solid Dispersions of Eudragit® FS 100 and Poorly Soluble Spironolactone Prepared by Electrospinning and Melt Extrusion[J]. European Polymer Journal, 2017, 95: 406-417.
[32] FAZLI-ABUKHEYLI R, RAHIMI M R, GHAEDI M. Electrospinning Coating of Nanoporous Anodic Alumina for Controlling the Drug Release: Drug Release Study and Modeling[J]. Journal of Drug Delivery Science and Technology, 2019, 54: 101247.
[33] CESTARI M, CALDAS B S, FONSECA D P, et al. Silk Fibroin Nanofibers Containing Chondroitin Sulfate and Silver Sulfadiazine for Wound Healing Treatment[J]. Journal of Drug Delivery Science and Technology, 2022, 70: 103221.
[34] RADISAVLJEVIC A, STOJANOVIC D B, PERISIC S, et al. Cefazolin-Loaded Polycaprolactone Fibers ProducedDifferent Electrospinning Methods: Characterization, Drug Release and Antibacterial Effect[J]. European Journal of Pharmaceutical Sciences, 2018, 124: 26-36.
[35] ARUMUGAM M, MURUGESAN B, PANDIYAN N, et al. Electrospinning Cellulose Acetate/Silk Fibroin/ Au-Ag Hybrid Composite Nanofiber for Enhanced Biocidal Activity Against MCF-7 Breast Cancer Cell[J]. Materials Science and Engineering: C, 2021, 123: 112019.
[36] JIANG Chun-ji, LING Zi-yue, XU Yuan-ting, et al. Long-Term, Synergistic and High-Efficient Antibacterial Polyacrylonitrile Nanofibrous Membrane Prepared by "one-Pot" Electrospinning Process[J]. Journal of Colloid and Interface Science, 2022, 609: 718-733.
[37] CHEN Pin-hong, CHAI Mu-yuan, MAI Zhuo-xian, et al. Electrospinning Polyacrylonitrile (PAN) Based Nanofiberous Membranes Synergic with Plant Antibacterial Agent and Silver Nanoparticles (AgNPs) for Potential Wound Dressing[J]. Materials Today Communications, 2022, 31: 103336.
[38] WEI Lan-lan, ZHOU Dong-rui, KANG Xue-jun. Electrospinning as a Novel Strategy for the Encapsulation of Living Probiotics in Polyvinyl Alcohol/Silk Fibroin[J]. Innovative Food Science & Emerging Technologies, 2021, 71: 102726.
[39] CALAMAK S, AKSOY E A, ERTAS N, et al. Ag/Silk Fibroin Nanofibers: Effect of Fibroin Morphology on Ag+Release and Antibacterial Activity[J]. European Polymer Journal, 2015, 67: 99-112.
[40] MAHDIEH Z, MITRA S, HOLIAN A. Core–Shell Electrospun Fibers with an Improved Open Pore Structure for Size-Controlled Delivery of Nanoparticles[J]. ACS Applied Polymer Materials, 2020, 2(9): 4004-4015.
[41] ANDRIOLO J M, SUTTON N J, MURPHY J P, et al. Electrospun Fibers for Controlled Release of Nanoparticle-Assisted Phage Therapy Treatment of Topical Wounds[J]. MRS Advances, 2018, 3(50): 3019-3025.
[42] BALLESTEROS C A S, CORREA D S, ZUCOLOTTO V. Polycaprolactone Nanofiber Mats Decorated with Photoresponsive Nanogels and Silver Nanoparticles: Slow Release for Antibacterial Control[J]. Materials Science and Engineering: C, 2020, 107: 110334.
[43] WEI Xiao-hui, CAI Jun-jie, LIN Song, et al. Controlled Release of Monodisperse Silver Nanoparticles via in Situ Cross-Linked Polyvinyl Alcohol as Benign and Antibacterial Electrospun Nanofibers[J]. Colloids and Surfaces B: Biointerfaces, 2021, 197: 111370.
[44] MIN Tian-tian, SUN Xiao-li, YUAN Zhi-peng, et al. Novel Antimicrobial Packaging Film Based on Porous Poly(Lactic Acid) Nanofiber and Polymeric Coating for Humidity-Controlled Release of Thyme Essential Oil[J]. LWT, 2021, 135: 110034.
[45] BUGATTI V, VERTUCCIO L, VISCUSI G, et al. Antimicrobial Membranes of Bio-Based PA 11 and HNTS Filled with Lysozyme Obtained by an Electrospinning Process[J]. Nanomaterials (Basel, Switzerland), 2018, 8(3): 139.
[46] SCAFFARO R, MAIO A, GULINO E F, et al. PLA-Based Functionally Graded Laminates for Tunable Controlled Release of Carvacrol Obtained by Combining Electrospinning with Solvent Casting[J]. Reactive and Functional Polymers, 2020, 148: 104490.
[47] ZAHABI N, GOLMAKANI M T, FAZAELI M, et al. Electrospinning of Glutelin-Hordein Incorporated withEssential Oil: Characterization of Nanofibers[J]. Colloids and Surfaces B: Biointerfaces, 2021, 208: 112058.
[48] REHMAN A, TONG Qun-yi, SHARIF H R, et al. Biopolymer Based Nanoemulsion Delivery System: An Effective Approach to Boost the Antioxidant Potential of Essential Oil in Food Products[J]. Carbohydrate Polymer Technologies and Applications, 2021, 2: 100082.
[49] ALONSO-GONZÁLEZ M, CORRAL-GONZÁLEZ A, FELIX M, et al. Developing Active Poly(Vinyl Alcohol)-Based Membranes with Encapsulated Antimicrobial Enzymes via Electrospinning for Food Packaging[J]. International Journal of Biological Macromolecules, 2020, 162: 913-921.
[50] DAI Jin-ming, HU Wei, YANG Hong-ying, et al. Controlled Release and Antibacterial Properties of PEO/Casein Nanofibers Loaded with Thymol/-Cyclodextrin Inclusion Complexes in Beef Preservation[J]. Food Chemistry, 2022, 382: 132369.
[51] LI Xiang-luan, XIAO Nai-yu, XIAO Geng-sheng, et al. Lemon Essential Oil/Vermiculite Encapsulated in Electrospun Konjac Glucomannan-Grafted-Poly(Acrylic Acid)/Polyvinyl Alcohol Bacteriostatic Pad: Sustained Control Release and Its Application in Food Preservation[J]. Food Chemistry, 2021, 348: 129021.
[52] HOSEYNI S Z, JAFARI S M, SHAHIRI TABARESTANI H, et al. Release of Catechin from Azivash Gum-Polyvinyl Alcohol Electrospun Nanofibers in Simulated Food and Digestion Media[J]. Food Hydrocolloids, 2021, 112: 106366.
[53] SCHMATZ D A, COSTA J A V, DE MORAIS M G. A Novel Nanocomposite for Food Packaging Developed by Electrospinning and Electrospraying[J]. Food Packaging and Shelf Life, 2019, 20: 100314.
Recent Research Progress on Electrospinning Controlled-release Materials
LIU Rui-ming, ZHANG Jin-shan, TIAN Qiang-yun, LIN Qing-yi, ZHANG Zheng-jian
(College of Light Industry Science and Engineering, Tianjin University of Science and Technology, Tianjin 300457, China)
The work aims to review the development and principle of electrospinning, controlled-release materials and systems, as well as the application of electrospinning controlled-release materials (ECM) in drug sustained-release and antibacterial aspects to provide theoretical reference and research ideas for ECM related research. Based on the analysis and summary of the research results at home and abroad, the application of ECM to control release by environmental pH regulation, carboxyl modified nanofibers, light response, nanofiber film thickness, fiber surface pore size and other factors was introduced. The analysis showed that ECM could be used in slow release and antibacterial aspects of drugs, and could realize the response and release of drugs under specific conditions, so that drugs had a suitable release cycle. In addition, it could also control the release of all kinds of antibacterial agents to achieve long-term sterilization and prolong the shelf life. Research on ECM (for sustained release of drugs) can realize controlled release of drugs, ensure the durability of drug efficacy and improve the therapeutic effect. Research on ECM (for sustained-release antibacterial) can obtain longer antibacterial effect and improve the health and safety of food and drugs. ECM has great development prospects in drug sustained-release and antibacterial fields.
electrospinning; controlled release; sustained release; antibacterial
TB484.9
A
1001-3563(2023)03-0039-13
10.19554/j.cnki.1001-3563.2023.03.006
2022−04−05
天津科技大学大学生创新创业训练计划(202110057274)
刘芮铭(2001—),男,本科生,主要研究方向为纤维素基功能材料。
张正健(1981—),男,博士,副教授,主要研究方向为功能性印刷包装材料。
责任编辑:彭颋

