宁夏酿酒葡萄不同子产区土壤细菌群落特征对比及其影响因子分析
陈晓娟, 李 明
(1.宁夏大学农学院,宁夏银川 750021; 2.宁夏大学食品与葡萄酒学院,宁夏银川 750021;3.宁夏大学葡萄与葡萄酒研究院,宁夏银川 750021)
土壤是葡萄栽培的关键因素,提供给葡萄生长发育的必要营养条件。土壤类型、肥力、微生物、温度、水分等均能影响植株根系的生长和吸收功能。土壤微生物菌群组成及结构的变化与土壤养分含量相关[1]。 微生物群落分布也是土壤肥力状况的体现,通过制约土壤活性影响根系对养分的吸收利用[2],从而对土壤养分的有效性起间接影响作用[3]。据调查,土壤的养分状况和土壤中的微生物含量成正比关系,在做土壤检测时,通常会将微生物群落特征作为重要的评判标准[4-5]。有研究将土壤微生物区系及多样性作为生态环境质量的一个重要评价指标[6]。目前,有关土壤微生物的研究已经成为土壤学研究最活跃的领域之一。西班牙、法国、美国等已对其本土的土壤微生物做了广泛研究[7]。自然环境中仅有约1%甚至更少的微生物具有可培养性[8],利用传统技术对土壤微生物进行研究已不能满足微生物资源的开发和利用。高通量测序技术是近年来应用最普遍的新一代测序技术,具有高通量、高灵敏度和高准确性等特点[9],为全面认识土壤微生物提供了新的契机[10-11]。
贺兰山东麓地处宁夏银川平原西部边缘(37°43′~39°23′N,105°45′~106°47′E),贺兰山沿山以东涵盖了石嘴山、银川、吴忠3市,属中温带干旱气候区。贺兰山东麓凭借其优越的地理位置和气候条件,成为中国重要的葡萄酒产区,也是世界最佳酿酒葡萄生态区之一。至2020年,在贺兰山东麓形成百万亩葡萄种植长廊,大量荒漠草原开垦为葡萄种植地,地表覆被发生改变,开垦后形成的土壤的物理、化学及生物学性质也都发生了极大的变化[7]。本试验通过测定甘城子、立兰、玉泉营、天得4个酿酒葡萄子产区的代表性酒庄葡萄园土壤的理化性质,对比分析不同产区土壤的养分差异;基于Illumina Miseq高通量测序技术,分析4个子产区葡萄园土壤的微生物群落特征,揭示不同产区的细菌群落特征,以期为贺兰山东麓酿酒葡萄产区土壤微生物资源库的建设以及葡萄根际微生物资源的筛选和利用提供理论依据。
1 材料与方法
1.1 试验地概况
以贺兰山东麓的4个酿酒葡萄子产区代表性酒庄葡萄园土壤为研究对象。采样地分别为甘城子(GCZ)、立兰(LL)、玉泉营(YQY)、天得(TD)产区。甘城子产区(38°08′54″ N,105°58′37″ E),位于吴忠市青铜峡市叶甘公路与233乡道交汇处北路东,海拔1 123 m,土壤为普通灰钙土;立兰酒庄(38°27′38″ N,105°58′20″ E),位于银川市永宁县闽宁镇原隆村,海拔1 148 m,土壤为砾质灰钙土;玉泉营西夏王酒庄(38°25′59″ N,106°06′04″ E),位于银川市永宁县玉泉大街,海拔1 092 m,土壤为风沙土;红寺堡天得酒庄(37°32′09″ N,106°09′16″ E),位于吴忠市红寺堡区新庄集乡西川村,海拔1 403 m,土壤为黄绵土。
1.2 供试材料
分别采集贺兰山东麓甘城子、立兰、玉泉营、天得酿酒葡萄园这4个区域的土壤。葡萄品种为3年生赤霞珠(Cabernet sauvignon)。取样均在2020年9月进行,采集葡萄根际0~20、20~40 cm土层土壤。随机选取3棵葡萄树,每个采样点采取2组土样并做标记,采土过程避免采取石块或大块的土壤。将采取的不同土样放置冰盒低温运回实验室,采用1.00、0.25 mm孔径的筛子过筛,将筛过的土样分成2组,一组置于-20 ℃冰箱中保存,用于土壤细菌群落多样性测定;另一组自然风干,用于理化性质的测定。
1.3 试验方法
1.3.1 土壤理化性质测定 将风干后的土壤样品进行理化性质的测定:使用pH计测定pH值,使用电导率仪测定电导率,采用重铬酸钾容量法-水合热法测定有机质含量,采用NaOH碱解-扩散法测定有效氮含量,采用火焰光度计法测定有效钾含量,采用碳酸氢钠浸提-钼锑抗比色法测定有效钾含量[12]。
1.3.2 土壤DNA提取 采用Mo Bio Power Soil DNA Isolation Kit (Carlsbad,USA) 试剂盒进行土壤中微生物原基因组总 DNA 的提取[13]。将提取的DNA作为模板进行下一步扩增。
1.3.3 PCR扩增 采用细菌16S rDNA V4扩增通用引物进行目标基因PCR扩增,细菌引物为515F(5′-G T G C C A G C M G C C G C G G T A A-3′)和806R(5′-G G A C T A C H V G G G T W T C T A A T-3′)[14]。
1.3.4 土壤细菌群落的测定 采取 Illumina Miseq 高通量测序,获得土壤样品的丰度、α多样性指数、群落结构和群落组成差异。
1.4 数据分析
利用Microsoft Excel 2013进行数据处理,用SPSS 19.0软件Duncan’s法进行单因素方差分析及Pearson相关性分析。
2 结果与分析
2.1 土壤理化性质
4个子产区葡萄根际0~20、20~40 cm土层土壤的化学性质见表1。在葡萄根际土壤0~20 cm土层范围中,GCZ产区土壤的pH值最大,YQY产区土壤的电导率值最大(P<0.05),YQY、TD产区土壤的有机质含量显著大于其他产区(P<0.05),YQY产区土壤全氮含量亦大于其他产区,有效氮含量4个产区无明显差异,TD产区有效磷含量最大,GCZ产区有效钾含量显著高于其他产区(P<0.05)。在葡萄根际20~40 cm土层土壤范围中,GCZ产区的pH值显著高于其他产区(P<0.05),LL、TD产区电导率值显著高于其他2个产区(P<0.05),LL产区有机质含量在4个产区中较高,全氮含量YQY产区最高且显著高于其他产区(P<0.05),有效氮含量是LL产区的最高,TD产区有效磷含量显著高于其他产区,GCZ产区有效钾含量显著高于其他产区(P<0.05)。通过对比,0~20 cm土层土壤的养分含量普遍高于20~40土层。
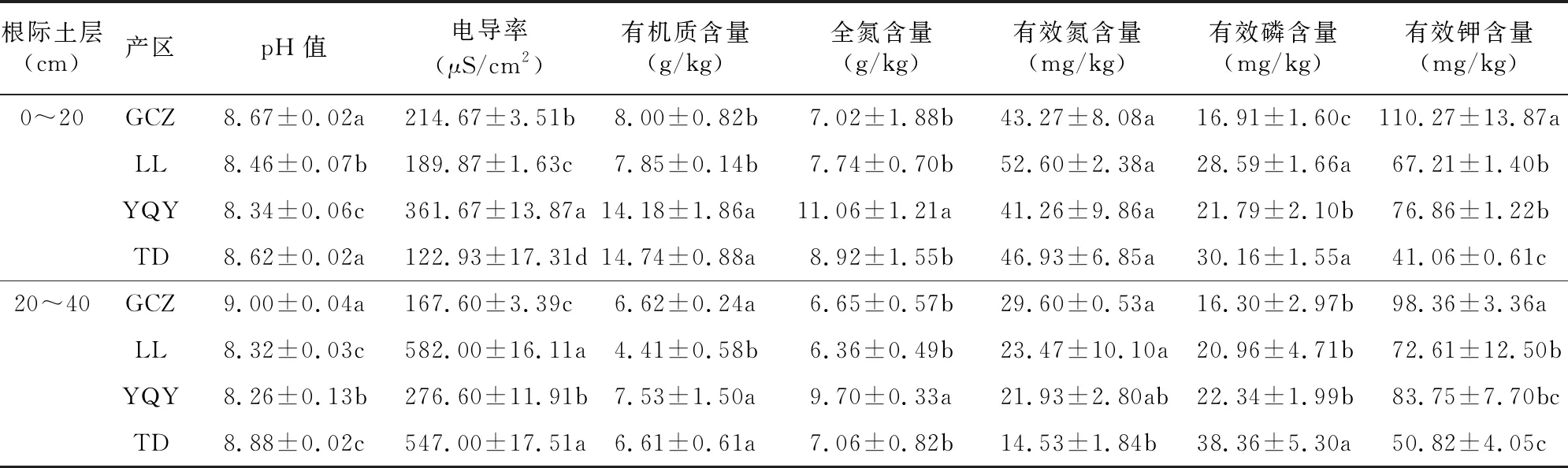
表1 不同产区葡萄根际土壤化学性质对比分析
2.2 土壤细菌群落特征
2.2.1 不同产区的土壤细菌多样性指数分析 ACE指数、Chao1指数表示群落丰度,指数越高说明群落的丰富度越大;Shannon指数可以用来估计样本群落的多样性,经常与Simpson指数一起用于反映α多样性指数,这2个指数越高表明微生物群落多样性越高。表2显示,贺兰山东麓4个产区葡萄根际土壤0~20、20~40 cm土层的测序覆盖率在98.23%~98.63%之间,说明该测序样本的可信度较高。在葡萄根际土壤0~20 cm土层中,GCZ产区的Chao1指数、ACE指数最大,说明在GCZ产区葡萄根际土壤0~20 cm土层中细菌群落丰富度较大。GCZ产区的Shannon指数、Simpson指数在4个产区中最大。在葡萄根际土壤20~40 cm土层中,GCZ产区与TD产区的ACE指数、 Chao1指数较大, TD产区的Shannon指数显著大于其他产区,该产区的Simpson指数也比其他产区大,说明TD产区细菌群落的多样性及丰富度较高。
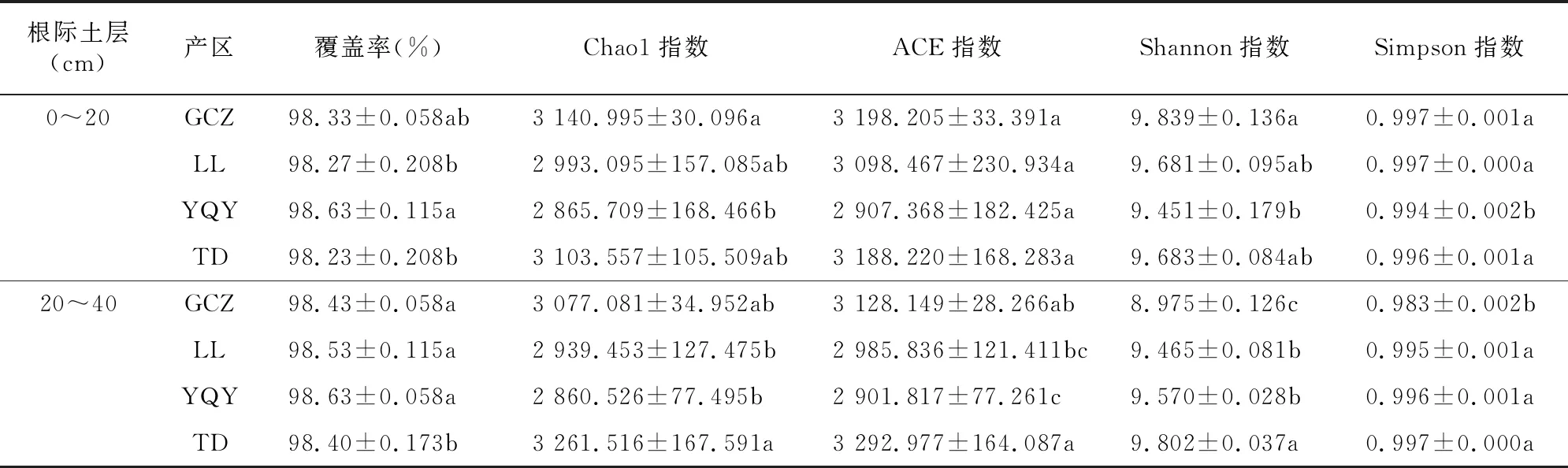
表2 不同产区葡萄根际土壤的细菌多样性指数
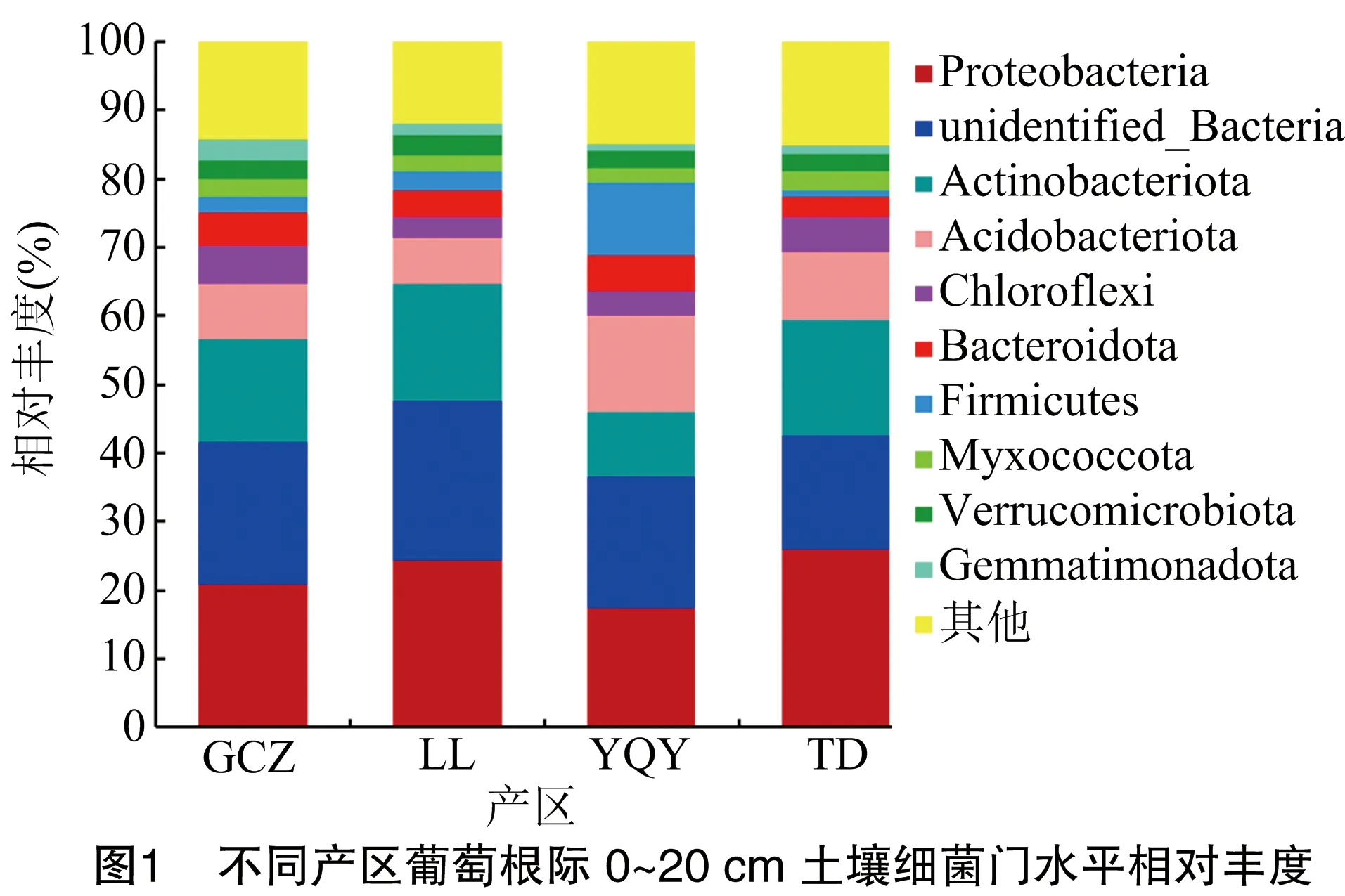
2.2.2 不同产区细菌门水平群落结构组成 由图1可知,在0~20 cm土层中,细菌丰富度较高的10个门类从高到低依次为变形菌门(Proteobacteria)、未知菌门(unidentified_Bacteria)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、黏菌门(Myxococcota)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadota)。其中变形菌门(Proteobacteria)是葡萄根际土壤0~20 cm土层中的最优势菌门,GCZ、LL、YQY、TD这4个产区相对丰度分别为20.89%、24.34%、17.33%、25.88%;同时还在根际土壤测得大量未知门类的菌,其相对丰度分别为20.83%、23.33%、19.10%、16.65%;其次是放线菌门、酸杆菌门等,都占有一定的比例。
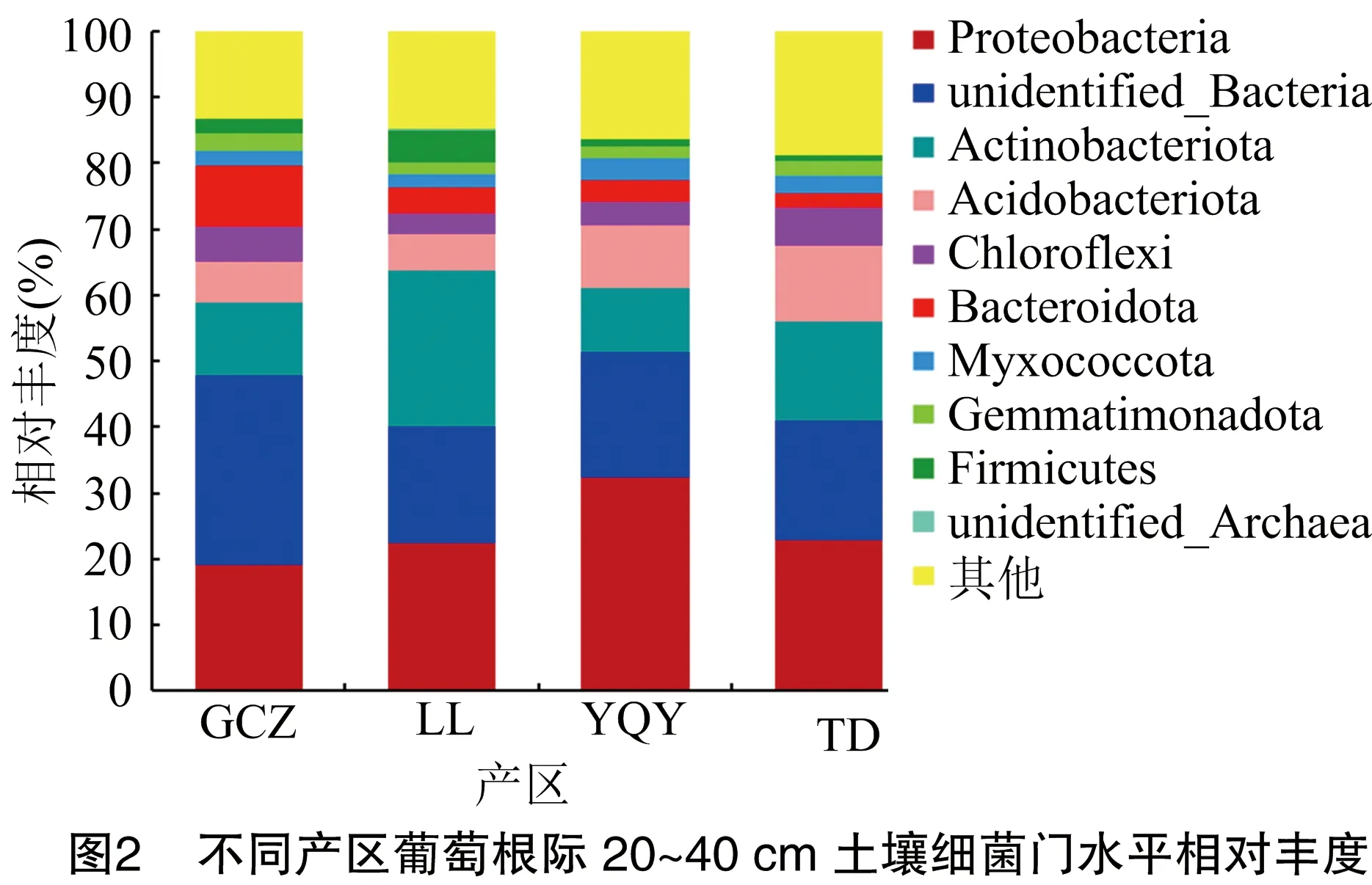
由图2可以看出,贺兰山东麓4个酿酒葡萄子产区在葡萄根际土壤20~40 cm土层中排名前十的细菌菌门依次是变形菌门(Proteobacteria)、未知菌门(unidentified_Bacteria)、放线菌门(Actinobacteriota)、酸酐菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidota)、黏菌门(Myxococcota)、芽单胞菌门(Gemmatimonadota)、厚壁菌门(Firmicutes)、未知古菌门(unidentified_Archaea)。最优势菌门仍为变形菌门(Proteobacteria),GCZ、LL、YQY、TD这4个产区相对丰度分别为19.05%、22.41%、32.35%、22.78;其次是未知菌门,其相对丰度分别为28.7%、17.62%、18.96%、18.14%;放线菌门相对丰度分别为10.98%、23.77%、9.84%、15.09%。
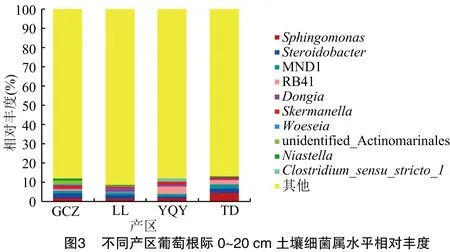
2.2.3 不同产区细菌属水平群落结构组成 由图3可知,在葡萄根际土壤0~20 cm土层中相对丰度排名前十的属分别为鞘氨醇单胞菌属(Sphingomonas)、链霉菌属(Steroidobacter)、MND1属、幽门螺菌属(RB41)、Dongia、斯科曼氏属(Skermanella)、海洋伍斯菌(Woeseia)、未知类菌门(unidentified_Actinomarinales)、农研丝杆菌属(Niastella)、Clostridium_sensu_stricto_1。优势菌属为鞘氨醇单胞菌属(Sphingomonas),在TD产区相对丰度最大,为4.37%,其余3个产区的相对丰度分别为:GCZ 1.81%、LL 1.32%、YQY 1.75%;其次优势菌属为链霉菌属,GCZ、LL、YQY、TD这4个产区相对丰度分别为2.44%、2.01%、0.80%、2.19%。
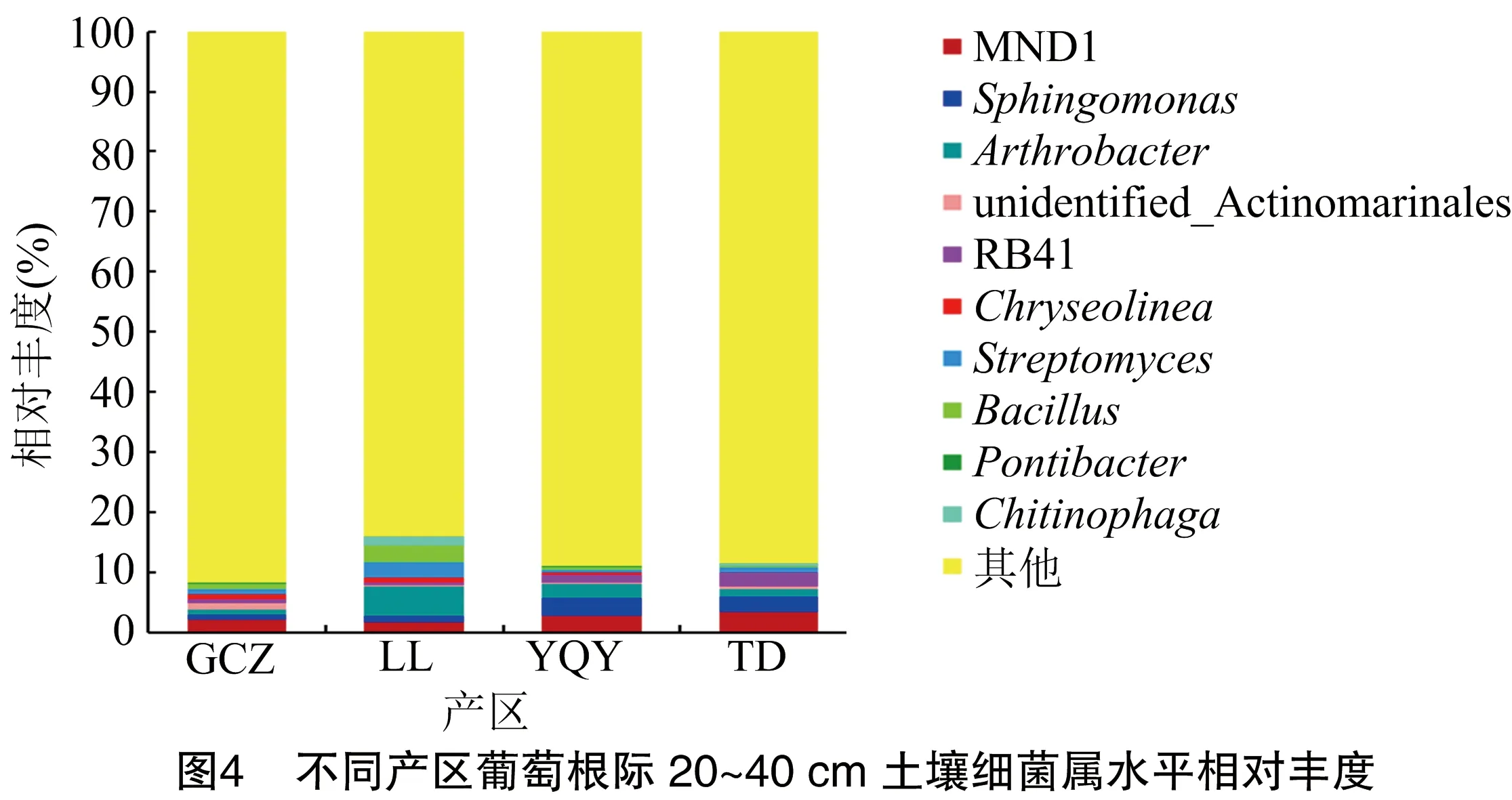
如图4所示,贺兰山东麓不同产区葡萄根际土壤20~40 cm土层中较高10个属的细菌分别为MND1属、鞘氨醇单胞菌属(Sphingomonas)、节核细菌属(Arthrobacter)、未知类菌门(unidentified_Actinomarinales)、幽门螺菌属(RB41)、Chryseolinea菌属、链霉菌(Streptomyces)、芽孢菌(Bacillus)、Pontibacter、几丁质噬菌(Chitinophaga)。其中,MND1为最优势菌属,在GCZ、LL、YQY、TD这4个产区相对丰度分别为1.78%、1.76%、2.74%、3.42%,鞘氨醇单胞菌属(Sphingomonas)相对丰度分别为0.70%、1.00%、2.97%、2.63%,节核细菌属(Arthrobacter)相对丰度分别为0.70%、4.81%、2.37%、1.28%。
2.3 土壤理化性质与优势细菌群落门水平的相关性分析
表3表明,不同产区葡萄根际土壤2个土层中,变形菌门与pH值、电导率值等呈负相关,与全氮、有效磷含量呈正相关;未知菌门与电导率值与呈显著正相关,与有效磷含量呈显著负相关;放线菌门与电导率值、全氮含量呈显著负相关;酸杆菌门与有机质含量及全氮含量呈极显著正相关;拟杆菌门与pH值、有效磷含量呈显著负相关,与电导率值、有效钾含量呈极显著正相关;绿弯菌门与土壤pH值呈极显著正相关。
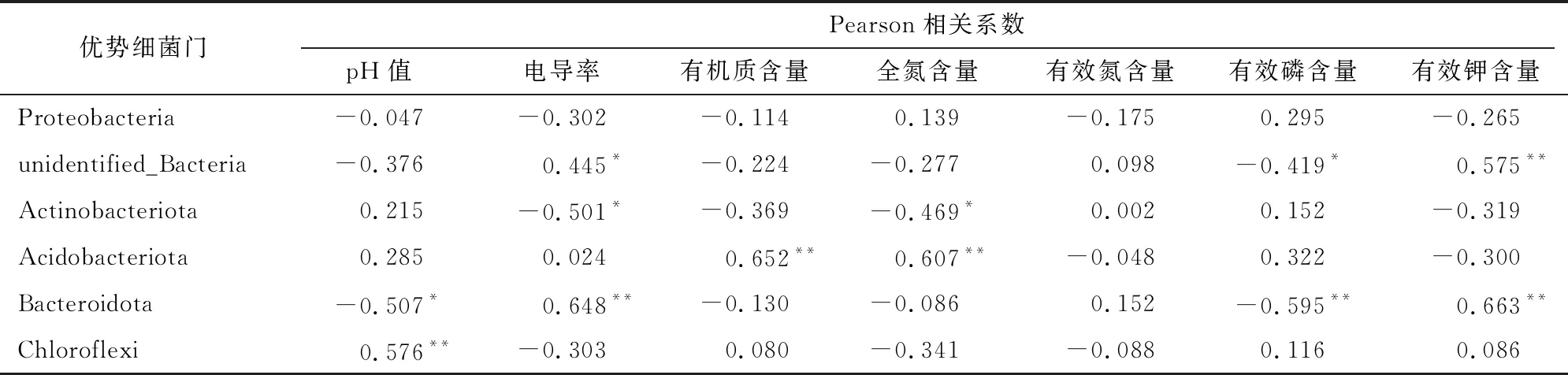
表3 不同产区葡萄园土层土壤理化性质与优势细菌门相对丰度Pearson相关性分析
3 讨论
3.1 贺兰山东麓不同子产区土壤理化性质分布特征分析
土壤养分含量对植株的生长具有重要作用[15]。本研究对贺兰山东麓酿酒葡萄4个子产区葡萄根际 0~20、20~40 cm土层土壤的理化性质进行分析,结果显示,玉泉营、天得产区的有机质与全氮含量较高,而有机质含量是土壤肥力的重要指标[16],因此玉泉营产区葡萄根际0~20 cm土层土壤肥力较高,天得产区20~40 cm土壤肥力较高。该结果源于贺兰山东麓不同果园施肥量有差异[17]。有研究表明,葡萄最适宜的土壤pH值为 6.5~7.5[18],本研究所测pH值为8.12~9.00,由此可见4个产区的土壤碱性都比较强,不利于葡萄植株生长。甘城子产区土壤的有效氮、有效钾含量在4个产区中较高,这是由土壤质地的不同及葡萄栽培过程中养分管理的差异所致[17,19]。
3.2 贺兰山东麓不同子产区土壤细菌多样性、群落结构组成及影响因子
本研究基于高通量测序分析贺兰山东麓不同土壤层细菌群落的结构组成,结果显示,测序覆盖率为98.23%~98.63%,在测序具有可信度的情况下,得出4个酿酒葡萄子产区葡萄根际0~20 cm土层土壤中,甘城子产区根际土壤的细菌群落丰富度及多样性相对较高。有研究表明,有效钾对α多样性指数的影响最大[20],土壤中K+有利于盐渍化土壤作物和微生物的生长,但是含量过高会产生盐害效应[21]。而本研究测得在葡萄根际20~40 cm土层土壤中,天得产区的细菌群落丰富度及多样性指数最大,可能是因为天得产区的有效钾含量处于较合适范围。有机质也可以提高土壤微生物的多样性,可以起到稳定土壤微生态的作用[22]。因此,建议葡萄园适量施用生态有机肥,从而有效调控细菌群落结构,促进葡萄园微生物的多样性。
土壤理化性质和微生物相互影响,与植株共享一个土壤生态系统[23]。贺兰山东麓4个酿酒葡萄子产区的优势菌属有MND1菌属、鞘氨醇单胞菌属、节核细菌属,优势菌门为变形菌门、放线菌门、酸杆菌门,这与周柳婷等的研究结果[24-25]一致。研究表明,影响细菌群落特征的主要因子是pH值[26],且大多数细菌最适pH值在6.5~7.6之间[27]。本研究中pH值与大多数细菌门类呈负相关。通常变形菌门为多数盐碱土壤地的优势菌门[26],本研究测得变形菌门为4个产区最优势菌门,这与李润根等研究结果[28-29]一致。变形菌门中存在尿素酶,可以促进尿素分解,固定土壤中的氮素,参与土壤物质循环[30]。变形菌门在玉泉营、天得产区的相对丰度相比其他产区高,相对应地,玉泉营、天得产区土壤中全氮含量也较高,经Pearson相关性分析,全氮含量与变形菌门呈正相关,与罗旦等的研究结果[31]一致。放线菌门在立兰产区的相对丰度较其他产区高。相关研究表明,酸杆菌门细菌可以编码纤维素酶、淀粉水解酶的基因序列,酸杆菌门可以降解动植物残体产生有机质等养分,提高土壤肥力[32]。本试验中酸杆菌门在玉泉营 0~20 cm土层土壤中相对丰度为13.90%,相比其他产区最大;天得产区在20~40 cm土层土壤中相对丰度为11.56%,相比其他产区大;而Pearson相关性分析得出,有机质含量与酸杆菌门呈极显著正相关,在玉泉营、天得产区葡萄根际土壤中较高,与隋夕然等的研究结果[33]一致。
4 结论
对比贺兰山东麓4个酿酒葡萄子产区的土壤养分含量,发现不同产区葡萄根际土壤养分均存在差异。其中,玉泉营产区土壤肥力相对较高,4个产区葡萄根际土壤均偏碱性。
不同产区葡萄根际土壤细菌α多样性指数分析表明,各产区细菌群落结构的差异性较大。甘城子、天得产区细菌群落的多样性及丰富度相对较高。
贺兰山东麓4个酿酒葡萄子产区土壤的优势菌门为变形菌门、放线菌门、酸杆菌门,优势菌属有MND1菌属、Sphingomonas菌属、Arthrobacter菌属。不同产区葡萄根际土壤理化性质与优势菌门的Pearson相关性分析表明,全氮含量是影响变形菌门的重要因子;有机质与全氮含量是影响酸杆菌门的重要因子;pH值、有效磷含量、电导率值、有效钾含量是影响拟杆菌门的主要因子;pH值是影响绿弯菌门的主要因子。

