红平菇锌化多糖制备工艺优化及抗氧化活性研究
时焕军陈婕妤高铄皓崔明晨林嘉龙何建昆贾乐张建军
(山东农业大学生命科学学院,山东 泰安 271018)
食用菌多糖系由10个以上的单糖以糖苷键连接而成的高分子多聚物,是从子实体、菌丝体、发酵液等组织中分离出的,具有控制细胞分裂分化、调节细胞生长衰老[1]、抗氧化[2]、抗肿瘤[3]、降血糖[4]等多种生物活性,成为近年来生物医学研究领域的热门。自由基学说是Denhan Harman提出的有关衰老的氧自由基理论,其研究表明自由基是具有高度活性的物质,能够使细胞和细胞器膜脂类产生过氧化损伤,进而导致细胞膜功能丧失。伴随人体内抗氧化系统能力下降,自由基可对组织器官造成伤害,危害人类健康,因此寻找外源性自由基清除剂具有十分重要的意义[5]。锌作为人体的必需微量元素,与300多种酶的活性密切相关,在免疫反应中起着非常重要的作用[6]。锌缺乏会导致机体出现发育迟缓、免疫和抗氧化防御功能紊乱、学习记忆能力下降和皮肤不完全角化等症状。人体主要是从药物或食物中获取锌元素,但补锌药物价格偏高,而提高锌在食物中的富集度可改善锌摄取不足。食用菌多糖具有良好的抗氧化活性[7]和自由基清除能力[8],且真菌多糖配合锌化合物修饰的抗氧化能力更强[9]。
红平菇(Pleurotus djamor)是食用菌中的珍稀菌类[10],具有较大的开发潜力。本试验以经过液体发酵和固体富锌培养的红平菇为材料,在预试验基础上,选择对锌化多糖得率影响大的锌浓度、培养时间、接种量3因素利用响应面法进行优化,确定最佳制备工艺,并评估锌化多糖在体内外的潜在抗氧化能力,为红平菇在大健康领域的应用提供理论参考。
1 材料与方法
1.1 材料与仪器
红平菇菌种为本实验室自主分离、鉴定并保存。Kunming雄性小鼠50只[(20±2)g],购于泰安泰邦生物制品有限公司。其他常规试剂均为化学纯。
1.2 试验方法
1.2.1 红平菇锌化多糖制备工艺优化 采用液体发酵和固体培养技术,在单因素预试验基础上,选择锌浓度、培养时间和接种量3个因素,以多糖得率为指标,利用响应面法优化红平菇锌化多糖的制备工艺。3因素及水平见表1。

表1 多糖得率的Box-Behnken试验设计
工艺流程:以醋酸锌为锌源配制不同锌浓度培养基,按设计接种量将菌块接入盛有相应锌浓度的150 mL培养基的三角瓶中,25℃静置24 h,130 r/min振荡培养相应培养时间。离心,将菌丝体60℃烘干至恒重,备多糖提取。
1.2.2 红平菇锌化多糖提取 参照张建军[11]的方法,将烘干的菌丝体放入离心管内,加入20倍体积的去离子水,90℃水浴锅内水浴2 h,3 000r/min离心10 min,将上清液转移到250 mL三角瓶中,反复浸提2次,加入3倍体积的乙醇进行醇沉,冷冻干燥。
1.2.3 多糖含量测定 采用苯酚-硫酸法。标准曲线制作方法:将葡萄糖置于100℃烘箱中干燥2h,准确称取干燥后的葡萄糖20 mg,加水定容至500 mL,分别精确量取0.4、0.8、1.0、1.2、1.6、1.8、2.0 mL葡萄糖溶液于10 mL具塞试管中,补水至2 mL,加入5%苯酚溶液(现配现用)1 mL后立即加入5 mL浓硫酸,沸水浴20 min后冷却至室温,于490 nm下测吸光值。以葡萄糖浓度为横坐标、吸光值为纵坐标,建立标准曲线,曲线R2值大于0.9900方可使用。准确量取2 mL样品按上述方法测定吸光值,并根据标准曲线计算多糖含量。
1.2.4 红平菇锌化多糖的红外光谱扫描分析利用傅里叶红外光谱分析方法。取1 mg干燥红平菇锌化多糖样品,加150 mg KBr充分研磨后压片,使用Nicolet Nexus 470红外光谱仪在500~4 000 cm-1范围内扫描,根据红外光谱中各特征峰的位置和形状,推断多糖官能团的特征。
1.2.5 红平菇锌化多糖的体内抗氧化能力评估
(1)小鼠衰老模型:将Kunming种雄性小鼠随机分为空白组、模型组、阳性对照组、锌化多糖高剂量组和锌化多糖低剂量组,每组10只小鼠。其中,空白组:腹腔注射pH为4.5的柠檬酸缓冲液10 mL/kg+灌胃去离子水10 mL/kg;模型组:腹腔注射D-半乳糖(D-gal)0.2 mL+灌胃去离子水10 mL/kg;阳性对照组:腹腔注射D-半乳糖0.2mL+灌胃葡萄糖酸锌10 mL/kg;高剂量组:腹腔注射D-半乳糖0.2 mL+灌胃锌化多糖溶液400 mg/kg;低剂量组:腹腔注射D-半乳糖0.2 mL+灌胃锌化多糖溶液200 mg/kg。
每天小鼠自由饮食和饮水,定时腹腔注射和灌胃各1次,持续45 d。每日记录小鼠的体重及饲料和水的消耗量。
(2)样品制备:所有小鼠禁食过夜后称量体重,麻醉处死后眼眶取血,5 000 r/min离心5 min后取上清液(血清)备用。取血后将小鼠在无菌环境中解剖,摘取肝、肾、脑等组织放进0.9%的生理盐水中进行清洗,用滤纸吸干表面水分,称重并记录。取1 g组织迅速加入9 mL预冷的PBS缓冲液(0.2 mol/L,pH 7.4,4℃)进行研磨,于5 000 r/min离心20 min,取上清即得组织匀浆,冷藏保存待用。另外取小鼠的肝、肾、脑组织,浸泡于4%的中性甲醛溶液进行固定,进行组织病理标本及切片的制备。
(3)指标分析:利用全自动生化分析仪测定小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)、肌酐(CREA)。通过紫外可见分光光度计平行测定各组小鼠组织匀浆液中过氧化氢酶(CAT)活性和丙二醛(MDA)的含量。
1.3 数据处理
用SPSS 22.0软件(IBM Institute,USA)进行显著性分析。试验数据以3次独立平行试验的平均值±标准差表示,同时采用单因素方差分析(ANOVA)及LSD、Tukey事后多态性检验来评估组间差异,P<0.05为差异显著。
2 结果与分析
2.1 红平菇锌化多糖制备工艺优化
2.1.1 响应面优化试验结果 对表2中各组合锌化多糖得率进行Design-Expert 7.0数据分析,获得多糖得率与锌浓度(X1)、接种量(X2)、培养时间(X3)的二次拟合回归方程:

表2 响应面试验设计及结果
由方程中3因素的一次项数值可以得出,锌浓度、接种量和培养时间的正向变化在一定程度上可以引起多糖得率的增加;3因素的二次项系数为负值,开口向下,说明该模型条件范围内能够得到最大值。因此,可以利用该模型对多糖的得率进行优化。
表3、表4显示,该模型的F值为464.09,P值<0.0001,说明模型极显著,可用来进行响应面预测。失拟值的F值为0.21,P值为0.8860(>0.05),表明失拟项与纯误差之间差异不显著。模型的R2值为0.9983,说明模型的拟合程度良好;噪声比为54.725,PRESS为0.68,表明该模型自变量与响应值之间的线性关系显著。综上所述,模型的拟合程度很好,误差较小,可以用此模型对红平菇锌化多糖的制备工艺进行优化。

表3 BBD的中心组合设计模型及方差分析

表4 多糖得率拟合方差分析
二次模型中回归系数的显著性分析结果见表5。可知,一次项中X1、X3及交互项、二次项均在P<0.01水平上对多糖得率有显著影响,其中X3、的影响较大。一次项因素对多糖得率的影响顺序依次是X3>X1>X2,即培养时间>锌浓度>接种量。

表5 多糖得率二次模型回归系数的显著性检验
2.1.2 模型的准确性和异常值分析 多糖得率正态概率随机分布在直线的两侧,并且靠近直线,表明该模型的方差无偏差(图1A);残差与方程预测值的对应关系(图1B)显示,响应值随机分布在限定线(红色)以内。综上说明模型设计精确度高,可用于多糖得率的响应分析。

图1 多糖得率模型准确性分析
如图2所示,所有多糖得率的外部学生化残差分析均落到限制线(图2A中的红线)内,杠杆值远远低于1(图2B)。可用该模型分析影响多糖得率变量之间的关系。

图2 不同多糖得率间异常值的分析
2.1.3 因素间交互作用分析 从图3和表5看出,锌浓度和接种量交互作用对多糖得率影响显著,曲面较缓和并且随着锌浓度的上升,多糖得率先升高后降低。轴向等高线密集变化显示锌浓度对多糖得率的影响较接种量更大,这与方差分析结果一致。

图3 锌浓度和接种量对多糖提取率交互作用影响的等高线图及响应面图
由图4和表5看出,锌浓度和培养时间交互作用对多糖得率影响显著,锁定一个变量可以看出另一个为先增加后平缓的趋势。轴向等高线密集变化显示培养时间对多糖得率的影响较锌浓度更大,这与方差分析结果一致。

图4 锌浓度和培养时间交互作用对多糖提取率影响的等高线图及响应面图
由图5和表5可知,接种量和培养时间交互作用对多糖得率影响显著,随着培养天数增加,多糖得率缓慢上升。轴向等高线密集变化显示培养时间对多糖得率的影响较接种量更大,这与方差分析结果一致。

图5 接种量和培养时间交互作用对多糖提取率影响的等高线图及响应面图
综合上述分析,通过回归方程可得锌浓度为163.90 mg/L、接种量为2.39 cm2、培养时间为8 d时,锌化多糖理论得率最高,为6.70%。对该条件下的富锌率进行火焰原子吸收分光光度法检测,结果为(90.22±4.35)%,富锌率较高,可用于后续动物实验。
2.2 红平菇锌化多糖体内抗氧化能力评估
2.2.1 血清生化指标分析 血清中CREA、BUN为检测肾功能是否被损伤的生化指标。由图6可知,注射D-gal后模型组小鼠CREA、BUN含量比空白组显著升高,表明小鼠肾脏发生了损伤,肾小球过滤能力下降,无法正常代谢,导致血清中CREA、BUN积累,造成机体器官组织功能障碍。当灌胃红平菇锌化多糖后,小鼠肾脏中CREA、BUN含量降低,说明红平菇锌化多糖对衰老引起的肾脏损伤有一定缓解作用。
ALT、AST被临床认为是监测肝损伤的生化指标。由图6可知,注射D-gal后模型组小鼠ALT、AST活性比空白组明显升高,表明发生了特征性肝脏损伤。当灌胃红平菇锌化多糖后,小鼠肝组织中ALT、AST活性分别有不同程度降低,但差异不显著(P>0.05)。结果表明红平菇锌化多糖可一定程度上减轻衰老引起的肝脏损伤。
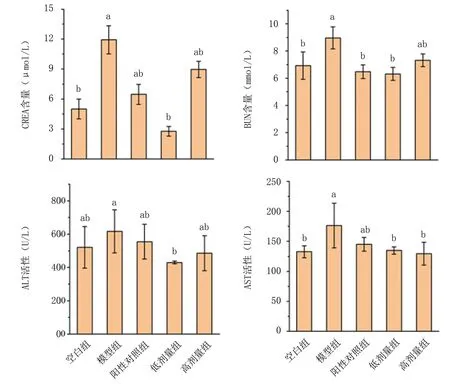
图6 红平菇锌化多糖对衰老小鼠血清生化指标的影响
2.2.2 体内抗氧化指标分析 由图7可知,模型组肾组织和肝组织CAT活性比空白组明显降低,表明小鼠产生了不同程度的肝损伤。灌胃锌化多糖后CAT活性皆有明显提高,且高于阳性对照,可以证明红平菇锌化多糖能够提高D-gal诱导的衰老小鼠肝组织及肾组织中CAT活性,缓解氧化应激损伤。
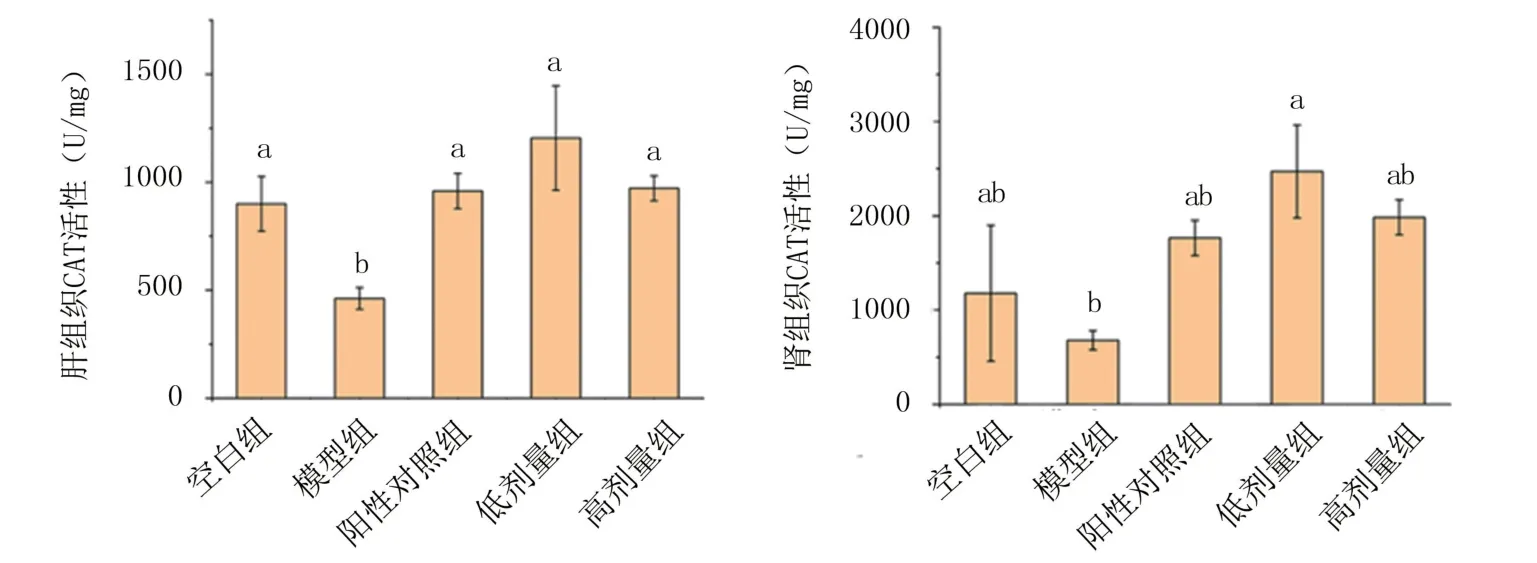
图7 红平菇锌化多糖对衰老小鼠组织内CAT活性的影响
由图8可知,相比空白组,D-gal诱导的衰老模型组小鼠肝、肾组织中MDA含量升高,且肝组织中升高显著(P<0.05)。锌化多糖处理组MDA含量显著降低,说明红平菇锌化多糖能有效降低肝及肾组织中MDA含量,有效抑制D-gal诱发的衰老,且效果高于阳性对照组。
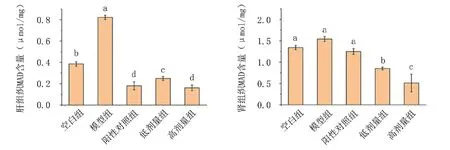
图8 红平菇锌化多糖对衰老小鼠组织内MDA含量的影响
2.3 红平菇锌化多糖的红外光谱扫描分析
扫描结果(图9)显示,在光谱3 278.17 cm-1处出现多糖特征吸收峰,由羟基(-OH)伸缩振动引起;在2 917.94 cm-1附近的吸收峰是糖类C-H键伸缩振动;在1 644.49 cm-1处出现显著吸收峰,由多糖中乙酰胺基(-NHCOCH3)的(C=O)非对称伸缩振动引起;在1 324.10 cm-1附近是糖醛酸特征吸收峰,以上几组吸收峰结果表明该物质属于糖类化合物。在光谱1 024.51、888.84、666.10 cm-1处出现吸收峰,推测为Zn-O的外弯弯曲振动峰,因此红平菇锌化多糖为β-呋喃糖。由于红外光谱给出的结构信息仅为相关官能团连接方式及类型,对红平菇锌化多糖的结构反映并不全面,因此,还需对其具体结构进一步研究。

图9 红平菇锌化多糖红外光谱分析结果
3 讨论与结论
多糖是生物体的重要组成成分,是具有抗衰老、抗病毒、增强机体免疫力等功能的天然活性物质[12]。MDA是氧自由基损伤和脂质过氧化作用的主要代谢产物,存在于血清和组织中的MDA含量高低能反映机体自由基代谢的情况[13]。CAT存在于机体过氧化物体内,其活性高低间接反映细胞遭到自由基攻击的受损程度[14]。本试验结果表明红平菇锌化多糖相比于同浓度的未富锌多糖[15]及其他部分侧耳属多糖有更好的抗氧化能力[16],且抗氧化能力随着多糖浓度的增加而增加,可在一定程度上缓解氧化应激所带来的肝损伤和肾损伤,从而抑制衰老,延长寿命。
本试验采用醇沉浸提方式,在单因素预试验基础上,通过响应面法确定了红平菇锌化多糖的最佳提取条件为锌浓度163.90 mg/L,接种量2.39 cm2,培养时间8 d。在此条件下,红平菇锌化多糖提取率可以优化至6.70%。本研究结果可为建立红平菇有机锌转化、锌化多糖制备生产体系以及补锌食物、药物开发提供参考和依据。

