环境因素胁迫下浓香型白酒窖泥微生物多样性变化规律
雷学俊,张霞,刘芳,赵东,2,乔宗伟,2,罗青春,王晓妹,刘多涛,郑佳,2
(1.宜宾五粮液股份有限公司,四川宜宾 644000;2.中国轻工业浓香型白酒固态发酵重点实验室,四川宜宾 644000)
浓香型白酒占我国白酒年总产量的70 %以上,因入口甜、落口绵、窖香浓郁、绵柔甘洌、香味协调、尾净余长等特点,广受消费者的喜爱[1-2]。窖泥作为浓香型白酒酿造过程中厌氧微生物的发酵载体,是赋予浓香型白酒主体香、窖香等复杂风味的主要来源[3]。在长期不间断的生产过程中,窖泥微生物菌群也在不断的发生演替变化,逐渐形成了以乳杆菌属(Lactobacillus)、己酸菌属(Caproiciproducens)、梭菌属(Clostridium)、互营单胞菌属(Syntrophomonas)、沉积菌属(Sedimentibacter)和甲烷杆菌属(Methanobacterium)等为优势微生物属[4-5],宜宾产区优势微生物为沉积菌属(Sedimentbacter)、Sporanaerobacter和Tissierella[6-7]等。不同种类优势微生物各司其职,又相互影响,例如,Lactobacillus相对丰度6.45 %~55.79 %[8-9],能够利用葡萄糖产生氢气、二氧化碳和乙酸等[10];Caproiciproducens相对丰度随着窖龄的增加而升高,约为40.40 %[11-12],能利用葡萄糖、乳糖等产生乙酸、CO2和H2[13];Sedimentibacter相对丰度为1.14 %[9],具有降解氨基酸的作用[14];Clostridium与Caproiciproducens在厌氧及有关酶的作用下,代谢产生己酸和氢气[4],与产甲烷菌之间通过种间氢转移过程,消耗氢气,促进己酸的合成[15]。
近年来,运用高通量测序技术和统计学方法等研究窖泥微生物群落与理化指标之间的关系越来越多。研究发现,窖泥微生物生长的最适温度为32~35 ℃,温度过低会抑制窖泥微生物生长[16]。乙酸、铵态氮和pH 值等与老窖泥的菌群呈正相关,乳酸、乙醇和丙酸含量与新窖泥的菌群呈正相关[17]。成熟期窖泥中的乳酸与Caproiciproducens和Clostridium微生物呈负相关[18]。此外,30 年窖龄的窖泥中的有机酸与Caproiciproducens、Caloramatoraceae呈正相关[19]。目前的研究热点在于寻找窖龄、窖泥微生物和窖泥理化特性与风味物质相关的信息,因此,探索不同环境因素胁迫条件下窖泥微生物群落结构的定向驯化(特别是优势微生物菌群)是十分有意义的。
本研究应用高通量测序系统研究了环境因素(温度为物理因素,乙醇、乳酸、乙酸为化学因素)胁迫下窖泥微生物菌群的演化,通过定量的环境因素水平下揭示窖泥优势微生物群落的变化情况,以期为阐明窖泥微生物的功能和影响因素提供理论依据。
1 材料与方法
1.1 材料、试剂及仪器
样品及材料:窖泥样品由五粮液股份有限公司提供,窖龄约20年,窖泥均采集下层窖泥,编号分别为A和B。
试剂及耗材:乳酸,美国Sigma 公司;乙醇,成都市科隆化学品有限公司;乙酸,成都市科隆化学品有限公司,以上试剂均为分析纯。土壤样品提取试剂盒(MP Biomedicals FastDNA),美国MP Biomedicals 生物医学公司;五粮粉液体发酵培养基参照文献[20]进行制备。
仪器设备:高速冷冻离心机(5810R),德国Eppendorf 公司;NanoDrop one 超微量分光光度计,赛默飞世尔科技公司;生化培养箱(BPC-250F),上海一恒科学仪器有限公司;蒸汽灭菌锅(HVE-50),上海一恒科学仪器有限公司;高通量测序仪(Next-Seq 500),美国Illumina公司。
1.2 实验方法
1.2.1 窖泥微生物洗脱液的制备
按窖泥∶无菌水=1∶10比例进行涡旋混匀5 min,800 r/min 低速分离,收集上清液;10000 r/min 高速收集,去掉上清液,再按窖泥∶无菌水=1∶10 比例加入无菌水,重复以上步骤5~6次,尽量洗脱窖泥溶解于水中的风味物质,得到窖泥微生物洗脱液。
1.2.2 发酵实验方案
1.2.2.1 物理因素胁迫窖泥微生物发酵
温度:窖泥洗脱液按培养基的10 %接种至100 mL 已灭菌的五粮粉液态培养基中,分别放置28 ℃、34 ℃、40 ℃培养箱中培养30 d。
1.2.2.2 化学因素胁迫窖泥微生物发酵
乙醇:窖泥洗脱液按培养基的10 %接种至100 mL 已灭菌的五粮粉液态培养基中,再添加1%、2%、4%乙醇,混合均匀,放置34 ℃培养箱中培养30 d。
有机酸:窖泥洗脱液按培养基的10 %比例接种至100 mL 已灭菌的五粮粉液态培养基中,分别添加0.1%、0.2%、0.4%乳酸和乙酸,混合均匀,放置34 ℃培养箱中培养30 d。
1.2.3 基因组DNA提取及PCR扩增
采用MP Biomedicals FastDNA 试剂盒提取窖泥发酵液中微生物基因组总DNA,用NanoDrop one 超微量分光光度计检测DNA 浓度和纯度。以DNA 为模板,引物为Hyb515F(5'-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGGTG -CCAGCMGCCGCGGTAA-3') 和 Hyb806R (5'-GTCTCGTGGGCTCGGAGATGTGTATAAGAG -ACAGGGACTACHVGGGTTCTAAT-3-) 对细菌16S rDNA 基因V4 区域扩增[7]。PCR 扩增具体反应程序如下:94 ℃预变性3 min;94 ℃变性20 s,53 ℃退火25 s,72 ℃延伸45 s,共25 个循环;72 ℃延伸5 min。
1.2.4 高通量测序及序列分析
高通量测序及序列分析步骤具体参照文献[7]进行。
1.2.5 数据处理
对测序原始数据参照文献[7]进行处理;采用Origin 2021绘制柱状图。
2 结果与分析
2.1 环境因素胁迫下窖泥发酵液pH值变化
如图1 所示,物理因素胁迫发酵后,pH 值由5.2~5.5 降低至3.0 左右;经化学因素胁迫发酵后,pH 值由3.0~4.2 降低至3.0 左右,均呈现减少的现象,说明经环境因素胁迫,窖泥微生物能进行正常生长且一定程度上代谢产酸。
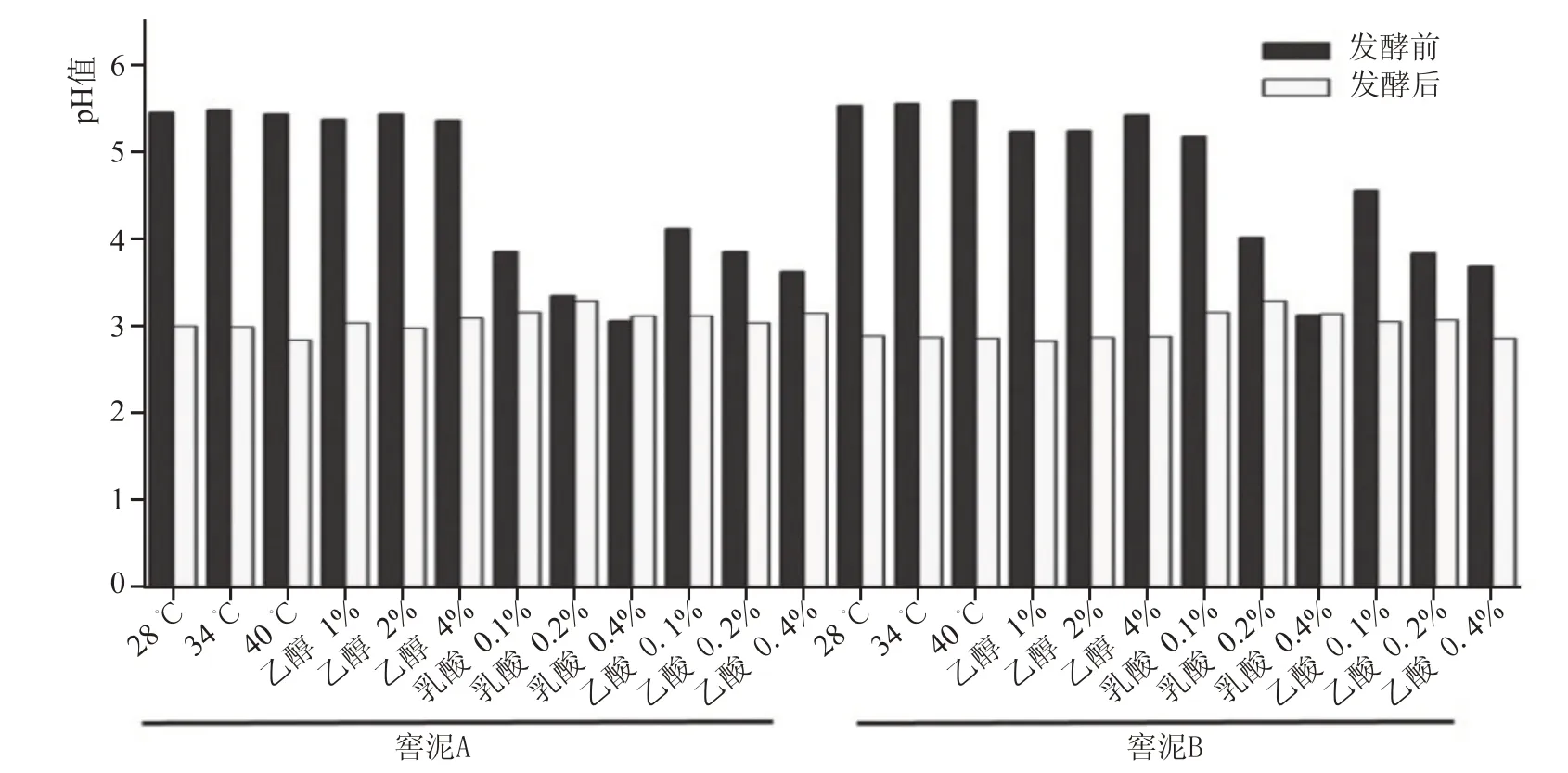
图1 发酵前后pH值变化情况
2.2 物理因素胁迫下窖泥微生物群落结构变化
2.2.1 目水平下群落结构变化
基于OTU 注释,每个发酵样品中厚壁菌门(Fimicutes)相对含量占96%以上,与四川某知名浓香型酒厂窖泥中厚壁菌门为绝对优势菌群具有一致性[21]。门水平下差异性不显著,故选择在目水平进行比较。在目水平下共检出8 个目,占每个样品总含量的95%以上,如图2所示。
目水平下,两个窖泥样品微生物群落结构组成大体一致(图2)。经物理因素胁迫发酵后,主要由4 个目主导,包括梭菌目(Clostridiales)>Thermoanaerobacterales>乳杆菌目(Lactobacillales)≥芽孢杆菌目(Bacillales),拟杆菌目(Bacteroidales)、Coriobacteriales、互养菌目(Synergistales)和Acholeplasmatales未检出。
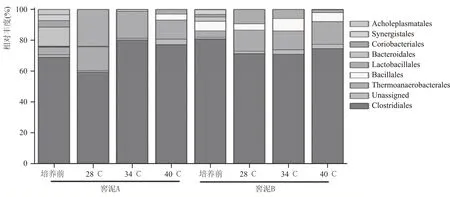
图2 目水平下窖泥中原核微生物群落结构的变化
与培养前相比,梭菌目的相对丰度为68 %~79%,差异性不显著,除在28 ℃胁迫发酵后;Thermoanaerobacterales 相对丰度从4 %增加到14 %~16%,差异性显著。经28 ℃胁迫发酵后,窖泥A 和B 中乳杆菌目相对丰度分别为23.7 %和9.3 %,相比其他水平胁迫(相对丰度为0.1%~8%),达到了最高相对丰度。
2.2.2 属水平下群落结构变化
将平均相对丰度超过1 %的微生物定义为优势属[22]。本研究基于OTU注释,两个窖泥样品微生物群落结构组成大体一致,共得到113 个属,其中相对丰度>1%的优势菌属共17个,各优势菌属的相对丰度如图3 所示。经物理因素胁迫发酵后,主要由6 个属主导,包括Sedimentibacter(占20 %~35 %)>Caloribacterium(占10 %~17 %)>Tepidimicrobium(占6 %~12 %)>Lactobacillus(占1 %~23 %)≥Sporanaerobacter(占2 %~4 %)≥Tissierella(占2 %~3 %),占每个样品总含量的60 %以上。Aminobacterium、Proteiniphilum、Acholeplasma和Atopobium均未检出。

图3 属水平下窖泥中原核微生物群落结构的变化
与培养前相比,Sedimentibacter、Tissierella和Sporanaerobacter的相对丰度差异不显著;Calorib-acterium和Tepidimicrobium相对丰度均增加了2 倍以上,但在不同温度胁迫下差异不显著;在28 ℃发酵下,Lactobacillus相对丰度最高,增加了3倍以上。有关研究表明,Sedimentibacter和Tepidimicrobium能够为己酸合成提供前体物质乙酸和丁酸[13,23],Caloribacterium和Sporanaerobacter能够利用葡萄糖发酵产乙酸、氢气和二氧化碳[24-25]。
相比对照组(34 ℃培养下),低温28 ℃能促进Lactobacillus的生长。作为固态法白酒生产的重要微生物Lactobacillus,代谢产有机酸能促进酿酒酶系的糖化和发酵[26],代谢积累的乳酸可作为梭菌属合成丁酸和己酸的底物,还具有维护与保持酿酒微生态环境等作用[27-28]。
2.3 化学因素胁迫下窖泥微生物群落结构变化
2.3.1 目水平下群落结构变化
基于OTU 注释,每个发酵样品中厚壁菌门(Fimicutes)相对含量占99%以上,无法进行样品之间的差异性比较,故选择在目水平进行比较。在目水平下共检出8 个目,占每个样品总含量的97 %以上,两个窖泥样品微生物群落结构组成大体一致,如图4所示。

图4 目水平下窖泥中原核微生物群落结构的变化
目水平下,经化学因素胁迫发酵后,主要由4个目主导,包括梭菌目(Clostridiales)>Thermoanaerobacterales>乳杆菌目(Lactobacillales)≥芽孢杆菌目(Bacillales),拟杆菌目(Bacteroidales)、Coriobacteriales、互养菌目(Synergistales)和Acholeplasmatales 未检出。添加乳酸胁迫发酵,能抑制梭菌目微生物生长,添加乙酸胁迫,则无显著性作用,这与吴浪涛等[18]表明的乳酸与大部分梭菌纲微生物都呈负相关相一致。
与培养前相比,Thermoanaerobacterales 相对丰度从4 %增加到14 %~16 %,差异性显著;芽孢杆菌目和乳杆菌目相对丰度均呈现增加的趋势,芽孢杆菌目在添加0.2 %乙酸(在窖泥A 中相对丰度为12.1%)和0.4 %乳酸(在窖泥B 中相对丰度为13.8 %)胁迫发酵下达到最高,乳杆菌目在添加0.2 %乳酸胁迫发酵下达到最高(A-30.4 %,B-25.5%)。
2.3.2 属水平下群落结构变化
经化学因素胁迫发酵后,两个窖泥样品微生物群落结构组成大体一致,各优势菌属的相对丰度如图5 所示。主要由6 个属主导,包括Sedimentibacter(占19 %~30 %)>Caloribacterium(占10 %~16 %)>Tepidimicrobium(占4 %~12 %)>Lactobacillus(占3 %~30 %)≥Sporanaerobacter(占2~4%)≥Tissierella(占1%~3%),占每个样品总含量的60 %以上。Aminobacterium、Proteiniphilum、Acholeplasma和Atopobium均未检出。
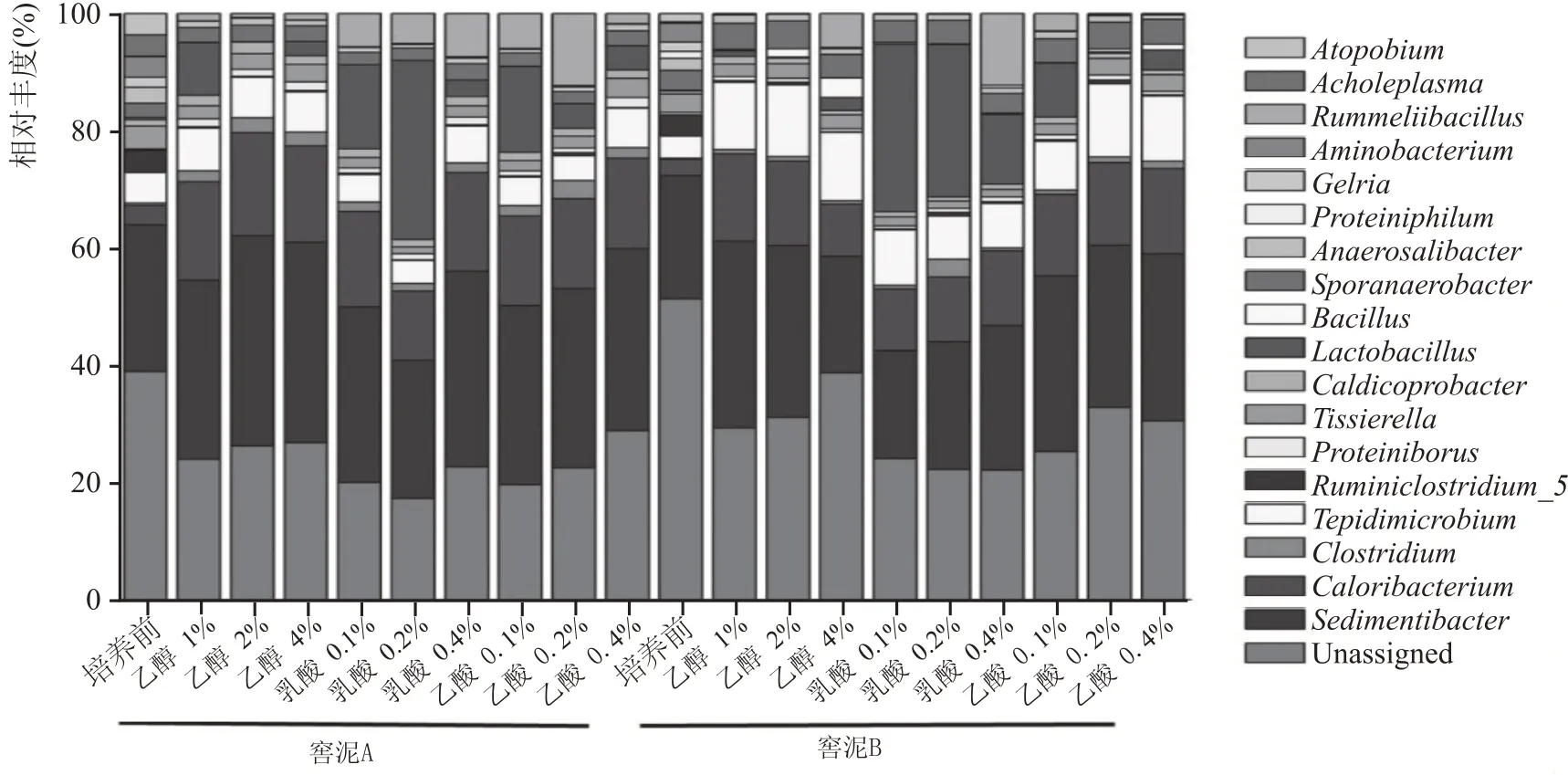
图5 属水平下窖泥中原核微生物群落结构的变化
与培养前相比,Lactobacillus相对丰度差异极显著,在添加0.2%乳酸胁迫下的相对丰度最高,占25%~30%;Sedimentibacter和Sporanaerobacter相对丰度差异不显著;Caloribacterium和Tepidimicrobium相对丰度均增加了2 倍以上,但在不同乙醇浓度胁迫下差异不显著;Caloribacterium相对丰度增加了2 倍以上,但在不同乳酸、乙酸浓度下相对丰度差异不显著;在窖泥样品B组中,Tepidimicrobium相对丰度增加幅度具有显著性。
相比对照组(34 ℃培养下),添加乳酸和乙酸胁迫发酵能促进Lactobacillus的生长,抑制Tissierella和Clostridium的生长。推测原因如图1 所示,添加乳酸和乙酸胁迫发酵后,环境pH 维持在3.0 左右,适宜乳酸杆菌属生长(Lactobacillus可以在pH值低至2.4 的条件下存活[29]),不适宜Tissierella和Clostridium生长(Tissierella生长的最适pH值为6.0~7.0[30],Clostridium生长的最适pH 值为5.0~7.0[31])。
3 结论
本研究利用高通量测序仪对环境因素(温度物理因素,乙醇、乳酸、乙酸化学因素)胁迫下窖泥微生物群落结构进行分析和比较。结果表明,选取2个窖泥样品进行环境因素胁迫发酵后,在目水平和属水平下,窖泥微生物群落结构组成大体一致,具有一定程度的可重复性。
目水平下,经环境因素胁迫发酵后,28 ℃和0.2 %乳酸胁迫下,对乳杆菌目菌群微生物的生长具有促进作用。主要由4 个目主导,包括梭菌目(Clostridiales)>hermoanaerobacterales>乳杆菌目(Lactobacillales)≥芽孢杆菌目(Bacillales),拟杆菌目(Bacteroidales)、Coriobacteriales、互养菌目(Synergistales)和Acholeplasmatales 未检出。与培养前相比,Thermoanaerobacterales 相对丰度由4 %增加到14%~16%,具有显著差异性;在化学因素胁迫发酵下,芽孢杆菌目和乳杆菌目相对丰度均呈现增加的趋势。
属水平下,经环境因素胁迫发酵后,得出低温、乳酸和乙酸对Lactobacillus的生长具有促进作用;乳酸和乙酸对Tissierella和Clostridium具有抑制作用。主要由6 个属主导,包括Sedimentibacter>Caloribacterium>Tepidimicrobium>Lactobacillus≥Sporanaerobacter≥Tissierella,Aminobacterium、Proteiniphilum、Acholeplasma和Atopobium均未检出。与培养前相比,Sedimentibacter、Tissierella和Sporanaerobacter的相对丰度差异不显著;Lactobacillus在低温28 ℃和0.2 %乳酸胁迫发酵下相对丰度最高,分别为16.2%和27.65%。

