利用Hnf4α敲除的小鼠肝脏类器官探究发育模型的应用潜力
张智玉,曹 军,梁俊波
中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系,北京 100005
肝脏是重要的代谢调控和药物解毒器官,肝细胞是肝脏的主要实质细胞,是肝脏功能的主要承担者。然而,由于种种原因,胚胎时期肝脏发育中肝细胞分化的研究仍然有限。
诱导多能干细胞(induced pluripotent stem cells, iPSCs)经过逐步诱导分化形成类肝细胞及肝脏类器官是目前研究肝脏发育的经典模型。2013年首次将PSCs诱导形成的肝内胚层细胞与内皮细胞、间充质细胞按一定比例混合,在体外聚合形成了3D肝芽结构[1]。随后,经过对该模型的不断优化和改进,最终实现了PSCs向胆管细胞分化以及向肝细胞样细胞和胆管细胞样细胞共分化[2-4]。然而,该模型诱导分化过程耗时较长、成本较高。成体来源的胆管类器官(intrahepatic cholangiocyte organoid, ICO)能够在体外长期扩增并保持胆管细胞的特征,同时可经一步诱导分化为类肝细胞[5],且培养过程相对简单,分化时间较短,为体外探究肝脏发育提供了新的途径。但胆管类器官对肝脏发育的模拟潜力仍不明确。
本研究利用小鼠胆管类器官转分化模型,以肝脏发育过程中已知的核心转录调控因子肝细胞核因子4 α(hepatocyte nuclear factor 4α,Hnf4α)敲除的胆管类器官为例,结合小鼠胎肝单细胞转录组测序数据,从基因变化趋势、生物学功能、regulon调控关系三方面,比较了胆管类器官转分化与胎肝发育中的分化异同,以探究胆管类器官作为研究肝脏发育模型的应用潜力。
1 材料与方法
1.1 材料
Advanced DMEM/F12、B27细胞无血清培养添加剂、N2添加剂、GlutaMAX、青霉素/链霉素、EGF和TrypLE(Life Technologies公司);N-乙酰半胱氨酸、烟酰胺、forskolin、γ分泌酶抑制剂DAPT、地塞米松和TGF-β受体拮抗剂A83-01(Sigma-Aldrich公司);R-spondin1(R&D公司);FGF10和HGF(Peprotech公司);胃泌素(Tocris Bioscience公司);Matrigel Matrix(BD公司);小鼠胆管类器官由复旦大学赵冰实验室惠赠[6];微量样品总RNA提取试剂盒(上海天根生化科技有限公司)。
1.2 方法
1.2.1Hnf4α敲除胆管类器官的构建:利用在线网站设计针对HNF4α蛋白编码区的sgRNA序列:GG GACCGGATCAGCACGCGG,非靶向sgRNA序列:AAGGCGTAAACGAGTACACG。合成相应寡核苷酸序列后退火形成双链DNA,连到酶切后的CROP-seq-mCherry载体上。将Hnf4α敲除质粒转染HEK293T细胞包装慢病毒,用慢病毒感染类器官。通过流式细胞分选技术筛选成功感染的细胞。
1.2.2 小鼠胆管类器官转分化:根据Hans Clever实验室的方法对小鼠胆管类器官进行扩增和转分化[7]:首先将非靶向(non-targeting, NT)胆管类器官和Hnf4α敲除胆管类器官在分化培养基1(differentiation medium 1, DM-1)培养4 d,再在DM-2培养基培养3 d,进行转分化诱导;同时将胆管类器官在扩增培养基(expansion medium, EM)中培养作为对照。
1.2.3 转录组测序(RNA sequencing, RNA-seq)样品制备及高通量测序:分别收集在EM中培养的类器官(EM组)、在DM中培养的类器官(DM组),以及在DM中培养的Hnf4α敲除的类器官(KO组)样品,每组设置5个生物学重复。用微量样品总RNA提取试剂盒收集细胞并提取细胞总RNA,送诺禾致源公司进行转录组建库及高通量测序。
1.2.4 转录组测序数据分析:以Gapdh为内参基因计算基因相对表达量。用DESeq2分别对DM组和EM组,KO组和DM组的RNA-seq数据进行差异表达分析,筛选差异表达基因的标准为|log2FC|>1,且校准后P<0.05。用clusterProfiler软件中的enrichGO对差异表达基因进行GO分析并去冗余,用gseaKEGG做通路富集分析。在Hnf4α敲除后下调的差异表达基因中,用Rcistarget基于Motif分析识别与Hnf4α有直接调控关系的基因作为候选靶基因。
1.2.5 单细胞转录组测序数据分析:从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)下载小鼠胎肝多时间点的scRNA-seq数据(GSE90047),每百万条读长的转录本(transcripts per million, TPM)标准化后,用prcomp做主成分分析(principal component analysis, PCA),取主成分1(principal component 1, PC1)的loading值前200的基因做后续分析。GSA数据库(https://ngdc.cncb.ac.cn/gsa/)下载小鼠胎肝多时间点的scRNA-seq数据(CRA002445),用Cell Ranger整理fastq数据为表达矩阵,Seurat进行聚类、归一化、降维、分群等处理,根据标记基因注释细胞类型,每个时间点抽取1 000个肝细胞/肝母细胞用于后续分析。用pySCENIC预测胎肝发育过程中的regulon,从Hnf4α的regulon中提取其下游靶基因作为候选靶基因。
2 结果
2.1 胆管类器官转分化体系的验证
经过分离培养,单个细胞自组织形成3D类器官,该类器官呈现囊性结构(图1)。EM组类器官表达Lgr5等干细胞标志基因(图2)。

EM.intrahepatic cholangiocyte organoid cultured in expansion medium; KO.intrahepatic cholangiocyte organoid cultured differentiation medium after Hnf4α knockout

EM.intrahepatic cholangiocyte organoid cultured in expansion medium
EM组表达胆管标志基因,如Spp1和Cftr,不表达肝细胞标志基因,如Apoa1、Ttr和Mup20。相较于EM组,DM组类器官中胆管标志基因的表达降低,肝细胞标志基因表达升高。KO组类器官中胆管标志基因的表达与DM相近,肝细胞标志基因的表达低于DM组而高于EM组(图3)。

DM.intrahepatic cholangiocyte organoid cultured in differentiation medium; EM.intrahepatic cholangiocyte organoid cultured in expansion medium; KO.intrahepatic cholangiocyte organoid cultured differentiation medium after Hnf4α knockout; ICOs.intrahepatic cholangiocyte organoids
2.2 小鼠胆管类器官转分化过程中基因表达的变化趋势与小鼠胎肝发育一致
胎肝的主成分分析中,主成分1(PC1)方向与分化方向一致(图4A)。PC1载荷值(loading)绝对值最大的200个基因的热图显示,在分化过程中,载荷值为负值的基因随着胎肝发育表达量下降,而正值的基因随着胎肝发育表达量上升(图4B)。
比较这200个基因在DM组与EM组差异分析中的log2FC值与载荷值的正负方向,84.14% 载荷值为负值的基因,log2FC也为负值,即在胆管类器官的转分化过程中表达量下降(图4C);83.87%载荷值为正值的基因,log2FC也为正值,即在转分化过程中表达量上升(图4D)。
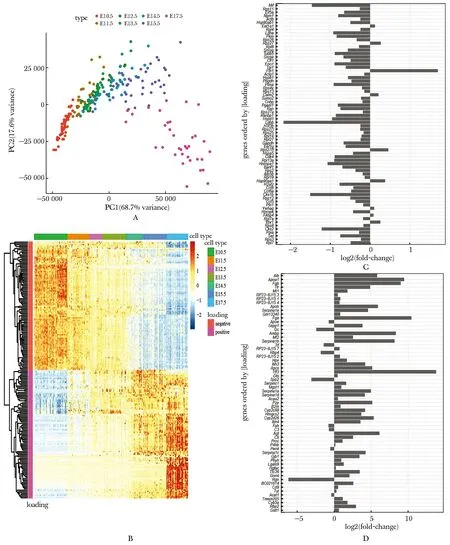
A.principal component analysis of hepatocyte/hepatoblastic during fetal liver development; B.heatmap showed the expression of top 200 variable genes; C.log2FC value of the genes whose loading values were negative; D.log2FC value of the gene with positive loading values
2.3 胆管类器官分化过程中的功能变化
DM组与EM组相比筛选出3 382个差异基因,包括1 694个表达下调的差异基因和1 688个表达上调的差异基因(图5)。

图5 胆管类器官(ICO)分化过程中的差异表达基因Fig 5 Volcano plot of differentially expressed genes during intrahepatic cholangiocyte organoid (ICO) differentiation
DM组与EM组相比,下调的差异基因主要富集在核分裂、染色体分离、细胞周期和DNA复制等生物学过程。上调的差异基因主要富集在脂肪酸、类固醇、烯烃化合物、不饱和脂肪酸、类二十糖苷、花生四烯酸代谢等与肝实质细胞功能密切相关的生物学过程(图6)。

图6 差异表达基因GO 富集分析结果Fig 6 GO enrichment analysis for differentially expressed genes
EM组中细胞周期和DNA复制等相关通路的基因表达上调,DM组中视黄醇和细胞色素P450代谢等相关通路的基因表达上调,这与GO通路富集结果类似(图7)。

A.up-regulated pathways in EM; B.up-regulated pathways in DM
2.4 Hnf4α敲除对类器官分化的影响
Hnf4α敲除组细胞与DM组细胞相比,共筛选出1 429个差异表达基因,包括864个表达下调的差异基因和565个表达上调的差异基因。
Hnf4α敲除后表达下调的差异基因主要富集在脂肪酸、类二十糖苷和烯烃化合物代谢以及上皮细胞增殖等过程。表达上调的差异基因主要富集在纤毛组装和运动等过程(图8)。
2.5 两种分化过程中Hnf4α regulon调控关系的比较
在胆管类器官和小鼠胎肝中分别预测到263个和1 386个Hnf4α正调控的靶基因,其中46个基因为共有靶基因。以小鼠所有基因为背景做显著性检验,共有靶基因P-value为1.8e-16,odds ratio为5,两个靶基因集有显著关联。共有靶基因主要富集在小分子代谢调节、脂质定位、脂肪酸代谢、细胞增殖调控、类固醇代谢和肝脏发育等过程(图9A)。类器官和胎肝中Hnf4α及其共有靶基因的调控网络中,Zfhx4、Igfbp4和Sec16b在类器官中排名靠前,受调控影响大;胎肝中Hnf4α调控转录因子Nr1h3、Tcf7l1、Ppara和Arnt2,并协同调控下游靶基因(图9B, C)。
将类器官中Hnf4α的263个靶基因按照-log2FC值排序,排名前4的靶基因Zfhx4、Igfbp4、Sec16b和Inhba为胎肝共有靶基因(图 9D),在胎肝发育中也随Hnf4α表达量而发生变化,提示类器官中Hnf4α敲除后基因表达影响最大的基因和胎肝发育中的分化一致。以往研究表明,这4个靶基因与增殖发育有关[8-10]。

图 8 Hnf4α敲除后的差异基因GO富集分析Fig 8 GO enrichment analysis for differentially expressed genes upon Hnf4α knockout

A.GO enrichment analysis for overlapped target genes; B.regulatory network of Hnf4α in organoid transdifferentiation; C.regulatory network of Hnf4α in fetal liver development; the thickness of the arrow represents the intensity of regulation (-log2FC); D.the position of overlapped genes in all target genes of organoids, the thickness of the arrow represents the intensity of regulation (importance value)
3 讨论
本研究从基因变化趋势、生物学功能,以Hnf4α为例的regulon调控关系这3个方面,比较了胆管类器官体系和小鼠胎肝发育中的分化过程。
相较于EM组,DM组类器官中胆管标志基因的表达降低,肝细胞标志基因表达升高,表明胆管类器官向肝细胞分化。相较于DM组,KO组中肝细胞标志基因的表达的降低,表明Hnf4α的敲除影响了胆管类器官向肝细胞的分化。
在胆管类器官向肝细胞转分化的过程中,基因表达的变化方向与胎肝发育一致。随胎肝发育过程表达量发生变化的基因中包含多个肝细胞标志基因,如Alb、Apoa1,Ttr等,在类器官转分化过程中其表达变化趋势与胎肝发育总体一致。
在胆管类器官分化前后差异基因的功能富集分析结果中,胆固醇、脂质和细胞色素P450等代谢相关通路的基因在DM组中表达上调,这与以往研究相符[11],表明该转分化体系能够将胆管类器官转分化为类肝细胞;而DM组中细胞周期、DNA复制等基因的下调,与分化体系中DAPT 的添加有关[12]。
在类器官分化体系中,Hnf4α敲除后下调基因富集在与肝细胞功能密切相关的代谢过程,表明Hnf4α敲除抑制了胆管类器官向肝细胞分化和成熟,这与Hnf4α敲除小鼠肝内脂质堆积,血清胆固醇和三酰甘油水平降低,脂质代谢和转运紊乱相符[13]。
类器官转分化体系与胎肝发育过程中Hnf4α的下游靶基因部分重合,特别是类器官中Hnf4α敲除后对下游靶基因影响最大的基因,提示胆管类器官转分化与胎肝发育中的分化具有一定的相似性。
本研究从全转录组层面,描绘了小鼠胆管类器官转分化过程中的基因表达、功能变化和调控关系,并与小鼠胎肝发育分化进行比较。结果表明,胆管类器官转分化可以部分模拟胎肝发育中肝实质细胞的分化过程,为胆管类器官转分化模型用于研究肝发育过程提供了基础。

